Введение
Хроническая обструктивная болезнь легких (ХОБЛ) является гетерогенным заболеванием, при котором происходит ограничение воздушного потока, связанное с иммуновоспалительной реакцией в легких [1]. Воспалительные реакции влияют на гомеостаз протеаз, способствуя усиленной деградации внеклеточного матрикса, что приводит к прогрессирующей альвеолярной деструкции и ремоделированию дыхательных путей [2]. К медиаторам воспаления, участвующим в патогенезе ХОБЛ, относятся матриксные металлопротеиназы (ММП) [3]. ММП разрушают внеклеточный матрикс и имеют сложные взаимоотношения с цитокинами, хемокинами, рецепторами адгезии, факторами роста и их рецепторами [4, 5]. Матриксная металлопротеиназа-9 (ММП-9) представляет собой разрушающую коллаген ММП IV типа, секретируемую в легких нейтрофилами, альвеолярными макрофагами, бронхиальными эпителиальными клетками и эозинофилами [6, 7]. ММП-9 играет важную роль в усилении воспалительного процесса, обмене матрикса и восстановлении легких [8]. Его активность регулируется тремя способами: транскрипцией, протеолитической активацией формы зимогена и ингибированием активного фермента [4, 9]. Воспаление и деструкция легочной ткани усиливаются за счет синергетического действия протеиназ и активных форм кислорода [10]. Доказано, что прооксиданты могут активировать проферментную форму ММП и впоследствии инактивировать ММП для достижения гомеостатического баланса в пораженной ткани [11]. Тканевой ингибитор ММП (ТИМП-1) представляет собой ингибитор ММП-9, который связывается с предшественниками и с активной формой ММП-9. Нарушение регуляции и дисбаланс между активностью протеаз и ингибиторов протеаз имеют значение для патогенеза ХОБЛ. Ограничение потока выдоха при ХОБЛ возникает из-за эмфиземы и разной степени выраженности поражения дыхательных путей (ремоделирование, разрушение альвеолярных перегородок, уменьшение эластичности) [12]. Текущий диагноз и классификация ХОБЛ в значительной степени зависят от степени ограничения выдоха, определяемого спирометрическим измерением объема форсированного выдоха за 1-ю секунду (ОФВ1). Спирометрия является «золотым» стандартом для точных и воспроизводимых измерений функции легких [13]. Гиперинфляция легких является важным клиническим феноменом и связана с ограничением скорости выдоха.
Цель исследования: определение сывороточных уровней MMP-9 и TIMP-1 у пациентов с ХОБЛ и оценка их ассоциации с тяжестью симптомов ХОБЛ.
Методы
Проведено проспективное исследование, в которое были включены 96 пациентов с ХОБЛ, госпитализированных в пульмонологическое отделение ГКБ № 20 Воронежа с мая 2021 по январь 2023 г., средний возраст составил 68,1±1,4 года; нынешние курильщики – 36,5%: индекс курящего человека – ИКЧ=37 (10–54) пачек/лет, бывшие курильщики – 63,5%: ИКЧ=28 (5–43) пачек/лет. Для определения референсных значений изучаемых показателей (ММП-9, ТИМП-1 и их соотношения) была изучена контрольная группа, которую составили 40 лиц в возрасте 65,1±1,2 года без хронических заболеваний, инфекционных состояний, которые могли бы влиять на воспалительный статус.
Критерии включения: 1) подписанное информированное согласие на участие в исследовании; 2) возраст старше 45 лет; 3) диагноз ХОБЛ II степени (GOLD) выставлен не менее чем за 6 месяцев до исследования; 4) по крайней мере одно измерение спирометрии за последний год с бронхолитиком, 5) ОФВ1/ФЖЕЛ (форсированная жизненная емкость легких) <0,70; 6) отсутствие обострений в течение минимум 4 недель до включения в исследование.
Критерии исключения: 1) диагноз астмы или любого другого хронического респираторного заболевания; 2) иммуносупрессия любой формы 3) острое или хроническое состояние, ограничивающее возможность пациента участвовать в исследовании.
Всем больным ХОБЛ проводили ингаляционную терапию и учитывали число обострений в предшествовавшем году. Симптомы оценивались по модифицированной шкале одышки Совета медицинских исследований (mMRC) и оценочному тесту ХОБЛ (CAT) [14]. Обострение ХОБЛ определяли как острое ухудшение респираторных симптомов, приводящее к необходимости дополнительной терапии. Частыми считали 2 и более обострений ХОБЛ в год [15].
Текущий курильщик определялся как человек, который курит либо каждый день (ежедневный курильщик), либо в настоящее время, но не каждый день (иногда или не каждый день) [16]. Бывший курильщик – человек, выкуривший за свою жизнь более 100 сигарет, но не куривший в течение последних 12 месяцев.
Всем пациентам был проведен забор крови и определение сывороточных уровней MMП-9 и TIMП-1 с интервалом не менее 4 недель после предшествовавшего обострения ХОБЛ.
Проводили общий анализ крови (ОАК) с определением числа лейкоцитов и лейкоцитарной формулы. После сбора цельной крови образцы хранили при комнатной температуре в течение 30 минут, а затем центрифугировали при 1000×g в течение 10 минут. Образцы сыворотки разливали в пробирки по 0,5 мл и хранили при температуре -80°C до анализа. ММП-9 и ТИМП-1 измеряли с использованием наборов для твердофазного иммуноферментного анализа (ELISA) в соответствии с инструкциями производителя.
Проведение и интерпретация рутинных легочных функциональных тестов проводились в соответствии с современными рекомендациями [17].
Спирометрию выполняли на КМ-АР-01 «Диамант спирограф» (Россия). Анализируемые параметры: ОФВ1, ФЖЕЛ, соотношение ОФВ1/ФЖЕЛ.
Базы данных пациентов формировались с помощью электронных таблиц Excel MS Office, 2010, статистический анализ проводили с использованием программ Statistica, 10.0. Количественные данные представлены как медиана (Ме), Q25% и Q75% (25-й и 75-й процентили), а также непрерывные значения как M±SD, где М – среднее значение, SD – стандартное отклонение. Качественные переменные представлены в виде частоты встречаемости (%). Качественные переменные сравнивали с помощью χ2-критерия. Сравнение количественных переменных при нормальном распределении признака проводили с помощью t-критерия Стьюдента, а в случае отличия распределения от нормального – с помощью критерия рангов Вилкоксон для зависимых переменных и U-теста Манна–Уитни для независимых групп. Для изучения связей между признаками применяли корреляционный анализ с использованием непараметрического критерия Спирман и линейный регрессионный анализ. Все статистические тесты были выполнены с использованием уровня значимости р<0,05.
Результаты
Основные демографические данные, уровни ММП-9 и ТИМП-1 в сыворотке, а также соотношение ММП-9/ТИМП-1 представлены в табл. 1.
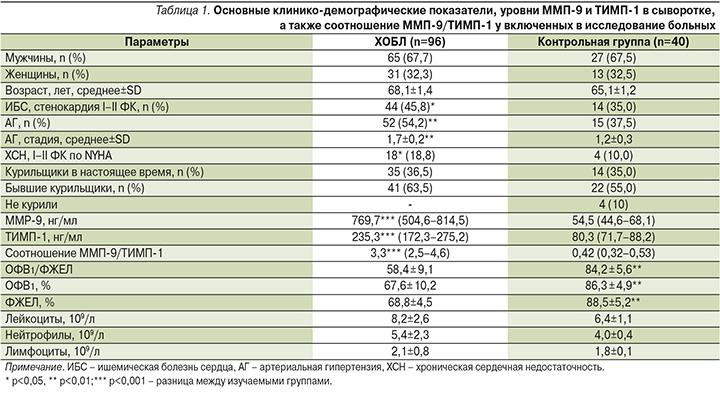
По демографическим показателям группы были сопоставимы между собой, однако пациенты с ХОБЛ чаще имели ИБС, стенокардию I–II функциональных классов – ФК (р<0,05), ХСН I–II ФК (р<0,05), АГ (р<0,01), более высокую степень АГ (р<0,01). Показатели ММП-9 (p≤0,001), ТИМП-1 (p ≤0,001) и их соотношение (p≤0,001) были значительно выше у пациентов с ХОБЛ, чем у лиц контрольной группы. Пациенты с ХОБЛ имели среднюю продолжительность заболевания 10 (7,0–12,0) лет, оценку CAT – 14,9 (7,4–18,7), mMRC – 2,0 (1,0–3,0), уровень С-реактивного белка (СРБ) – 3,4 (2,4–4,6) мг/л. В общем анализе крови у больных ХОБЛ число лейкоцитов (21,9%; р<0,01), нейтрофилов (25,9%; р<0,01), лимфоцитов (14,3%; р<0,05) было достоверно выше, чем у лиц контрольной группы.
На втором этапе исследования пациенты с ХОБЛ были рандомизированы в группы в зависимости от выраженности клинических симптомов и числа обострений в год. Результаты представлены в табл. 2.
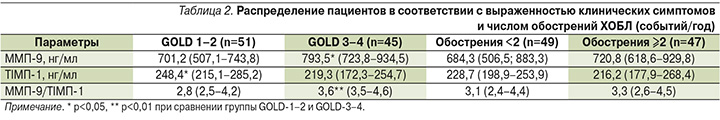
Установлено, что уровень ММП-9 (11,6%; р<0,05) и соотношение ММП-9/ТИМП-1 (19,4%; р<0,01) были статистически выше у пациентов с ХОБЛ на стадии GOLD-3–4, при этом уровень ТИМП-1 в сыворотке крови был ниже (11,7%; р<0,05). Как ММП-9, так и соотношение ММП-9/ТИМП-1 были выше у пациентов с обострением ХОБЛ≥2, но не достигли статистической достоверности.
Нами проведены определение корреляционной зависимости показателей ММП-9, ТИМП-1 и их соотношение с изучаемыми показателями больных ХОБЛ. Результаты представлены в табл. 3.
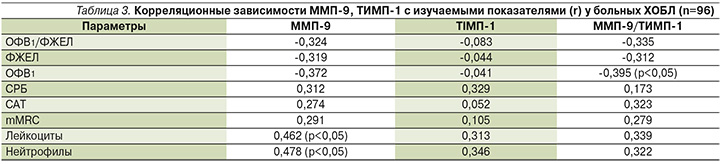
Выявлены отрицательные корреляционные связи между ММП-9, соотношением ММП-9/ТИМП-1 с параметрами спирометрии: ФЖЕЛ, ОФВ1, ОФВ1/ФЖЕЛ (p<0,05). Корреляции между сывороточным уровнем TIMП-1 и изучаемыми параметрами спирограммы обнаружено не было. Установлена положительная корреляция показателей CAT и mMRC с MMП-9 и соотношением MMП-9/TIMП-1 (p<0,05). MMП-9 и TIMП-1 были положительно связаны с CРБ (p<0,05). MMП-9, TIMП-1 и соотношение MMП-9/TIMП-1 были положительно связаны с числом лейкоцитов и нейтрофилов (p<0,05).
Обсуждение
Хроническое воздействие табачного дыма вызывает окислительный стресс и воспаление дыхательных путей, что приводит к нарушению регуляции активности протеаз, деградации внеклеточного матрикса, прогрессирующей альвеолярной деструкции и ремоделированию дыхательных путей со значительными функциональными нарушениями и необратимой потерей функции легких. Ремоделирование дыхательных путей включает структурные изменения, вызванные длительным воспалением дыхательных путей, что является отличительной чертой патогенеза ХОБЛ [18].
В проведенном нами исследовании определено содержание MMП-9, TIMП-1 и соотношение MMП-9/TIMП-1 в сыворотке крови больных ХОБЛ II степени в зависимости от выраженности клинических симптомов и числа обострений в год. На первом этапе исследования установлено, что сывороточные значения MMП-9 и TIMП-1, а также соотношение MMП-9/TIMП-1 были значительно выше у пациентов с ХОБЛ, чем у лиц контрольной группы, что свидетельствует о нарушении соотношения процессов синтеза и деградации коллагена у больных ХОБЛ. В мета-анализе, опубликованном Y. Li et al. (2016), включившем результаты обследования 923 пациентов с ХОБЛ и 641 здорового лица, значения ММП-9 и ТИМП-1 в сыворотке были выше у пациентов с ХОБЛ, чем у здоровых людей [19]. В исследовании I. Gilowska et al. (2018) пациенты с ХОБЛ имели более высокие значения как MMП-9, так и соотношение MMП-9/TIMП-1, чем лица контрольной группы [20]. Исследование, проведенное Линдером и соавт., выявило более высокие значения ММП-9 у пациентов с ХОБЛ, значительную корреляцию с продуктивным кашлем и снижением ОФВ1, что согласуется с полученными нами результатами [21]. S.R. Arbaningsih et al. (2019) установили, что уровни ММП-9 при ХОБЛ были достоверно (р=0,003) выше по сравнению с таковыми у курильщиков и здоровых некурящих, тогда как уровни TИМП-1 у курильщиков были достоверно (р<0,001) ниже по сравнению с таковыми при ХОБЛ и у некурящих [22]. В исследовании, проведенном P. Piesiak et al., уровни ММП-9 и ТИМП-1 в сыворотке были выше у пациентов с ХОБЛ, чем у здоровых людей, и оба биомаркера коррелировали с уровнем СРБ и ОФВ1, что соответствует результатам нашего исследования [23].
Однако уровни ММП-9 в сыворотке и соотношение ММП-9/ТИМП-1, по-видимому, связаны с ХОБЛ. Несколько исследований, в которых изучалась потенциальная роль ММП-9 при ХОБЛ, продемонстрировали повышенный уровень ММП-9 в средах, отличных от сыворотки: мокроте [24, 25], жидкости бронхоальвеолярного лаважа [26] и плазме [27, 28]. Потенциальную роль MMП-9 оценивали в зависимости от состояния болезни, будь то стабильное или обострение ХОБЛ. В исследовании, проведенном J.M. Wells et al., повышенный уровень ММП-9 в плазме был независимо связан с риском обострения ХОБЛ [29]. Ю.С. Панасенкова и соавт. (2015) продемонстрировали, что дисбаланс оксидантов/антиоксидантов был значительно выражен у пациентов с обострением ХОБЛ [30].
Кроме того, мы оценили связь ММП-9 и ТИМП-1 с параметрами функции легких и обнаружили отрицательную корреляцию между уровнем ММП-9 в сыворотке и соотношением ММП-9/ТИМП-1 и спирометрическими параметрами ОФВ1/ФЖЕЛ, ФЖЕЛ и ОФВ1. В исследовании российских ученых В.А. Невзоровой и соавт. более низкие значения ОФВ1 коррелировали с повышенными уровнями в сыворотке ММП-9, соотношением ММП-9/ТИМП-1 и ТИМП-1, что свидетельствовало о тяжести нарушения функции нижних дыхательных путей [31]. Нам не удалось найти корреляцию между сывороточным TIMP-1 и каким-либо параметром функции легких, что может быть связано с возрастом участников (старше 65 лет) и тем фактом, что уровень ТИМП-1 в сыворотке зависит от возраста.
В нашем исследовании уровень ММП-9 значительно увеличивался с увеличением тяжести обструкции дыхательных путей, а уровень ТИМП-1 изменялся незначительно, что свидетельствует о дисбалансе между протеазами и ингибиторами протеаз, приводящем к усилению протеолитической активности, и указывает на важность соотношения ММП-9/ТИМП-1 как потенциального биомаркера ремоделирования дыхательных путей и развития ХОБЛ. В нашем исследовании циркулирующие лейкоциты и нейтрофилы положительно коррелировали с уровнями ММП-9 и ТИМП-1 в сыворотке и соотношением ММП-9/ТИМП-1, а также положительно коррелировали с числом событий обострения ХОБЛ. Поскольку ХОБЛ ассоциирована с системным воспалением, в исследовании S. Bchir et al. (2017) был поставлен вопрос о связи курения с сывороточными уровнями ММП-9 у пациентов с ХОБЛ. Результаты данного исследования свидетельствуют о том, что уровни MMP-9 в сыворотке крови могут отражать состояние системного воспаления при ХОБЛ, связанное с курением сигарет [32].
Пациенты с ХОБЛ имели больше симптомов и более выраженную одышку, по данным mMRC и CAT. Мы обнаружили значительную связь между MMП-9, соотношением MMП-9/TIMП-1 и показателями mMRC и CAT, но не с числом зарегистрированных случаев обострения ХОБЛ в предыдущем году. Если все принять во внимание, возможно, что больные ХОБЛ с более стабильным фенотипом, которые не страдают частыми обострениями, но имеют повышенную одышку и выраженность симптоматики, имеют большую протеолитическую активность.
Заключение
У пациентов с ХОБЛ повышены сывороточные уровни ММП-9 и ТИМП-1 и соотношение ММП-9/ТИМП-1. У пациентов с ХОБЛ наблюдается дисбаланс между MMП-9 и TIMП-1 в пользу пропротеолитической среды, что в целом указывает на важность соотношения MMП-9/TIMП-1 как потенциального биомаркера для диагностики и тяжести ХОБЛ.
Вклад авторов. Л.В. Васильева – концепция, дизайн исследования, сбор материала. Е.В. Гостева – сбор, обработка материала, написание текста. Е.Ю. Суслова – обработка данных, редактирование текста. Л.Р. Эль-журкаева – статистическая обработка данных. М.А. Золотарева – дизайн исследования.
Дополнительная информация
Публикация статьи осуществляется в рамках диссертационного исследования «Прогностическое значение биомаркеров воспаления и фиброза в течении хронической сердечной недостаточности у больных ХОБЛ».



