Бронхиальная астма (БА) и хроническая обструктивная болезнь легких (ХОБЛ) – наиболее часто встречающиеся в практике интерниста хронические обструктивные заболевания органов дыхания. Диагностические критерии БА и ХОБЛ достаточно подробно изложены в Глобальной стратегии лечения и профилактики бронхиальной астмы (Global Initiative for Asthma-GINA) и Глобальной стратегии диагностики, лечения и профилактики хронической обструктивной болезни легких (Global Initiative for Chronic Obstructive Lung Disease - GOLD) [1, 2].
Целью статьи стало определение диагностических критериев и лечебных мероприятий по отношению к больным с сочетанием двух заболеваний легких: БА и ХОБЛ. Общим для этих заболеваний служит хронический воспалительный процесс бронхолегочной системы, который определяет клиническую картину заболевания, методы диагностики и лечение. И хотя хронический воспалительный процесс является общим для БА и ХОБЛ, он имеет существенные различия, что во многом определяет особенности течения и прогноз заболевания. Так, например, коэффициенты смертности по причине БА и ХОБЛ на 100 тыс. населения в Российской Федерации в 2010 г. составили 1,6 и 20,6 соответственно, т.е. при ХОБЛ почти в 13 раз выше по сравнению с БА [3].
Распространенность БА в разных странах мира колеблется от 1 до 18 % [4]. В Российской Федерации распространенность БА среди взрослого населения, изученная в различных регионах, колеблется от 4,5 до 6,5 % [5–7]. В свою очередь распространенность ХОБЛ, зависящая от возраста, увеличивается c 45 лет и достигает максимума среди лиц старше 60 лет [2]. В связи с высокой распространенностью курения среди подростков в России ХОБЛ молодеет, и если еще несколько лет назад считалось, что клиническая картина ХОБЛ наступает после 45 лет, то в настоящее время все чаще встречаются случаи более раннего наступления развернутых признаков болезни.
Являясь безусловным экзогенным фактором риска ХОБЛ, курение влияет на характер воспаления у больных не только ХОБЛ, но и БА. Установлено, что у курящих больных БА отмечается гиперпродукция бронхиальной слизи, преобладает нейтрофильное воспаление, сопровождающееся низкой эффективностью к глюкокортикостероидам (ГКС) [8]. Кроме того, у значительной части больных БА независимо от тяжести (от 63,5 до 69,9 %) могут определяться признаки поражения мелких бронхов с формированием «воздушных ловушек», характерные для ХОБЛ [9].
Несмотря на некоторые клинико-цитологические сходства между курящими больными БА и пациентами ХОБЛ, у курящих больных БА не определяется характерное для ХОБЛ повышение маркеров системного воспаления (фактора некроза опухоли-α и интерлейкина-8), их отличают более стабильные спирометрические показатели [10].
Типичными нарушениями показателей функции внешнего дыхания больных ХОБЛ служат прогрессирующее падение объема форсированного выдоха в первую секунду (ОФВ1), соотношение ОФВ1/форсированной жизненной емкости легких < 70 %, неполная обратимость бронхиальной обструкции, снижение емкости вдоха, сопровождающиеся увеличением остаточного объема и общей емкости легких (признаки гиперинфляции) и поражением мелких бронхов с синдромом «воздушных ловушек», определяемым компьютерной топографией высокого разрешения [2].
Установлено, что курящие люди, страдающие с детства БА, имеют иные клинические проявления заболевания по сравнению с больными ХОБЛ без указаний в анамнезе на БА. Распространенность такого фенотипа не известна, но есть данные, что он проявляется у 13 % пациентов с генетической предрасположенностью к ХОБЛ [11]. Эпидемиологические исследования, проведенные в ряде стран, показали, что распространенность сочетания БА и ХОБЛ у одного пациента среди больных БА и ХОБЛ составляет 4,3 % в США, 5,0 % в Германии, 6 % в Италии [12, 13]. Soriano и соавт. [14] установили, что приблизительно 23 % больных ХОБЛ в возрасте 50–59 лет могут иметь смешанный фенотип «Астма–ХОБЛ» с нарастанием частоты в пожилом возрасте около 50 % в возрасте 70 лет и старше. Существование такого фенотипа, уже описанного в Канадских [15] и Японских [16] рекомендациях, подтверждается положительным эффектом назначения ингаляционных глюкокортикостероидов (ИГКС) [17, 18].
Наличие аллергического ринита, бронхиальной гиперреактивности, «свистящего дыхания», повышение IgE в плазме крови у больных ХОБЛ указывают на сочетание у них БА и ХОБЛ, что получило название «overlap»-синдрома, или фенотипа «Астма–ХОБЛ» [19]. Чаще всего ХОБЛ присоединяется к БА, а не наоборот.
В любом случае при присоединении второго заболевания наблюдается ухудшение состояния здоровья. «Overlap»-синдром определен как наличие неполной обратимости ограничения дыхательного потока в сочетании с положительным тестом на обратимость бронхиальной обструкции [20, 21] или как диагноз ХОБЛ у пациентов с наличием БА в анамнезе до 40 лет [22]. У таких пациентов имеются симптомы двух болезней, что создает трудности при постановке диагноза на уровне первичного звена [23].
В таких случаях смысл проведения дифференциальной диагностики утрачивается, а диагностируются оба заболевания. При присоединении ХОБЛ прослеживается длительное воздействие факторов риска ХОБЛ (курение, профессиональные или бытовые вредности у больных БА).
Клинические особенности смешанного фенотипа «Астма–ХОБЛ» [24]: как правило, это пациент старше 40 лет с клинико-функциональными параметрами ХОБЛ, у которого ранее (чаще до 40 лет) диагностировалась БА; ХОБЛ при смешанном фенотипе развивается в более молодом возрасте при меньшей продолжительности и интенсивности курения; смешанный фенотип протекает более тяжело и с большей частотой обострений, чем изолированные заболевания БА и ХОБЛ.
Присоединением ХОБЛ к БА следует считать ситуацию, когда у больного с контролируемыми симптомами астмы и малой вариабельностью пиковой скорости выдоха сохраняется низкий показатель ОФВ1 с возможным положительным бронходилатационным ответом. Присоединение БА к ХОБЛ встречается значительно реже. В этом случае появляется ранее отсутствовавшая волнообразность клинических симптомов, связанных с бронхиальной обструкцией, возникают эпизоды ночных и/или в ранние утренние часы приступов малопродуктивного кашля, удушья, сопровождающиеся ощущением «свистящего» дыхания и потребностью применения короткодействующих бронходилататоров.
У больных, страдающих сочетанной патологией «Астма–ХОБЛ» («overlap»-синдром), отмечается прогрессирование дыхательной недостаточности, уменьшается эффективность ИГКС, ранее обеспечивающих хороший эффект, снижается переносимость физической нагрузки и качество жизни.
К особенностям «overlap»-синдрома кроме клинических симптомов и функциональных относится различный ответ на базисную терапию ИГКС. Установлено, что пациенты с ХОБЛ и эозинофильным обострением имеют повышенную концентрацию эозинофилов в периферической крови даже в период стабильного течения [25, 26]. Ингаляционные глюкокортикостероиды уменьшают выраженность клинических симптомов и частоту обострений [27, 28]. При обострении заболевания наблюдается положительный ответ на системные ГКС по сравнению с плацебо. В случае преимущественно нейтрофильного характера обострения ответ на системные ГКС значительно слабее как при эозинофильном обострении, так и при сравнении с плацебо [29].
Безусловно, важная роль независимо от тяжести бронхиальной обструкции в лечении хронических бронхообструктивных заболеваний принадлежит назначению ингаляционных бронходилататоров в соответствии с рекомендациями по лечению БА и ХОБЛ. Для определения объема базисной терапии больных сочетанными заболеваниями БА + ХОБЛ обратимся к основополагающим документам GINA и GOLD [1, 2].
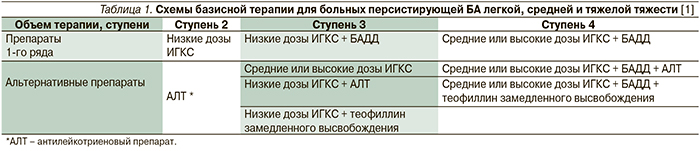
Для больных персистирующей БА средней и тяжелой тяжести, не получающих базисную терапию, препаратами первого ряда являются ИГКС + β2-агонисты длительного действия (БАДД). Согласно консенсусу «GINA, 2011», объем базисной терапии больных БА определяется в соответствии с контролем над течением заболевания [1]. Легкая персистирующая БА – это БА, контроль которой может быть достигнут при небольшом объеме терапии (ступень 2). Бронхиальная астма средней тяжести и тяжелая – это астма, для контроля которой необходим объем терапии, соответствующей третьей и четвертой ступеням по GINA, или БА, над которой не удается достичь контроля, несмотря на назначенную базисную терапии [1]. Схемы базисной терапии больных персистирующей БА легкой, средней и тяжелой тяжести представлены в табл. 1.
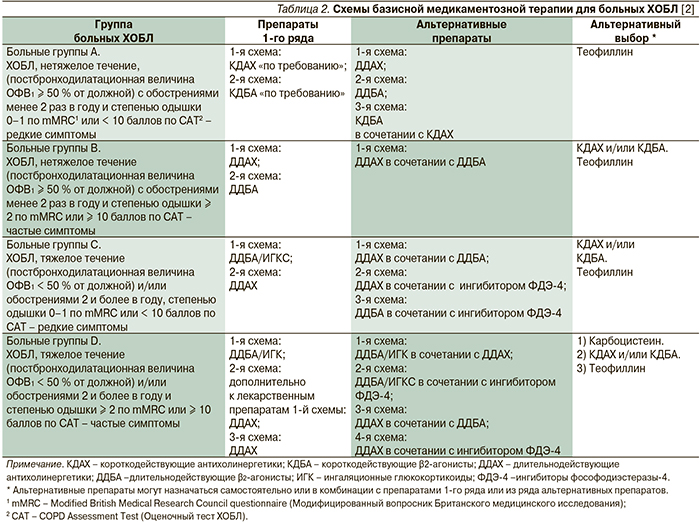
Лекарственная терапия ХОБЛ предназначена для предупреждения и контролирования симптомов, уменьшения частоты и тяжести обострений, улучшения состояния здоровья и переносимости физической нагрузки. Основой базисной терапии ХОБЛ являются ингаляционные длительнодействующие антихолинергетики (ДДАХ) и БАДД, которые достоверно улучшают ОФВ1 и легочные объемы, оказывают положительное действие на больных нарушением дыхания, улучшают показатели качества жизни и снижают частоту обострений (уровень доказательности А).
В базисной терапии ХОБЛ тяжелого течения в качестве препаратов первого ряда предусмотрена комбинированная терапия ИГКС и БАДД, способная снижать смертность среди больных ХОБЛ (уровень доказательности В). Схемы базисной медикаментозной терапии больных ХОБЛ даны в табл. 2.
В случае фенотипа «Астма–ХОБЛ» медикаментозная терапия занимает важное место, при этом, как и в случаях диагностики каждого заболевания (БА и ХОБЛ), требуется обязательное использование программ отказа от курения, реабилитационных мероприятий, физических упражнений, лечение сопутствующей патологии, применение хирургических методов к некоторым пациентам.
Безусловно, объем базисной терапии больных фенотипом «Астма–ХОБЛ» зависит от тяжести заболевания и контроля над течением заболевания.

В табл. 3 отражены сводные данные Испанского общества пульмонологов и торакальных хирургов 2012 г. (Consensus document of Spanish Society of Pulmonologists and Thoracic Surgeons – SEPAR) по лечению больных смешанным фенотипом «Астма–ХОБЛ» [24].
У больных фенотипом «Астма–ХОБЛ» независимо от выраженности клинических симптомов и функциональных нарушений следует учитывать наличие БА, что требует включения в базисную терапию ИГКС. Препаратами 1-го ряда в базисной терапии БА, для которой необходим объем терапии соответствующей 3-й и 4-й ступеням, являются ИГКС в сочетании с ДДБА. В свою очередь ДДБА являются препаратом выбора для базисной терапии ХОБЛ нетяжелого течения (постбронходилатационная величина ОФВ1 ≥ 50 % от должной с обострениями менее двух в году) (группы А и В по GOLD, 2013). Пациентам с фенотипом «Астма–ХОБЛ» при тяжелом течении ХОБЛ (постбронходилатационная величина ОФВ1 < 50 % от должной и/или два и более обострения в году) с учетом БА в качестве базисной терапии требуется назначение либо ИГКС + ДДБА, либо «тройной» терапии ИГКС + ДДБА + ДДАХ в зависимости от выраженности симптомов ХОБЛ, определенных в соответствии с рекомендациями GOLD, 2013 [2]. Схема базисной терапии больных различными по тяжести фенотипами «Астма–ХОБЛ» может быть представлена следующим образом (табл. 4).
Следовательно, независимо от тяжести БА больным фенотипом «Астма–ХОБЛ» в качестве базисной терапии требуется назначение комбинации ИГКС и БАДД. Больным «overlap»-синдромом при тяжелом течении ХОБЛ с частыми обострениями рекомендуется «тройная» базисная терапия, включающая ИГКС + БАДД и ДДАХ.


