Актуальность
Acne vulgaris – наиболее распространенное хроническое воспалительное заболевание сальных желез, имеющее мультифакторный иммунозависимый патогенез. Этим заболеванием страдают до 80–90% населения различных возрастов; пик заболеваемости приходится на 16–20 лет. С учетом распространенности и большой социальной значимости Acne vulgaris, значительно влияющего на качество жизни, непрерывно ведутся углубленные исследования по изучению патогенеза этого заболевания и совершенствованию терапии. Некоторые исследователи связывают развитие акне с инсулинорезистентностью [1]. Для развития акне имеют значение нарушения диеты [2]. Проявления акне вызывают депрессию, тревожность, нарушения межличностных взаимоотношений [3]. Недостаточная эффективность лечения, ассоциированные с данной нозологией аффективные расстройства, такие как дисморфофобия и депрессия, существенно снижающие качество жизни больных и способствующие их дезадаптации, обусловливают медико-социальную значимость проблемы [4].
В плане дифференциального диагноза Acne vulgaris главными нозологиями выступают розацеа, стероид-индуцированные акне, демодикоз, бактериальный, эозинофильный фолликулит, псевдофолликулит, фолликулярная Т-клеточная лимфома кожи, папулонекротический туберкулез [5].
Выбор методов терапии акне определяется тяжестью клинических проявлений. Препараты наружного применения (третиноин, адапален, бензоилпероксид, клиндамицин, эритромицин, α-гидроксикислоты, средства, содержащие салициловую кислоту, серу, азелаиновую кислоту) назначаются при умеренной тяжести клинических проявлений. В более тяжелых случаях применяются системные препараты (тетрациклин, доксициклин, азитромицин, ко-тримоксазол). Системный изотретиноин (СИ) назначается при риске развития рубцов. В случаях, ассоциированных с гормональными нарушениями, применяются андрогены, эстрогены, спиронолактон, дексаметазон.
Дополнительные методы лечения акне включают комедоноэкстракцию, химический пилинг и микродермабразию, внутрикожные инъекции кортикостероидов для лечения кист, высокоинтенсивную узкополосную фотодинамическую терапию синим светом, а также введение филлеров и лазерную шлифовку для удаления рубцов [6, 7].
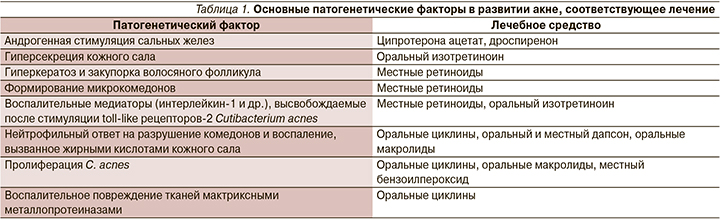
W. Sinclair [5] в 2017 г. проводил анализ основных патогенетических факторов в развитии акне и соответствующего им лечения (табл. 1).
Применение системных ретиноидов в дерматологии
Ретиноиды являются ключевым препаратом в терапии акне [8]. Если в 1980-е гг. назначение системных ретиноидов ограничивалось узловатокистозными вариантами, то сейчас оно включает случаи умеренных акне, резистентных к лечению местными ретиноидами и антибиотиками, а также при склонности к формированию рубцов. По данным Е.А. Ильичевской и соавт. (2017), применение СИ в терапии пациентов с экскориированными формами акне приводит к клинической ремиссии заболевания, за счет чего при своевременном назначении данного вида терапии можно ожидать снижения показателей личностной тревожности и вероятности развития депрессии [9].
Пероральный изотретиноин (13-цис-ретиноевая кислота) представляет собой ретиноид, полученный из витамина А. Он был синтезирован в 1955 г., а с 1973 г. начались исследования его применения при псориазе, генетических нарушениях ороговения, кистозных акне и базально-клеточном раке. В 1980-х гг. он стал наиболее эффективным методом лечения узелково-кистозных угрей и в настоящее время показан при умеренных формах, устойчивых к другим методам лечения. Клиническая эффективность перорального изотретиноина превосходит другие методы лечения акне, способствуя излечению или длительной ремиссии, улучшая качество жизни и уменьшая психосоциальный ущерб.
В настоящее время спектр клинического применения ретиноидов непрерывно расширяется.
СИ может являться эффективным методом терапии стойкой папулопустулезной, эритематозно-телеангиэктатической форм розацеа, а также ринофимы. Наиболее эффективна доза в 20 мг в сутки, или 0,3 мг/кг в сутки, на период приема от 6 от 10 месяцев; дозировка может быть скорректирована к концу 4-го месяца терапии. Продолжительный прием микродоз СИ рассматривается как профилактика рецидивов заболевания [10, 11]. При фульминантной розацеа предложенные схемы лечения часто включают короткий курс преднизолона (40–60 мг/сут в течение 1–2 недель с дальнейшим снижением дозы) для уменьшения воспалительных процессов, сопровождающийся медленным включением изотретиноина (0,2–0,5 мг/кг/сут с возможным увеличением дозы до 0,5–1 мг/кг/сут) от 3 до 4 месяцев, пока не наступит выздоровление или суммарная доза не достигнет 150 мг/кг [12].
Ранний успех использования СИ при болезни Девержи продемонстрирован в многоцентровом исследовании, в ходе которого отмечено улучшение у 43 из 45 пациентов, получавших высокие дозы изотретиноина (2,13 мг/кг в день). Трое из 5 пациентов достигли хорошего клинического эффекта на дозе 2,0 мг/кг в день [13]. В исследовании с участием 475 пациентов изотретиноин привел к хорошему ответу 61%, этретинат – 47%, ацитретин – 24% пациентов. Авторы предположили, что препаратом первой линии могут стать СИ, за которым следуют метотрексат и иммунобиологические препараты [14].
В литературе сообщается, что СИ являются эффективным вариантом лечения стойких к терапии случаев подострой кожной формы красной волчанки (SCLE), дискоидной красной волчанки (DLE) и хронической кожной красной волчанки (CCLE), показав такую же эффективность, как и другие методы лечения, включая гидроксихлорохин. СИ может назначаться в дозе от 0,2 до 1 мг/кг/день с быстрым ответом на проводимое лечение от 2 до 6 недель [15].
Имеются данные об эффективности применения СИ при болезни Дарье с назначением малых доз препарата (0,2 мг/кг/день) с дальнейшим увеличением до 1,0 мг/кг/день. Симптоматическое улучшение часто наступает после 2–4 недель лечения [12].
Исследования показали, что комбинированная терапия СИ в дозе от 0,5 до 1 мг/кг/день до 3 месяцев в сочетании с приемом интерферона-α может быть эффективным методом лечения в случаях устойчивых к терапии остроконечных кондилом [16, 17].
Также общепризнанным подходом к терапии генерализованной кольцевидной гранулемы является назначение СИ в дозе 0,5 мг/кг/день, демонстрирующее полное излечение в период от 2 до 6 месяцев лечения с сохранением ремиссии на срок от 6 месяцев до 1 года после проведенной терапии [18]. Сообщается о некоторых успехах применения СИ при лобной фиброзирующей алопеции (FFA) [12].
Существует опыт лечения СИ себорейного дерматита, пустулезного псориаза, гнойного гидраденита, Т-клеточной лимфомы кожи; сообщается об использовании СИ для коррекции фотостарения, лечения множественного актинического кератоза, абсцедирующего и подрывающего перифолликулита, декальвирующего фолликулита кожи головы [10].
Первоначальными торговыми марками СИ стали Роаккутан® и Акнекутан®, в текущий период существует большое количество генериков. Изотретиноин действует как пролекарство, превращаясь в аллтранс-ретиноевую кислоту (ATRA) в цитоплазме клеток для транспортировки в ядро, где он связывается с ядерным рецептором ретиноевой кислоты (RAR). Эра изучения молекулярных механизмов действия ретиноидов началась в 1987 г. с открытием RAR [19]. RAR типа α преобладают в себоцитах, их стимуляция приводит к апоптозу себоцитов и уменьшению салообразования, а также к развитию ретиноидного дерматита. Другими известными механизмами действия СИ являются нормализация гиперкератинизации выводного протока сальной железы, ингибирование продукции цитокератинов-1, -10 и -14, филаггрина и матриксных металлопротеиназ (MMPs), увеличение цитокератинов-7, -13 и -19, ламинина B1 и ИЛ-1. Влияние на пролиферацию, дифференцировку, апоптоз и обновление клеток в дополнение к иммуномодуляции связаны с регуляцией экспрессии генов, влияющих на ядерные факторы транскрипции. Происходит активация некоторых генов (опухолевых супрессоров или апоптотических, таких как p53 и BAX, и кодирующих выработку коллагена и фибронектина) и ингибирование других (участвующих в метаболизме липидов). При апоптозе ATRA увеличивает экспрессию фактора транскрипции forkhead box O3 (FOXO3), активирует связанный с фактором некроза опухоли путь индуцирующего апоптоз лиганда (TRAIL) и продуцирует каспазы FOXO1, прерывающие клеточный цикл, путем экспрессии генов p21, 27 и 53. Активация путей р53 представляет собой взаимосвязь между сигнальными путями, положительно или отрицательно регулируемыми изотретиноином. Белок BAX индуцирует апоптоз кератиноцитов с мутациями, вызванными ультрафиолетовым излучением; его экспрессия снижается изотретиноином из-за его антиканцерогенного действия.
Изотретиноин – единственный препарат, который самостоятельно воздействует на четыре этиопатогенных фактора акне: он уменьшает гиперкератинизацию выводного протока сальной железы и комедогенез; подавляет себогенез, уменьшая размер и активность сальных желез до 90%; уменьшает популяцию Cutibacterium acnes (C. acnes) из-за изменений в микроокружении фолликулов и модулирует воспаление действием на мембраны рецепторов (TLR-2 и -4) в кератиноцитах, себоцитах, моноцитах, клетках роговицы и иммунных клетках. Эти рецепторы активируются путем идентификации молекулярных структур C. acnes, и при их ингибировании происходит подавление путей ядерного фактора каппа В (NF-kB), который запускает выработку ряда цитокинов (ИЛ-8, -1, -17, IFN) и белка-активатора-1 (AP-1), ответственного за синтез MMPs [12].
Фармакологические эффекты изотретиноина заключаются в нормализации терминальной дифференцировки клеток, торможении пролиферации эпителия протоков сальных желез, образовании детрита, облегчении его эвакуацию; снижается выработка и облегчается выделение кожного сала. Обычные и низкие дозы изотретиноина связаны с повышенной экспрессией дермцидина (антимикробного пептида, секретируемого потовыми железами, который атакует любые бактерии на нашей коже). Снижение концентрации дермцидина в поту пациентов с воспалительными угрями может способствовать пролиферации P. acnes в пилосебиальных единицах, что приводит к прогрессированию воспалительных угрей [20].
Е. Bagatin et al. (2020) [12] приводят сведения о действии СИ на различные клетки (табл. 2).

При приеме внутрь абсорбция препарата изменчивая, биодоступность низкая и вариабельная; прием вместе с пищей повышает биодоступность в 2 раза. Время достижения максимальной концентрации в крови (Tmax) составляет 2–4 часа. Связывание с белками плазмы крови (преимущественно с альбумином) – 99,9%. Метаболизируется с образованием трех основных биологически активных метаболитов: 4-оксо-изотретиноина (основной метаболит), третиноина и 4-оксо-ретиноина, а также менее значимых метаболитов, включающих также глюкурониды. Поскольку in vivo изотретиноин и третиноин обратимо превращаются друг в друга, метаболизм третиноина связан с метаболизмом изотретиноина. 20–30% дозы изотретиноина метаболизируется путем изомеризации. В фармакокинетике изотретиноина у человека существенную роль может играть энтерогепатическая циркуляция. В исследованиях in vitro показано, что в метаболизм изотретиноина вовлечены изоферменты CYP2C8, CYP2C9, CYP3A4 и CYP2B6 цитохрома Р-450. T1/2 изотретиноина – 19 часов, 4-оксо-изоретиноина – 29. Метаболитывыводятсяпочкамиисжелчью примерно в равных количествах. Рекомендуемой дозой изотретиноина для лечения тяжелых акне является 0,5–1 мг/кг/день в течение 4–6 месяцев. Терапия СИ в суточной дозе 0,5–1 мг/кг с достижением кумулятивной дозы 120–150 мг/кг позволяет достигать клинического выздоровления и ремиссии заболевания всем наблюдавшимся пациентам с тяжелыми формами акне, а также способствует повышению качества их жизни (по данным Н.Н. Потекаева и соавт. (2021) [21]). Однако накоплен большой опыт использования режимов низких доз (0,3–0,4 и 0,1–0,3 мг/кг/сут). Лечение рекомендуется прекращать в случае повышения уровня триглицеридов более 400 мг/дл, холестерина более 300 мг/дл, щелочной фосфатазы более 246, аланинаминотрансферазы более 62 и аспартатаминотрансферазы более 80 единиц. G. Faghihi et al. (2017), проведя сравнение двух групп пациентов с акне, пролеченных дозами 0,25 и 0,5 мг/кг/сут, сделали вывод о более высоком уровне удовлетворенности пациентов, получавших низкие дозы. Кроме того, частота осложнений была выше у пациентов, получавших высокие дозы, чем у пациентов, получавших низкие дозы.
Побочные эффекты при приеме СИ наблюдаются у 90% больных. Известны многочисленные побочные эффекты со стороны кожи, ее придатков и слизистых оболочек, тератогенность, влияние на функцию печени и липидный обмен [22]. D. Türkmen (2020) отмечает, что большинство побочных эффектов препарата проявляется признаками, подобными проявлениям гипервитаминоза А [23]. Изотретиноин имеет период полувыведения 22 часа и биоэффективность 25%, а его концентрация в плазме увеличивается при приеме с пищей. Побочные эффекты уменьшаются, когда препарат принимают 2 раза в день. Частота и тяжесть побочных эффектов, за исключением тератогенности, зависят от дозы, и их можно контролировать с помощью дополнительного лечения. Эти побочные эффекты обычно обратимы при прекращении приема лекарства. При появлении серьезных побочных эффектов могут быть назначены более низкие дозы, и в этом случае для достижения кумулятивной дозы требуется более длительный период лечения.
Лабораторные изменения составляют 2% выявленных нежелательных явлений. Наиболее часто в сыворотке крови повышаются уровни триглицеридов (44%), общего холестерина, ЛПНП (33%) и ферментов печени (11%). Нет доказательств того, что эти повышения лабораторных показателей увеличивают сердечно-сосудистый риск [12].
Изотретиноин при пероральном приеме вызывает структурные и физиологические изменения кожи в виде нарушения ее барьерной функции, декогезии корнеоцитов, изменений в липидном составе и микрофлоре кожи [24]. В период лечения изотретиноином и сразу после его окончания запрещены механическая дермабразия, глубокие пилинги, абляционная лазеротерапия, глубокие кожные эксцизии, мышечные лоскуты.
Для лучшей переносимости терапии СИ в текущий период используются нутрициологические средства.
A. Kazmierska et al. (2022) на основании проведенного исследования сделали вывод: во время лечения изотретиноином масло примулы вечерней оказывает защитное действие на изменения липидного профиля и активности трансаминаз в течение 9 месяцев [25]. M. Mirnezami и H. Rahimi (2018) использовали прием омега-3 кислот для снижения побочных эффектов изотретиноина [26]. Е.В. Матушевская и Е.В. Свирщевская в 2018 г. приводят обзор зарубежной литературы, включивший сведения о снижении побочных эффектов СИ с помощью использования крема, содержащего омега-церамиды, никотинамид и гидрофильные сахара; разрабатывается поддерживающая наружная терапия после лечения в виде геля, содержащего наночастицы ретинола и гидроксипиноколона ретиноат [27].
Особым вариантом СИ для лечения среднетяжелых и тяжелых акне является Акнекутан, в производстве которого используется запатентованная технология LIDOSE* (Бельгия). В состав каждой капсулы Акнекутана прибавлены компоненты Гелюцира и Спана, способствующие увеличению растворенной фракции изотретиноина в капсуле и его абсорбции. Биодоступность данного препарата (которая позволяет увеличивать процент растворенной фракции изотретиноина на 13,5%) на 20% выше обычной формы изотретиноина, что позволяет уменьшать количество изотретиноина в каждой капсуле. После однократного приема 8 и 16 мг Акнекутана плазменный уровень изотретиноина аналогичен таковому для 10 и 20 мг соответственно изотретиноина других известных фирм. Рекомендуемая суточная доза составляет 0,4–0,8, курсовая – 120 мг/кг. Изотретиноин плохо растворим в воде, поэтому всасывание препарата происходит лучше при приеме его с пищей. В состав лекарственной формы изотретиноина LIDOSE* входят липидные компоненты, которые устраняют эту зависимость, что повышает комплаентность пациентов терапии изотретиноином. О.Ю. Олисова и Ц. Ма (2020), проведя лечение Акнекутаном 190 пациентов с акне, отмечали его высокую безопасность для лечения средней и тяжелой степеней данного заболевания. Авторами показано, что рецидивы при применении СИ возникают при наличии сопутствующих эндокринных заболеваний и гормональных нарушений, что требует мультидисциплинарного подхода к ведению таких пациентов [4].
W. Sinclair (2017) отмечает необходимость консультаций смежных специалистов – гинекологов и эндокринологов – при наличии нарушений менструального цикла, возраста начала акне старше 25 лет, других признаков синдрома поликистозных яичников, гирсутизма, черного акантоза, липоатрофии, вирилизации [5]. Рецидивы могут быть обусловлены назначением неадекватной суточной и кумулятивной дозы препарата, а также нарушением режима его приема.
Анализ полученных E.S. Negasheva et al. (2021) данных показал, что применение СИ в виде Акнекутана пациентами, страдающими синдромом Жильбера, приводило к двукратному снижению уровня общего билирубина в сыворотке крови относительно исходных значений. Динамика содержания печеночных ферментов (АлАТ, АсАТ) и триглицеридов не отличалась от таковой у пациентов без данной наследственной патологии. Применение Акнекутана в группе сравнения не приводило к каким-либо клинически значимым отклонениям лабораторных показателей крови [28].
Изучение биодоступности СИ
Несмотря на то, что препараты СИ незаменимы при лечении тяжелых форм акне и их токсические свойства хорошо известны, стандартный комплекс биохимических тестов не полностью отражает характер метаболических изменений, вызванных токсичностью препаратов. В связи с этим мультипараметрическая оценка состояния альбумина с изучением общей протеинограммы, транспортной функции данного белка, а также кристаллогенных свойств плазмы крови, в т.ч. определяющихся протеиновым компонентом биосубстрата, позволяет комплексно исследовать характер влияния препаратов СИ на гомеостаз организма.
Связывание лекарственных препаратов с белками плазмы, в частности с сывороточным альбумином, является одним из важных фармакокинетических параметров, определяющих распределение лекарств в организме. Альбумин полифункционален, он и является основным транспортером лекарственных средств, и участвует в поддержании не только белкового, но и других гомеостазов. Регуляция этих процессов осуществляется за счет как количественного содержания альбуминов, так и их конформации, модификации, т.е. функциональной характеристики [29, 30]. Однако данных исследований окислительной модификации альбумина крови больных акне мало, хотя известно, что при этом дерматозе происходят нарушения белкового гомеостаза, в т.ч. альбуминовой фракции [31].
Кристаллогенные свойства, присущие любому биологическому субстрату и являющиеся интегральным параметром его гомеостаза [32], способны косвенно отражать состояние протеома биосреды, т.к. кристаллогенный потенциал последней, реализующийся за счет его минеральных компонентов, непосредственно зависит от конформационных особенностей и степени гидратации белков. Ранее нами было показано, что характер дегидратационной структуризации сыворотки крови при кожной патологии (в частности, герпетиформном дерматите Дюринга) существенно отличается от свойственного практически здоровым людям [33]. Это позволяет, согласно теории биокристалломного анализа, оценивать эффективность проводимого лечения на основании исследования кристаллогенных свойств биожидкостей, прежде всего сыворотки или плазмы крови, а также сопоставлять различные препараты по действию на данный показатель гомеостаза рассматриваемой биосреды [34].
Целью нашей работы стало изучение влияния изотретиноина LIDOSE (Акнекутана) и обычной формы изотретиноина на белковый гомеостаз больных с тяжелыми формами акне.
Материал и методы
Под наблюдением находились 35 больных тяжелыми формами акне, 22 мужчины и 13 женщин в возрасте от 15 до 35 лет (средний возраст – 21,33 года): с длительностью заболевания до 3 лет – 9 (25,7%) человек, 4–7 лет – 19 (54,3%), 8–11 лет – 7 (20%). Группу физиологического контроля составили 23 человека.
Биохимическое обследование крови проводилось в соответствии со стандартом при назначении препаратов изотретиноина. Исследовались показатели: АсАТ, АлАТ, щелочная фосфатаза, билирубин, холестерин, триглицериды, креатинин, глюкоза крови на биохимическом анализаторе Clima-15; протеинограмма; эффективный альбумин по методу А.Д. Кожевникова (2004) [35]; общая окислительная модификация белка и окислительная модификация альбумина определялись методом Е.Е. Дубининой (2006) [36].
Произведено исследование характера собственной и инициированной кристаллизации различных биосубстратов (сыворотка крови, слюна) у данной группы больных с использованием методов классической кристаллоскопии и сравнительной тезиграфии. Базисным веществом в тезиграфическом тесте являлся 0,9%-ный раствор хлорида натрия. Оценку кристаллоскопических и тезиграфических фаций выполняли с применением системы параметров, разработанных А.К. Мартусевичем и соавт. [37–40].
Изучение данных показателей проводилось до начала лечения (1-е обследование), через месяц (2-е), и через 3 месяца от начала терапии (3-е).
Все пациенты ранее по поводу акне получали терапию с использованием стандартных средств без достижения клинического эффекта: наружные ретиноиды, бензоилпероксид, азелаиновая кислота; в 42,86% случаев применялись физиотерапевтические методики, 2 пациента ранее госпитализировались в хирургические отделения многопрофильных стационаров. В генеалогическом анамнезе акне у близких родственников констатировано в 57% случаев, по линии отца – 8 (40%) человек, по линии матери – 9 (45%), по линии обоих родителей – 2 (5,7%), у братьев и сестер – 5%, что подтверждает наследственную предрасположенность возникновению заболевания. Степень тяжести определялась согласно шкале, предложенной AAD. Сопутствовавшая патология имелась у 11 (31,4%) человек, из них патология желудочно-кишечного тракта у 63,6% пациентов.
В основной группе исследования в отношении 25 пациентов в лечении использовали препарат Акнекутан, 10 – обычный изотретиноин (Роаккутан). Суточная доза Акнекутана в среднем составила 0,45 мг/кг веса (31,4±8,6 мг), курсовая – 104,3 мг/кг веса (7,1±1,4 г) при средней массе пациентов 63,8± 10,62 кг. По обычной форме изотретиноинасуточнаядозировкаопределялась из расчета 0,6 мг/кг веса (43±10,37 мг), 126,4 мг/кг на курс (8,85±1,19 г) при средней массе пациентов 68,9±10,1 кг.
Полученные данные обработаны с помощью пакетов прикладных программ Statistica 6.0 и Microsoft Excel с использованием методов одномерной статистики.
Результаты
Проанализированы показатели общей окислительной модификации белков (ОМБ) плазмы крови и фракции альбуминов, а также содержание эффективного альбумина у больных акне в динамике лечения системными ретиноидами (табл. 3).

В первой графе таблицы представлен показатель общей ОМБ сыворотки крови, характеризующий количество карбонильных производных, регистрируемых в спектре длин волн от 230 до 540 нм в результате их спонтанного окисления в организме. Во второй и третьей графах – количество альдегидных и кетонных производных нейтрального характера, образование которых в общем спектре наиболее массово как у здоровых лиц, так и при патологии [30]. В четвертой графе представлены данные о метал-катализируемом (индуцированном) окислении молекулы альбумина под влиянием реактива Фентона, содержащего Н2О2 и Fe. Металл-катализируемое окисление характеризует устойчивость системы к переокислению.
Выявлено, что в сыворотке крови больных акне статистически значимо увеличено количество ОМБ. Общее количество карбонильных производных белков составило 19,43±1,66 ЕД/мл сыворотки крови против 14,4±1,5 в контроле (р<0,05).
Согласно данным литературы, основную диагностическую значимость в оценке спектра ОМБ имеют альдегидные и кетонные производные нейтрального характера, которые регистрируются при 356–370 нм. В контрольной группе этот показатель составляет 3,9±0,3 ЕД/мл сыворотки крови, или 27,7% от суммарного количества карбонильных производных, у больных акне – 6,17±0,41 ЕД/мл сыворотки крови, или 31,8%. При этом если суммарный уровень ОМБ превышает контрольные значения в 1,35 раза, то количество продуктов, регистрируемых при 356–370 нм, в 1,6.
На фоне терапии СИ (2-е обследование) больных акне было отмечено нарастание количества ОМБ при лечении обоими видами препаратов. На момент третьего обследования показатели не возвращались к исходному уровню. Эти данные свидетельствуют о том, что проводимое лечение вызывает в организме больного образование окисленно модифицированных продуктов, следовательно, развитие эндогенной интоксикации.
В связи с тем что основной функциональной и транспортной молекулой организма является альбумин, нами изучена степень его окислительной модификации и количество эффективно работающих молекул. Показано, что для больных акне характерны изменения функциональных характеристик молекулы альбумина, которые проявляются в статистически значимом увеличении уровня его альдегидных и кетонных карбонильных производных нейтрального характера как при спонтанном, так и при металл-катализируемом окислении, а также снижение количества эффективного альбумина (табл. 3). При этом до лечения больных в пределах контрольных значений оставалась разность в показателях количества продуктов индуцированного и спонтанного окисления.
В процессе лечения отмечено достоверное снижение показателя спонтанного окисления альбумина при лечении как Акнекутаном, так и Роаккутаном. В то же время уровень металл-катализируемого окисления снижался только при лечении обычной формой изотретиноина, а при терапии Акнекутаном оставался выше контрольных значений, что может говорить о большей устойчивости молекулы альбумина к процессам окисления. Однако достоверной разницы в уровне карбонильных производных металл-катализируемого окисления между исследуемыми группами не выявлено.
Ко второму обследованию нами была отмечена негативная тенденция влияния системных ретиноидов на состояние молекулы альбумина. Она проявилась в том, что оба препарата приводили к увеличению разности в количестве карбонильных производных между индуцированным и спонтанным окислением. Это может свидетельствовать о том, что лечение системными ретиноидами делает молекулу альбумина более подверженной процессам окислительной модификации под влиянием металлов переменной валентности и перекиси водорода. Подобные процессы служат результатом окислительного стресса организма.
К третьему обследованию показатели спонтанной окислительной модификации альбуминов (ОМА) снижались до уровня контрольных значений в обеих группах, что свидетельствует о восстановлении конститутивных характеристик молекулы альбумина. Однако в группе Роаккутана в динамике произошло резкое снижение уровня эффективного альбумина.
На основании проведенных исследований установлено, что тезиокристаллоскопический «паттерн» биосред пациентов с акне существенно отличался от характерного для практически здоровых людей. Морфологический анализ фаций (образцов биологических субстратов, приготовленных по любой методике биокристаллоскопического анализа) сыворотки крови и слюны пациентов с акне до лечения позволил выявить некоторые особенности структурообразования данных биологических жидкостей (рис. 1 и 2).


Так, фациям последних присуща высокая кристаллогенная активность (Кр) с преобладанием в высушенных образцах одиночно-кристаллических структур (индекс структурности, ИС). Следует подчеркнуть, что для структурных элементов микропрепаратов пациентов с акне характерно наличие выраженных признаков деструкции (степень деструкции фации; СДФ). Краевая зона фаций (Кз) сыворотки крови и слюны достаточно четкая, прослеживается по всему периметру образца.
К моменту проведения второго обследования больных сформированных групп (конец первого месяца лечения) нормализация кристаллогенных свойств биожидкостей происходила вариабельно, однако статистически значимых различий между группами не выявлено. При этом изменения собственной кристаллизации биологических жидкостей характеризовались постепенным снижением плотности и сложности строения формирующихся кристаллических элементов, а также выраженности деструктивных изменений (рис. 1а и 2а). Интересно, что темпы нормализации инициированного кристаллогенеза биосубстратов в данной точке наблюдения были ниже (рис. 1б и 2б).
К третьему обследованию (третий месяц лечения) наблюдали принципиально различную степень нормализации кристаллогенных и инициирующих свойств слюны и сыворотки крови (рис. 1, 2). Так, в высушенных образцах сыворотки крови пациентов, получавших Акнекутан, регистрировали максимальное приближение тезиокристаллоскопического «паттерна» к физиологическому уровню (рис. 1а). В то же время у больных, лечение которых производили обычной формой изотретиноина, имели место существенные отклонения от нормы (уменьшение плотности кристаллических элементов и сложности их структуропостроения – по Кр и ИС).
Кроме того, в данных микропрепаратах отмечали снижение выраженности Кз с нарастанием СДФ. На момент окончания терапии морфологический анализ фаций сыворотки крови и слюны пациентов с акне демонстрировал схожие процессы нормализации структуропостроения как для группы Акнекутана, так и для группы обычной формы изотретиноина. Отмечено, что темп нормализации для группы изотретиноина LIDOSE (Акнекутан) был более физиологичным.
Выводы
СИ является «золотым» стандартом терапии средней и тяжелой степеней вульгарных акне, в настоящее время показания к его применению расширяются для ряда дерматозов.
У больных тяжелыми формами акне установлено нарушение белкового гомеостаза, являющегося одним из важных факторов патогенеза заболевания. Пациентам с тяжелыми формами акне терапия СИ с большей биодоступностью (Акнекутан) оказывает менее выраженный негативный эффект на показатели гомеостаза организма по сравнению с препаратом Роаккутан.
Таким образом, применение препарата Акнекутан позволяет повышать эффективность лечения тяжелых форм акне и снижать риск побочных эффектов.



