Введение
Десятилетиями шли разработки различных методов иммунотерапии, но в практическом отношении результаты этой работы были не так велики. Однако результаты клинических испытаний ингибиторов «блокаторов иммунной системы» положили начало новой эре в лечении рака, в которой иммунотерапии отведена одна из главных ролей [1].
Изучение ниволумаба (BMS-936558/ MDX1106) – первого анти-PD1 моноклонального антитела – начато в 2010 г. В первой фазе клинического исследования приняли участие 39 пациентов с рефрактерными опухолями с метастазированием: с метастатической меланомой, колоректальным раком, немелкоклеточным раком легкого, раком почки, простаты. Уже в течение первой фазы испытания препарата продемонстрирован явный противоопухолевый эффект ниволумаба при его относительной безопасности [1, 2]. Дальнейшие клинические исследования проходили по ускоренной программе, и в декабре 2014 г. Управление по контролю за качеством пищевых продуктов и лекарственных препаратов (Food and Drug Administration, FDA) одобрило ниволумаб для лечения метастатической меланомы [3], в марте 2015 г. – для лечения метастатического рака легкого [4], в 2015 г. препарат был одобрен в Японии для лечения метастатической меланомы во второй линии [1, 4]. В дальнейшем этот препарат показал активность в отношении широкого спектра онкологических заболеваний, блокируя взаимодействие между рецептором программируемой смерти (PD-1) и его лигандами (PD-L1 и PD-L2).
Терапия ниволумабом позволяет существенно повышать частоту общих ответов, длительность ответа и общую выживаемость онкологических пациентов. Профиль безопасности препарата более благоприятный по сравнению со стандартным лечением [5, 6].
В настоящее время в России препарат зарегистрирован для лечения метастатического немелкоклеточного рака легкого во второй линии терапии, распространенного почечно-клеточного рака у пациентов, ранее получавших антиангиогенную терапию, и неоперабельной или метастатической меланомы [7–9]. Результаты применения препарата ниволумаб во второй линии терапии распространенного почечноклеточного рака показали, что иммуноонкология станет новым перспективным направлением в лечении этого заболевания [9].
Однако при иммунотерапии могут развиваться иммуноопосредованные нежелательные явления, требующие особого подхода к их ведению. Безопасность применения ниволумаба пациентами с меланомой представлена в совокупном анализе различных трех клинических исследований [10– 12]. Частота нежелательных явлений любой степени составила 71%, частота нежелательных явлений 3–4-й степеней — 10%. При этом в 85% случаев все нежелательные явления возникали в течение первых 16 недель терапии [10–12].
Таким образом, одновременно с тем, что ИКИ способны высвобождать Т-клетки для борьбы с раковыми клетками, они также могут запускать аутоиммуноподобные проявления в различных системах организма, обычно называемые иммунными сопутствующими нежелательными явлениями (irAEs) [1, 8, 9].
Эндокринные дисфункции – одно из наиболее частых нежелательных явлений, о которых сообщалось в клинических испытаниях с ИКИ, включая гипотиреоз, гипертиреоз, гипофизит, первичную надпочечниковую недостаточность, сахарный диабет и диабетический кетоацидоз [8].
Пациенты нуждаются в динамическом наблюдении для выявления признаков и симптомов эндокринопатии, в т.ч. изменения функции щитовидной железы (в начале лечения, периодически во время лечения и основываясь на клинической оценке). У пациентов могут отмечаться усталость, головная боль, изменение психического состояния, боль в животе, изменения перистальтики кишечника, гипотония или неспецифические симптомы, которые могут иметь сходство с другими состояниями, такими как метастазы в головной мозг или сопутствующие заболевания. Если иная этиология не выявлена, признаки и симптомы эндокринопатии считаются иммуноопосредованными [8].
Клинический случай
По направлению онкодерматолога на консультацию к эндокринологу обратился мужчина 42 лет без активных жалоб. При расспросе стало известно, что пациент состоит на учете с диагнозом «меланома кожи поясничной области (BRAF V600E+)». Состояние после широкого иссечения опухоли кожи от 07.05.2015. Прогрессирование от 12.2016, метастазы в левые паховые лимфоузлы. Операция Дюкена от 09.12.2016. Адъювантная иммунотерапия интерфероном-α с 01.2017 по 01.2018. Прогрессирование от 06.2020: метастаз в подвздошный лимфоузел. Полный регресс после терапии ниволумабом с 10.12.2020.
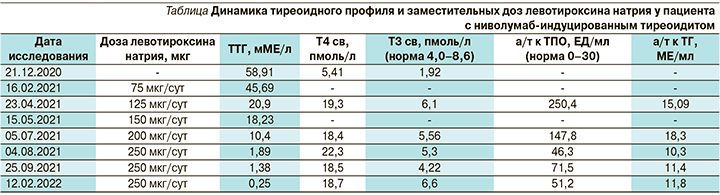
При плановом обследовании выявлены лабораторные признаки гипотиреоза (см. таблицу), в связи с чем был направлен на консультацию к эндокринологу.
Из анамнеза заболевания: считает себя больным с 2012 г., когда впервые заметил кровоточивость пигментного образования, существовавшего с рождения. В апреле 2015 г. при профилактическом осмотре установлен диагноз «меланома кожи поясничной области». 07.05.2015 в НИИ онкологии выполнено широкое иссечение опухоли кожи с пластикой раневого дефекта с фотодинамической терапией на зону первичной опухоли. По данным УЗИ органов брюшной полости и периферических узлов от 21.11.2016, метастатическое поражение левых паховых лимфоузлов. 09.12.2016 – операция Дюкена слева. С 01.2017 по 01.2018 получал интерферон-α-2b в дозе 3 млн ЕД 3 раза в неделю 2 месяца, далее 5 млн ЕД. При молекулярно-генетическом исследовании выявлена мутация в гене BRAF V600E; в KRAS, NRAS, C-kit мутации не выявлены, β-тубулин средний. По данным ПЭТ-КТ от 10.2017, в малом тазу имеет место подозрение на метастатически измененный лимфоузел подвздошной группы. При контрольном ПЭТ-КТ от 16.06.2020 в области органов грудной клетки, органов брюшной полости без признаков метастазирования; в области малого таза появление метаболически активного тазового лимфоузла 10×9 мм SUV 5,46, локальное уплотнение клетчатки кожи правой голени SUV – 2,49. При МРТ от 11.08.2020 появление наружного подвздошного лимфоузла по сравнению с исследованием от 05.06.2018. 26.08.2020 выполнена трепан-биопсия подвздошного лимфоузла. Гистологическое заключение: метастаз, наиболее вероятно, меланомы. С 09.09.2020 по 25.02.2021 проводилось 6 циклов курса иммунотерапии ниволумабом в дозе 480 мг внутривенно каждые 4 недели. По данным ПЭТ-КТ от 10.12.2020, данных за метастазы не получено. Ранее выявленный метаболически активный лимфоузел по ходу наружных подвздошных сосудов не определялся.
Из анамнеза жизни: из сопутствующих заболеваний: экзогенно-конституциональное ожирение I степени. Симптоматическая артериальная гипертензия 2-й степени, 1-й стадии. Сложная киста правой почки. Киста печени.
Наследственный анамнез: наследственность не отягощена.
Объективно: рост – 181 см, масса тела – 111 кг, индекс массы тела – 33,6 кг/м2. Состояние удовлетворительное. В сознании. Телосложение гиперстеническое. Подкожная клетчатка развита избыточно, распределена равномерно. Отмечается пастозность нижних и верхних конечностей. Кожные покровы бледно-розовой окраски, чистые, суховатые. Слизистые оболочки бледно-розовой окраски, чистые. Периферические лимфатические узлы не увеличены, не спаяны между собой, при пальпации безболезненны.
Форма грудной клетки не изменена. Над всей поверхностью легких выслушивается везикулярное дыхание, хрипов нет. Область сердца визуально не изменена. Тоны сердца ясные, ритм правильный. Частота сердечных сокращений – 80 в минуту. Артериальное давление – 157/85 мм рт.ст. Живот мягкий, безболезненный. Печень не выступает из-под края реберной дуги. Стул регулярный, оформленный.
Диурез адекватный. Щитовидная железа не увеличена, при пальпации умеренно эластичной консистенции, клинический гипотиреоз. Со стороны костно-мышечной системы патологических изменений не выявлено.
По данным дополнительных исследований (см. таблицу), пациенту установлен диагноз ниволумаб-индуцированного тиреоидита. Назначена заместительная терапия левотироксином натрия в стартовой дозе 75 мкг/ сут. При контрольных исследованиях тиреоидного профиля (см. таблицу) отмечена высокая потребность в дозах заместительной терапии левотироксином натрия, достигшая при титрации 250 мкг/сут.
Контрольное ПЭТ-КТ от 19.03.2021 показало отсутствие признаков прогрессирования заболевания c сохранением полного регресса.
Обсуждение
Разработка препаратов, блокирующих точки иммунного контроля, включая ниволумаб, изменила парадигму лечения пациентов с различными солидными опухолями.
В настоящее время разработка препаратов блокаторов контрольных точек иммунитета (CTLA4, PD1, PDL1) с высоким противоопухолевым эффектом представляет огромный интерес для исследователей и в этом направлении иммунотерапии опухолей уже получены впечатляющие результаты. А поиск дальнейших решений в фундаментальных вопросах современной онкологии существенно расширит возможности подобных блокирующих реагентов [1, 9].
Nishimura Н. et al. в 1999 г. впервые в своей работе in vivo на нокаутных мышах, дефицитных по PD1 (белок запрограммированной клеточной смерти 1), продемонстрировали, что PD1 может выступать как блокатор иммунного ответа [13]. После открытия его лигандов – PDL1 (лиганд запрограммированной смерти 1) и PDL2 (лиганд запрограммированной смерти 2) показано, что PDL1 экспрессируется на поверхности множества опухолей и, вероятно, вовлечен в процесс уклонения опухоли от распознавания иммунной системой [14].
Рецептор PD1 экспрессируется на поверхности активированных Ти В-лимфоцитов [1, 14]. Его взаимодействие с лигандом PDL1 на опухолевых клетках и клетках опухолевого микроокружения приводит к увеличению иммуносупрессивного эффекта и способствует подавлению противоопухолевого иммунного ответа [1]. Молекулы иммунных контрольных точек играют важную роль в регуляции иммунного ответа: после связывания со своими лигандами эти белки могут инициировать либо ингибирующие, либо стимулирующие пути, которые модулируют функцию Т-клеток. И CTLA4 (цитотоксический Т-лимфоцит-ассоциированный антиген 4), и PD1 играют ключевую роль в поддержании иммунологической толерантности к собственным антигенам, предотвращая аутоиммунные расстройства [1].
Противоопухолевая активность и выраженность побочных эффектов ингибиторов PDL1 и PD1 довольно схожи. Ведутся работы по выявлению потенциальных различий в противоопухолевом эффекте и выраженности побочных реакций данных препаратов. Так, показано, что при блокировании только PDL1 сохраняется активность PDL2, которая может снижать противоопухолевый иммунный ответ, но при этом сохраняется способность к предотвращению аутоагрессии в отношении нормальных клеток организма [1, 2].
При ниволумаб-индуцированном тиреоидите может наблюдаться как транзиторное течение тиреоидита, так и быстрое прогрессирование с последующим гипотиреозом. Кроме того, в исследованиях подтверждено, что PDL1 и PDL2 экспрессируются в нормальной ткани щитовидной железы. Это свидетельствует о том, что терапия ниволумабом снижает иммунную толерантность даже в нормальной ткани щитовидной железы и приводит к развитию тиреоидита. В свою очередь ниволумаб-индуцированный тиреотоксикоз, по-видимому, связан с безболезненным тиреоидитом, в то время как пациентов с болезнью Грейвса, по данным ряда исследований, не наблюдалось [15, 16].
С целью выявления частоты и риска эндокринных иммуноопосредованных нежелательных явлений, связанных с разными режимами использования ИКИ, проведен мета-анализ 38 рандомизированных клинических испытаний с участием 7551 пациента с запущенными солидными опухолями и с одобренными FDA схемами ИКИ (монотерапия ингибитором PD1 [белок программируемой смерти 1], ингибитором CTLA4 [цитотоксический белок-4, ассоциированный с Т-лимфоцитами], ингибитором PDL1 [лиганд программируемой смерти 1] и комбинированной терапией ингибитором PD1 плюс ингибитор CTLA4) [16].
Частота как гипотиреоза, так и гипертиреоза была самой высокой у пациентов, получавших комбинированную терапию. Пациенты, получавшие комбинированный режим, значительно чаще страдали гипотиреозом (р<0,001) и гипертиреозом (р=0,001), чем пациенты, получавшие ипилимумаб (CTLA4). Во всех группах исследования наблюдалось 472 случая гипотиреоза любой степени среди 7551 пациента, включенного в 38 исследований. Используя модель смешанных эффектов, общая заболеваемость гипотиреозом оценивалась в 6,6% (95% доверительный интервал [ДИ]: 5,5–7,8%). Прогнозируемая частота гипотиреоза варьировалась от 3,8% (95% ДИ: 1,9–7,8%) при применении ипилимумаба (CTLA4) до 13,2% (95% ДИ: 6,9–23,8%) при комбинированной терапии. Общая заболеваемость гипертиреозом оценивалась в 2,9%. Кроме того, было продемонстрировано, что тип опухоли не определял частоты развития гипотиреоза при приеме ингибиторов PD1 [16].
На основании представленных в мета-анализе результатов рекомендовано контролировать уровни тиреотропного гормона и свободного тироксина перед каждой инфузией ИКИ в течение как минимум первых 5 циклов терапии [16].
При гипотиреозе, развившемся на фоне применения ниволумаба, назначается заместительная терапия левотироксином натрия, а в случае гипертиреоза – терапия тиреостатиками (тиамазол). В случае острого тиреоидита рекомендовано назначение глюкокортикостероидов в дозе, эквивалентной 1–2 мг/кг/сут метилпреднизолона. При наступлении улучшения применение ниволумаба может быть продолжено после медленного снижения дозы глюкокортикостероидов. Необходимо продолжать наблюдение за функцией щитовидной железы для контроля адекватности проводимой заместительной гормональной терапии гормонами щитовидной железы [17].
У представленного нами пациента гипотиреоз развился после 4-го курсов применения ниволумаба и потребовал больших доз заместительной терапии левотироксином натрия. В течение года динамического наблюдения потребность в дозе снизилась на 20% от исходной на фоне продолжавшейся терапии ИКИ.
Заключение
Признание того, что сверхэкспрессия молекул иммунных контрольных точек в микроокружении опухоли играет решающую роль в уклонении от противоопухолевого иммунитета, произвело революцию в терапии онкологических заболеваний. С учетом постоянно растущего списка типов рака, при которых ИКИ продемонстрировали клиническую активность, ожидается, что их использование возрастет в ближайшие годы [1, 9].
PD1-рецептор является негативным регулятором активности Т-клеток.
Связывание PD1 с лигандами PDL1 и PDL2, способными экспрессироваться клетками опухолей или иными клетками микроокружения опухолей, приводит к ингибированию пролиферации Т-клеток и секреции цитокинов. Ниволумаб потенцирует иммунный ответ посредством блокады связывания PD1 с лигандами PDL1 и PDL2 [7, 8].
Клиническая активность ниволумаба при широком спектре солидных опухолей была доказана в ряде клинических исследований [9]. Ниволумаб показал высокую эффективность в исследовании первой фазы CheckMate 003 на пациентах с метастатической меланомой, у которых уже не было опций стандартной терапии. У пациентов, получавших ниволумаб в дозе 3 мг/кг 1 раз в 2 недели, пятилетняя общая выживаемость составила 35% [5, 6, 18].
Хотя комбинированная терапия с ИКИ имеет веское доклиническое обоснование и показала улучшение выживаемости без прогрессирования у пациентов с меланомой, этот подход увеличивает риск эндокринной дисфункции после его использования [16, 18].
Конфликт интересов. Авторы статьи заявляют об отсутствии конфликта интересов, а именно персональной заинтересованности в получении лично либо через представителя компании материальной выгоды или иного преимущества, которое повлияло или могло бы повлиять на надлежащее исполнение профессиональных обязанностей.



