Введение
Полипозный риносинусит (ПРС) — полиэтиологическое заболевание слизистой оболочки полости носа и околоносовых пазух (ОНП), характеризующееся рецидивирующим ростом назальных полипов, инфильтрированных различными клетками иммунной системы [1]. Рецидив болезни, по разным данным, может наступать с частотой от 4 до 60% [2], что в значительной мере ухудшает качество жизни пациентов и несет немалую финансовую нагрузку на систему здравоохранения.
Известно, что в случае преобладания Т2-типа иммунного ответа течение заболевания может стать неконтролируемым, кроме того, увеличивается риск развития бронхиальной астмы (БА) и/или непереносимости нестероидных противовоспалительных средств (НПВС), формируется аспирин-индуцированное респираторное заболевание. Ведение таких пациентов представляет особую сложность для врачей-оториноларингологов и аллергологов-иммунологов, т.к. хирургическое лечение в этой ситуации дает лишь временный положительный эффект и в целом является паллиативным.
За последние десятилетия внимание исследователей направлено на изучение иммунологических механизмов, участвующих в развитии ПРС, и коморбидных состояний. Полученные знания сформировали понимание того, что перспективное направление в лечении этого заболевания будет связано не с совершенствованием хирургических методик, а с развитием медикаментозной терапии. В 2019 г. в журнале Lancet опубликованы результаты двух многонациональных многоцентровых рандомизированных двойных слепых плацебо-контролируемых исследований в параллельных группах SINUS-24 и SINUS-52, оценивавших добавление моноклонального антитела дупилумаба к стандартному лечению взрослых пациентов с тяжелой формой ПРС [1]. Поэтому определенным прорывом в терапии пациентов с тяжелым течением ПРС стало внедрение в клинические рекомендации (EUFOREA-2019, EPOS-2020) таргетной терапии моноклональными антителами [4, 5]. Первым рекомендованным препаратом стал дупилумаб, блокирующий субъединицу рецептора к интерлейкину-4 (ИЛ-4) и -13 [5].
Клинический случай
С 2018 г. пациентка А. 40 лет наблюдается в Центральной клинической больнице гражданской авиации с диагнозом ПРС. На момент первичного обращения женщину беспокоили жалобы на длительное отсутствие носового дыхания, отсутствие обоняния, чихание, кашель, густые выделения из полости носа, чувство стекания по задней стенке глотки, повышенную утомляемость и снижение работоспособности.
Симптоматика начиналась в 20 лет с частых риносинуситов, сопровождавшихся длительным затруднением носового дыхания. Пациентка обращалась к врачам-оториноларингологам, назначалась консервативная терапия деконгестантами. Спустя 5 лет (в 2007 г.) были обнаружены назальные полипы. В том же году обследована аллергологом-иммунологом, выявлен аллергический ринит (АР) круглогодичный и сезонный, персистирующего течения, средней степени тяжести с латентной сенсибилизацией к бытовым (домашняя пыль+; Der. Farinae+; Der. Pteronyssinus+; библиотечная пыль+; перо подушки+), эпидермальным (шерсть кошки+; шерсть собаки+) и пыльцевым аллергенам (смесь деревьев+; смесь злаковых+; смесь сорных трав+). Несмотря на аллергическую реакцию, пациентка в течение 8 лет проживает в отдельной квартире с кошкой, что усугубляет симптоматику. Наследственный аллергоанамнез больной не отягощен. С 2007 г. пациентка находилась на постоянном приеме интраназальных глюкокорти-костероидов (ГКС), кроме того, при усилении симптоматики АР принимала антигистаминные препараты. Консервативная терапия не давала должного эффекта, в связи с чем проводились эндоскопические полисинусотомии под эндотрахеальным наркозом (8.12.2009, 29.07.2010, 26.01.2012, 17.04.2012, 11.01.2016, 17.12.2018, 16.04.2019), а также множество полипотомий под местной анестезией. В ходе первых операций пациентке удалены средние носовые раковины. Отсутствие анатомических ориентиров значительно осложняло последующие хирургические вмешательства. Более 10 лет больная жаловалась на отсутствие обоняния без положительного эффекта после неоднократных операций. По профессии женщина — повар, поэтому длительная аносмия не только нарушала ее качество жизни, но и мешала профессиональной деятельности. В 2009 г. следом за перенесенным бронхитом у пациентки выявлена БА смешанной формы, средней степени тяжести. Пульмонологом рекомендована базисная терапия: будесонид 160+формотерол 4,5 по 2 вдоха 2 раза в сутки; антилейкотриеновые препараты курсами. Позднее у женщины случился эпизод бронхоспазма на НПВС. Таким образом, за несколько лет у больной сформировалось аспирин-индуцированное респираторное заболевание, начавшееся с ПРС (рис. 1). Неконтролируемое течение болезни вынуждало врачей назначать пациентке более двух курсов системных ГКС в год, что привело к перераспределению подкожно-жировой клетчатки больной по типу синдрома Кушинга. В 2015 г. женщина перенесла анафилактический шок на цефтриаксон. Лекарственная аллергия распространяется также на пенициллиновый ряд антибиотиков (анафилактический шок), новокаин (отек Квинке).
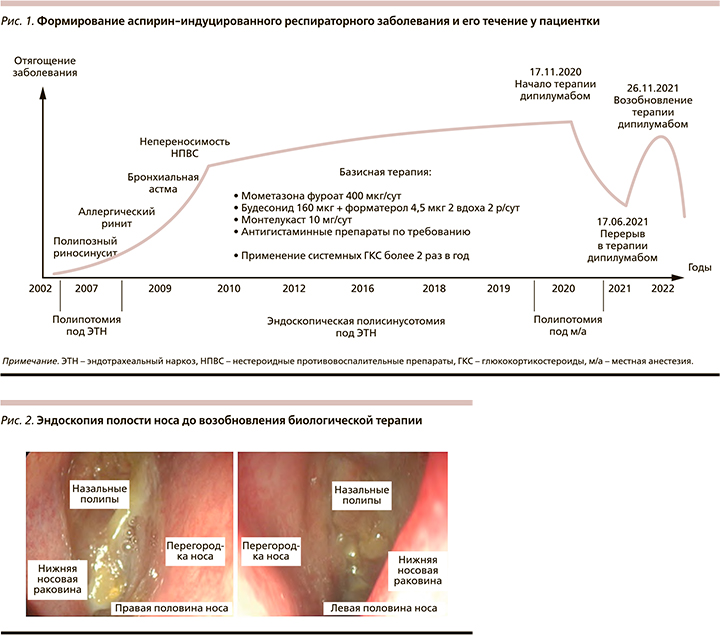
В 2020 г. в связи с прогрессированием симптоматики на фоне проводимой базисной терапии, а также необходимостью применения системных ГКС более 2 раз в год пациентке рекомендована биологическая терапия препаратом дупилумаб в дозе 300 мг подкожно каждые 2 недели. Женщина получала ее в течение 7 месяцев: с 17.11.2020 по 17.06.2021 в Красногорской городской больнице № 1 по причине перехода БА в тяжелое течение. Побочных реакций на препарат зафиксировано не было. На протяжении всего этого периода пациентка продолжала принимать ранее рекомендованную пульмонологом, оториноларингологом и аллергологом базисную терапию. Спустя 16 недель лечения дупилумабом больной достигнута положительная динамика по всем 5 критериям оценки ответа на биологическую терапию, предложенным в EPOS-2020 [5]:
- уменьшение размеров назальных полипов;
- уменьшение потребности в системных ГКС;
- улучшение качества жизни;
- появление обоняния;
- уменьшение влияния БА.
Прекращение биологической терапии было связано с обеспечением больницы. Эффект от проведенного лечения сохранялся в течение 2 месяцев, после чего пациентка отметила прогрессирование симптоматики, в т.ч. аносмию. В сентябре 2021 г. у нее снова возникла потребность в использовании системных ГКС. В ноябре 2021 г. пациентке рекомендовано продолжить получение биологической терапии дупилумабом по поводу неконтролируемого течения ПРС. Подтверждено наличие у нее всех критериев, предложенных EPOS-2020 [5]:
1. Признаки Т2-воспаления (IgE от 09.11.2021 552 кЕД/л при норме до 100 кЕД/л; эозинофилы крови от 28.10.2021 11% при норме до 5%, 970 клеток/мкл при норме 250 клеток/ мкл);
2. Значительное нарушение качества жизни (88 баллов по шкале SNOT-22 от 23.11.2021);
3. Аносмия;
4. Потребность в системных ГКС более 2 курсов в год;
5. Наличие БА, требовавшей базисной терапии.
Возобновление терапии дупилумабом в дозе 300 мг подкожно каждые 2 недели произошло 26.11.2021 в Центральной клинической больнице гражданской авиации. Лечение проходило на базе оториноларингологического отделения в соответствии с Программой государственных гарантий бесплатного оказания гражданам медицинской помощи на 2021 г. по диагнозу ПРС неконтролируемого течения (J33.8). Перед возобновлением терапии пациентка прошла обследование, включившее оценку выраженности симптомов по опроснику SNOT-22; определение абсолютного и относительного количества эозинофилов крови, иммуноглобулина Е общего; компьютерную томографию (КТ) ОНП с оценкой по шкале Lund—Mackey; эндоскопию полости носа с оценкой по шкале Lund-Kennedy.
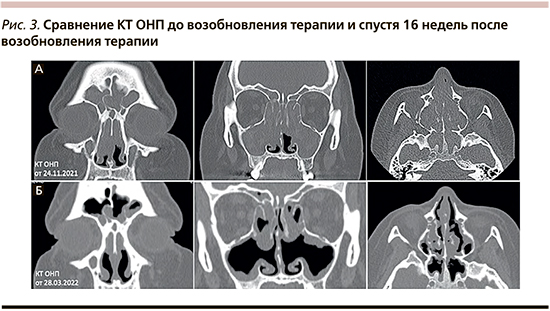
Данные ЛОР-осмотра от 26.11.2021 (рис. 2): форма носа правильная, пальпация безболезненная, преддверие носа не изменено, носовое дыхание резко затрудненное, обоняние отсутствует, перегородка носа и нижние носовые раковины плохо обозримы из-за назальных полипов, обтурирующих общие носовые ходы (2 балла по шкале Lund-Kennedy), на назальных полипах слизистогнойное отделяемое (2 балла по шкале Lund-Kennedy), слизистая оболочка выраженно отечная (2 балла по шкале Lund-Kennedy).
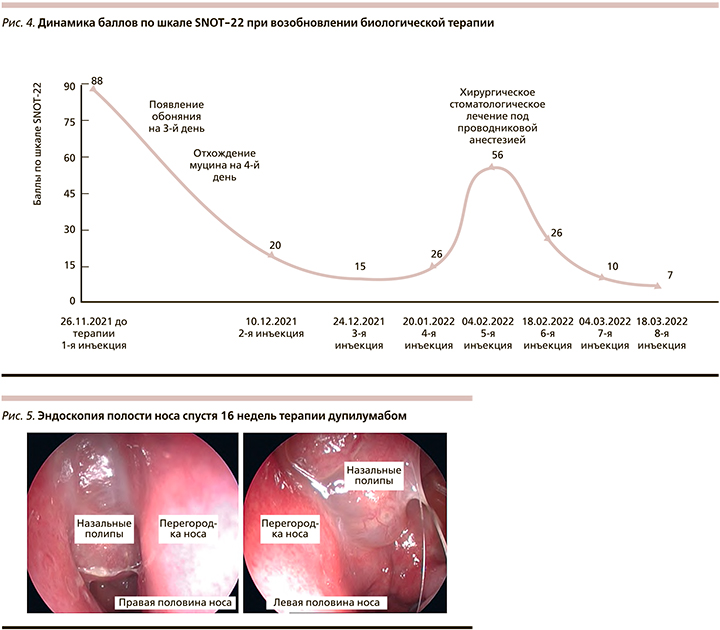
КТ ОНП от 24.11.2021 (рис. 3А): картина ПРС, тотальное затемнение всех ОНП, остиомеатальные комплексы не дифференцируются, затемнение общих носовых ходов с обеих сторон, состояние после эндоскопических полисинусотомий (23 балла по шкале Lund-Mackey).
На 3-й день с момента первой инъекции дупилумаба пациентка отметила появление обоняния, значительное улучшение носового дыхания. На 4-й день началось активное отхождение муцина из ОНП. Динамика состояния оценивалась каждые 2 недели по субъективным показателям - опросник SNOT-22; а также по объективным данным - эндоскопия полости носа. По графику динамики баллов SNOT-22 (рис. 4) можно пронаблюдать значительное улучшение качества жизни больной. Перед терапией показатели составляли 88 баллов (максимально возможное — 110), спустя 2 недели с момента первой инъекции дупилумаба этот показатель спустился до 20 баллов (минимально возможное — 0). Тем не менее на 10-й неделе терапии женщина снова отметила кратковременное ухудшение. При выяснении анамнеза оказалось, что оно коррелировало с проведением стоматологического лечения и после его окончания состояние пациентки снова улучшилось. Этот эпизод показывает важность отслеживания и коррекции воздействия внешних факторов на организм больного для достижения эффективности биологической терапии.
Через 16 недель с момента возобновления биологической терапии от пациентки получен полный ответ, оценка осуществлялась по критериям, предложенным в EPOS-2020 [5]. Назальные полипы значительно уменьшились (1 балл по шкале Lund— Kennedy), отделяемое в полости носа приобрело слизистый характер (1 балл по шкале Lund-Kennedy), отек слизистой оболочки стал не таким выраженным (1 балл по шкале Lund-Kennedy) (рис. 5).
По результатам КТ ОНП от 28.03.2022 была также отмечена положительная динамика, появилась пневматизация лобных, клиновидных, верхнечелюстных пазух и клеток решетчатого лабиринта с обеих сторон (рис. 3Б). Пациентка продолжает получать биологическую терапию.
Обсуждение
ПРС является заболеванием, значительно влияющим на качество жизни пациента: рост и частые рецидивы назальных полипов ведут к потере обоняния, заложенности носа, снижению трудоспособности, а также течение ПРС может быть отягощено сопутствующей БА [6].
В отечественной классификации ПРС разделяют на клинические фенотипы по этиопатогенетическому принципу [7]:
1. Полипоз в результате нарушения аэродинамики в полости носа и ОНП;
2. Полипоз в результате хронического гнойного воспаления слизистой оболочки полости носа и ОНП;
3. Полипоз в результате грибкового поражения слизистой оболочки;
4. Полипоз в сочетании с БА;
5. Полипоз при муковисцидозе и синдроме Картагенера.
Первые три фенотипа характеризуются благоприятным течением с низким риском рецидивирующего роста полипов, т.к. имеется возможность воздействия на ведущий этиологический фактор. В отличие от них четвертый и пятый фенотипы обладают неблагоприятным прогнозом, т.к. патологический процесс не носит локальный характер, а является результатом «поломок» в генотипе и отражается на других органах и системах [7, 8]. Лечение четвертого фенотипа ПРС ограниченно. Интраназальные ГКС позволяют замедлять формирование и рост полипов, но при неконтролируемом течении заболевания не дают должного эффекта. В свою очередь повторные курсы системных ГКС способствуют достижению более выраженной положительной динамики, но их использование может приводить к таким побочным эффектам, как стероид-индуцированный диабет и остеопороз. Эндоскопическая хирургия ОНП при четвертом фенотипе дает временное облегчение пациенту и сопряжена с высокой частотой рецидивов [9-11]. В 2019 г. возможности терапевтических подходов в лечении ПРС тяжелого течения были расширены и сосредоточены на контроле воспалительного процесса слизистой оболочки полости носа и ОНП, называемого воспалением 2 типа (Т2). Этот тип иммунной реакции характеризуется массивной тканевой эозинофилией, инфильтрацией назальных полипов Т-хелперами 2-го типа, повышенным уровнем цитокинов 2-го типа: ИЛ-4, -5 и -13 [12-14]. При преобладании в слизистой оболочке Т2-воспаления течение ПРС отягощается, поэтому на сегодняшний день блокирование ключевых звеньев этого иммунного ответа стало основным направлением в развитии патогенетической и таргетной терапии данного заболевания. Первым биологическим препаратом лечения ПРС стало человеческое моноклональное антитело дупилумаб, эффективность которого была оценена в рандомизированном двойном слепом плацебо-контролируемом исследовании II фазы, проведенном в 2016 г. Bachert et al. [15]. Положительная динамика достигается за счет специфического связывания и блокирования а-субъединицы рецептора ИЛ-4 (-4Ra), общей для ИЛ-4 и -13 [16, 17-21].
В рассмотренном клиническом случае пациентка страдала ПРС неконтролируемого течения, характеризующимся высокой частотой рецидивов, резистентностью к местному и системному медикаментозному лечению и сопутствующей БА (четвертый фенотип), что привело к значительному ухудшению качества жизни. Принимая во внимание неэффективность предшествовавшего хирургического и медикаментозного лечения, а также соответствие пациентки критериям назначения биологической терапии больным ПРС [4, 5], принято решение не выполнять дополнительной операции, а лечить пациентку дупилумабом. Выраженная положительная динамика не только отмечена по субъективным показателям, но и подтверждена результатами объективных исследований. Благодаря биологической терапии женщина смогла полноценно вернуться к работе. Тем не менее эффект терапии сохраняется при ее постоянном получении, прерывание лечения ведет к возвращению симптоматики.
Заключение
ПРС, в патогенез которого вовлечен Т2-иммунный ответ, характеризуется неконтролируемым течением и рецидивирующим ростом полипов.
Хирургическое лечение в этом случае носит паллиативный характер, т.к. положительный эффект непродолжителен.
Биологическая терапия ПРС, блокирующая звенья Т2-иммунного ответа, не только безопасна, но и эффективна. Она назначается на неопределенно продолжительное время, перерывы в лечении ведут к возвращению симптоматики и снижению качества жизни пациента.
Согласие пациента. Отсутствует.
Конфликт интересов. Ю.П. Моисеева — чтение лекций при поддержке Sanofi. Г.З. Пискунов, С.Я. Косяков, А.А. Кирсанова, Э.Ф. Шайхутдинова заявляют об отсутствии конфликта интересов.



