Введение
Апатия (Ап) - широко распространенное состояние при многих неврологических патологиях, она является частым осложнением инсульта, которое снижает эффективность реабилитации [1-3], отрицательно влияет на качество жизни и бытовую адаптацию пациентов [4, 5], утяжеляет уход за ними [6, 7].
Согласно работам Роберта Марина, основным симптомом Ап является потеря мотивации, при этом мотивация им определяется как «направление, интенсивность и настойчивость целенаправленного поведения» [8, 9]. В последние годы синдром Ап служит объектом возросшего внимания и изучения клиницистов и ученых, работающих с нейропсихиатрической популяцией пациентов [10]. При этом Ап остается значительно менее изученной, чем другие постинсультные расстройства [6, 7, 11, 12].
Согласно рядулитературных данных, выявляется взаимосвязь Ап после инсульта с рядом фактором: старший возраст [13-15], локализация очага поражения в определенных областях головного мозга [16], худшее восстановление навыков самообслуживания после инсульта [6, 17], наличие депрессии (Д) [7, 13, 18], когнитивное снижение [1, 7, 18], коморбидность с соматическими заболеваниями [1]. Изучается наличие взаимосвязи апатии с характеристиками нарушения мозгового кровообращения. В основном не получено данных о связи Ап с объемом поражения при нейровизуализации и тяжестью инсульта [6, 19, 14], касаемо ассоциации Ап с типом инсульта не выявлено однозначной взаимосвязи [6, 14].
Цель исследования: изучить факторы риска постинсультной Ап с учетом ее коморбидности и ее влияние на процесс восстановления нарушенных неврологических функций.
Методы
Работа проводилась на кафедре неврологии, нейрохирургии и медицинской генетики лечебного факультета ФГАОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава РФ совместно с врачом - психиатром Научного центра психического здоровья. В исследование были включены пациенты, поступавшие на лечение в нейрореанимационное и неврологическое отделения ГКБ № 31, впоследствии наблюдаемые амбулаторно.
Работа проведена как проспективное наблюдение за когортой больных в течение года.
В исследование были включены 207 пациентов с впервые возникшим ишемическим инсультом. Из них 117 (56%) мужчин и 90 (44 %) женщин в возрасте от 36 до 90 лет. Средний возраст больных составил 66±12 лет. Критерии исключения: летальный исход в остром периоде инсульта, угрожающая жизни соматическая патология, невозможность связаться с родственниками пациентов с тяжелыми речевыми нарушениями.
Для оценки тяжести и динамики неврологического дефицита применялась шкала NIHSS (National Institutes of Health Stroke Scale). Оценка проводилась в первые сутки инсульта, через 14, 28 суток, 3, 6 месяцев и 1 год после инсульта. Степень инвалидизации оценивалась с помощью шкалы Рэнкина в первые сутки инсульта, через 14, 28 суток, 3, 6 месяцев и 1 год после инсульта.
Диагностика синдрома Ап проведена в соответствии с критериями Marin и Starkstein (2000) начиная со 2-й недели заболевания: оценивали наличие симптомов, относящихся к следующим доменам: поведенческий, когнитивный, домен эмоций. При выявлении нарушений в двух или трех доменах диагностировался синдром Ап; пациент попадал в группу пациентов с Ап вне зависимости от срока ее диагностики.
Депрессивные расстройства диагностировали с применением критериев DSM-IV (Diagnostic and Statistical Manual of mental disorders) по рубрикам «большой депрессивный эпизод» (более 5 признаков, обозначенных в DSM-IV), «малый депрессивный эпизод» (от 3 до 5 признаков DSM-IV). Для оценки выраженности когнитивных нарушений использованы следующие инструменты: тест MMSE, 8-цветовой тест Струпа и тест лабиринтов Векслера. С целью выявления астении (Аст) применялось структурированное клиническое интервью (выявлялись симптомы гиперестезии, ухудшения самочувствия при изменении погодных условий, утомляемости, наличия общей слабости) и Шкала оценки Аст, которая применялась только в отношении пациентов без когнитивных нарушений и речевых расстройств.
Обработка полученных данных проводилась с помощью методов математической статистики, с применением методов описательной статистики и анализа достоверности различий между группами по непараметрическому критерию Краскела-Уоллиса, непараметрическому критерию U Манна-Уитни; анализ достоверности различий между группами по качественному признаку проводился с использованием непараметрического х2-критерия.
Результаты
Постинсультная Ап выявлена у 47 (23%) человек. Данная частота несколько ниже, чем средняя, приводимая в систематических обзорах, посвященных Ап после инсульта (32-36%) [6].
Руководствуясь тем, что Ап, Д и Аст проявляются поведенческой пассивностью и частой их коморбидностью, мы выделили клинические группы (табл. 1) с применением дименсионального подхода, учитывавшего наличие коморбидной психопатологии.

В работе проводили сравнение всех групп пациентов между собой и попарное сравнение каждой группы с определенной психопатологией с группой контроля.
При сравнении групп выявлены следующие особенности: при сравнении по среднему возрасту показано, что между группами есть значимые различия по критерию Краскела-Уоллиса (табл. 2) - пациенты групп с Ап и Аст и группы с сочетанной психопатологией старше пациентов из других групп.

Далее группы сравнивались попарно по непараметрическому критерию Манна-Уитни. Выявлено, что пациенты группы со смешанной психопатологией значимо старше пациентов группы, в которой Ап сочеталась с Д (иэмп=60,50; р=0,03), и контрольной группы (иэмп=559; р=0,01). Кроме того, видно, что они на уровне тенденции старше пациентов группы пациентов с изолированной Ап (иэмп=53,00; р=0,24). Также пациенты группы, в которой Ап сочеталась с Аст, находились на уровне тенденции к более старшему возрасту по сравнению с пациентами группы с изолированной Ап (иэмп= 12,50; р=0,42) и пациентами, у которых Ап сочеталась с Д (иэмп=25,5; р=0,14), и контрольной группы (иэмп=112,5; р=0,09). Соответственно, пациенты, у которых Ап сочетался с Аст и Д, а также просто с Аст, старше пациентов других групп (табл. 2). Наши результаты соответствуют литературным данным, согласно которым старший возраст - это фактор риска и постинсультной Д, и Аст. В данной работе больные группы с изолированной Ап старше пациентов группы контроля в среднем на 1,51 года, однако эта разница не является статистически значимой (иэмп=188,50; р=0,90). Обращает на себя внимание, что коморбидные пациенты старше пациентов без Ап в среднем более чем на 5 лет. В большинстве ранее проведенных исследований пациенты с Ап были старше пациентов без апатии на 2-4 года [20-25].
При сравнении групп по полу попарно отмечены значимые различия группы с сочетанной психопатологией и контрольной группы, в группе с сочетанной психопатологией выявлено значимое преобладание женщин, в контрольной группе значимо больше мужчин и меньше женщин (х2=4,226; р=0,043). При сравнении других групп значимых различий не выявлено. Наши результаты соответствуют литературным данным, в которых преимущественно не выявлено ассоциации Ап с полом [7, 14, 18]. Тот факт, что в группе со смешанной психопатологией женщин больше, чем мужчин, характерен для постинсультной Д (М.А. Савина, 2006).
В зависимости от характеристик очага поражения выявлены следующие различия между группами: у пациентов с изолированной Ап очаг локализовался в левом полушарии (х2=6,292; р=0,043), в височных и лобных областях (Х2=4,064; р=0,044 для лобных очагов, Х2=7,312; р=0,007 для височных) значимо чаще, чем в контрольной группе. У этих пациентов очаг был чаще среднего размера (х2=12,978; р=0,002), в отличие от пациентов группы без психопатологических расстройств. У пациентов группы с Ап и Д очаг был чаще среднего размера (х2=7,235; р=0,027), чем в группе контроля. У пациентов с одновременным наличием всех трех синдромов очаг чаще локализовался в левом полушарии (х2=6,802; р=0,033), у них чаще встречаются очаги в височной доле (х2=5,591; р=0,018), чаще отмечался лейкоареоз (х2=4,052; р=0,044), очаг был чаще среднего размера, чем в группе контроля (х2=9,191; р=0,01). Наши результаты согласуются с литературными данными, согласно которым пациенты с инсультом в левом полушарии более предрасположены к развитию постинсультной Д [26, 27] и рядом данных об ассоциации Ап с очагами в левом полушарии [22, 28].
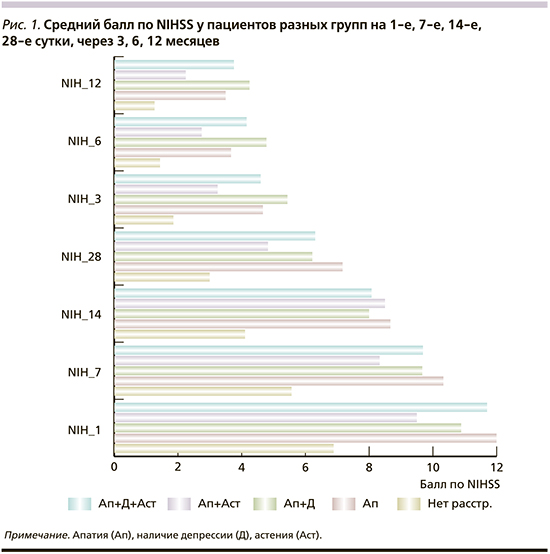
При оценке тяжести инсульта и степени выраженности инвалидизации показано, что для всех групп пациентов с психопатологией характерны более высокая исходная степень тяжести инсульта и большая выраженность инвалидизации по сравнению с таковой у пациентов контрольной группы. При динамическом наблюдении различия сохранялись (рис. 1, 2). Среди ранее проведенных исследований в работе W.K. Tang et al. [29] также выявлена взаимосвязь Ап с тяжестью инсульта; в исследовании L. Chen et al. [17] показана ассоциация наличия Ап с уровнем NIHSS на момент начала исследования. В ряде исследований Ап после инсульта отрицательно влияла на восстановление, уменьшала их функциональную независимость [1, 2, 17, 22, 29].
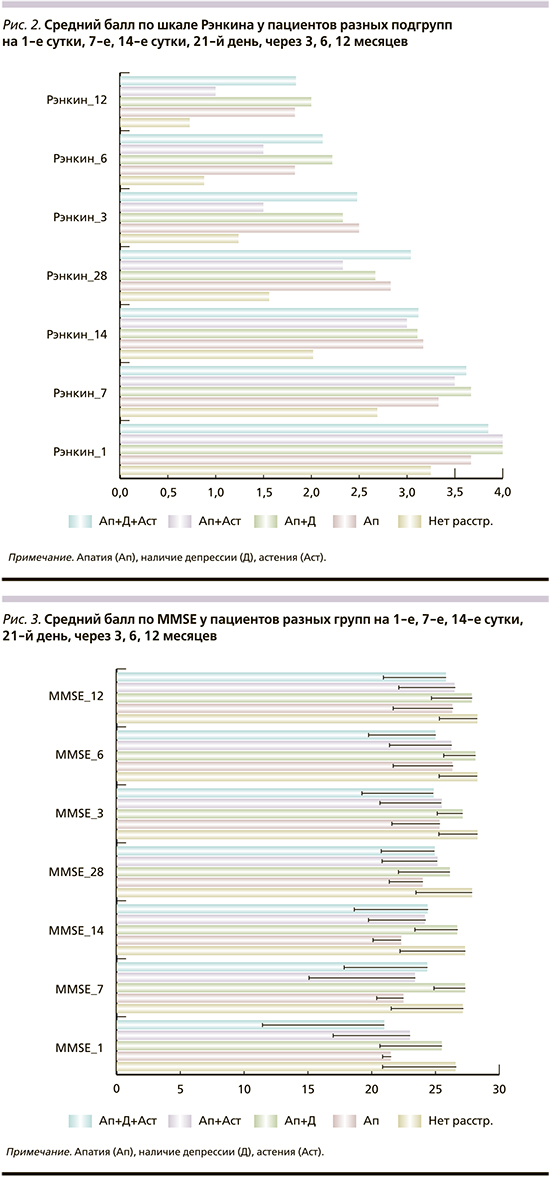
Также у пациентов с психопатологией, кроме группы с сочетанием Ап и Д, отмечались когнитивное снижение в предынсультном периоде и более низкий балл MMSE в отдельные сроки (рис. 3) по сравнению с группой контроля. По 8-цветовому тесту Струпа и тесту лабиринтов Векслера значимых различий не выявлено.
При анализе групп выявлены и другие различия. Изолированная Ап часто была ассоциирована с нерегулярным приемом лекарственных средств (Х2=10,119; р=0,38). У пациентов с сочетанием Ап и Д чаще выявлялись психические заболевания в наследственном анамнезе (х2=8,751; р=0,003), алкоголизм (х2=5,111; р=0,024), явления утомляемости (х2=9,022; р=0,003) и слабодушия (х2=6,962; р=0,008) до инсульта, чем в контрольной группе. Пациенты группы с сочетанной психопатологией наиболее часто сообщали о Д в предынсультном периоде (х2=6,618; р=0,01). Эти пациенты чаще, чем пациенты других групп, принимали лекарственные препараты (х2=4,136; р=0,042).
Заключение
Таким образом, в данном исследовании для решения задачи диагностики постинсультной Ап применялась новая методология «дименсионального» разграничения пациентов в зависимости от наличия Ап, Д и Аст. При этом получены данные о гетерогенности клинических групп по демографическим характеристикам, анамнестическим данным, характеристикам очага поражения мозга, особенностям поведения пациента в постинсультном периоде. Эти данные говорят: дименсиональный подход может быть полезным как в дальнейших исследованиях, так и в клинической практике.
Полученные данные о распространенности Ап после инсульта, выявленное ее отрицательное влияние на степень неврологического дефицита и инвалидизации говорят о необходимости диагностики и коррекции этого состояния в комплексе реабилитационных мероприятий.


