Введение
IgA-нефропатия (IgAN) - наиболее распространенная форма первичного гломерулонефрита во всем мире, остается ведущей причиной хронической болезни почек (ХБП) и терминальной почечной недостаточности (ТПН) [1]. Чаще всего IgAN протекает бессимптомно и характеризуется медленно прогрессирующим течением. Примерно у 25-30% любой когорты IgAN терминальная почечная недостаточность развивается в течение 20-25 лет от дебюта заболевания [1]. Помимо первичной формы IgAN может носить вторичный характер и быть ассоциированной с системными и аутоиммунными заболеваниями, болезнями печени, кожи, легких, кишечника [2]. Клинические проявления IgAN не различаются при первичном и вторичном вариантах болезни, в связи с этим дифференциальная диагностика базируется на исключении всех возможных вторичных причин нефропатии [2]. Согласно рекомендациям KDIGO (2021), лечение IgAN сосредоточено на неиммуносупрессивных терапевтических стратегиях, направленных на замедление темпов прогрессирования заболевания. Они включают строгий контроль артериального давления (АД) с оптимальным подавлением ренинангиотензиновой системы, ограничение поваренной соли в рационе питания, нормализацию (снижение) массы тела, повышение физической активности и отказ от курения [3]. К клиническому тупику приводит ситуация, когда исключены явные вторичные причины IgAN, а на фоне оптимальной нефропротективной терапии сохраняется активность нефрита. В контексте возможного улучшения исходов нефропатии, а также поиска новых терапевтических подходов научный интерес вызывает ассоциация IgAN и целиакии (ЦК). Отсутствие типичных жалоб и явной клинической гастроинтестинальной симптоматики, преобладание внекишечных проявлений и скрытых форм представляют определенные трудности диагностики ЦК. Исследования, направленные на изучение потенциальных патогенетических связей между IgAN и ЦК, демонстрируют убедительные результаты как на экспериментальном, так и на клиническом уровне [4-6]. При этом показано, что применение безглютеновой диеты улучшает клиническое течение IgAN [7, 8]. На сегодняшний день нет единого алгоритма диагностики ассоциации IgAN и ЦК с позиций выбора серологических маркеров (СМ), необходимости проведения генетического тестирования (HLA-DQ2, HLA-DQ8), клинической значимости морфологического исследования слизистой оболочки тонкой кишки (СОТК) в когорте взрослых. Однако, несмотря на противоречивость используемых методов диагностики ЦК у взрослых, наличие СМ как с нарушением, так и без изменений архитектоники двенадцатиперстной кишки (12ПК) усугубляют течение IgAN в виде более выраженной протеинурии, эритроцитурии, артериальной гипертензии и сниженной скорости клубочковой фильтрации (СКФ) [9, 10]. В российской популяции исследований, направленных на выявление распространенности IgAN, ассоциированной с ЦК, не проводилось. Актуальным на сегодняшний день остается вопрос, поможет ли скрининговое определение СМ ЦК без нарушения или с нарушением архитектоники кишечника с характерными морфологическими изменениями СОТК стать дополнительным диагностическим и прогностическим маркером для пациентов с IgAN.
Цель исследования: определить частоту встречаемости СМ ЦК в сыворотке крови у пациентов с IgAN, уточнить их диагностическую ценность в клинико-лабораторной картине IgAN.
Методы
В исследование были включены 50 пациентов с морфологически верифицированной IgAN. Из них 46 (92%) мужчин и 4 (8%) женщины в возрасте от 18 до 63 лет. Средний возраст мужчин составил 35,7±9,97 года, длительность основного заболевания на момент включения в исследование составила 48,0 [11,0-84,75] месяцев. Средний возраст женщин составил 39,0±8,16 года, длительность основного заболевания - 22,0 [17,0-48,0] месяца. Диагноз IgAN был установлен на основании световой и иммунофлуоресцентной микроскопии почечной ткани, полученной путем прижизненной пункционной биопсии почек. Все пациенты находились на обследовании и лечении в нефрологическом отделении ГВКГ им. Н.Н. Бурденко. Проведено одномоментное сравнительное проспективное исследование. Всем пациентам выполнено клиническое обследование, включившее сбор анамнеза и жалоб, осмотр с определением индекса массы тела (ИМТ, кг/м2), общеклинические анализы крови и мочи, определение суточной протеинурии (СПУ). В сыворотке крови оценены концентрации общего белка, альбумина, аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), креатинина, мочевины, мочевой кислоты, иммунглобулина А (IgA). Произведен расчет СКФ по формуле CKD-EPI, выполнено ультразвуковое исследование почек для оценки их размеров, исключения аномалии развития и нефролитиаза; измерение АД выполнялось стандартным методом. Для всех больных специальным методом исследования стало определение в сыворотке крови антител IgA к тканевой трансглютаминазе (АТ 1дАк ТТГ) и деамидированным пептидам глиадина (АТ IgA к ДПГ) с помощью наборов для иммуноферментного анализа «ELISA» (Euroimmun, Германия) с расчетом относительных единиц/мл в исследуемом образце, часть пациентов обследованы на наличие антител IgA к эндомизию с помощью наборов для непрямого иммунофлюоресцентного анализа (Euroimmun, Германия): единицы измерения—титр, другая часть пациентов на наличие антител 1дАи IgG к ретикулину с помощью непрямой иммунофлуоресценции: единицы измерения—титр. Всем пациентам с выявленным уровнем СМ выше референсных значений проводилась фиброгастродуоденоскопия, части больным — биопсия из залуковичного отдела 12ПК с последующим морфологическим исследованием. В результате сформированы две группы: I группа (n=10) - пациенты с IgAN и положительными СМ; II (n=40) — пациенты с IgAN и отрицательными СМ. Статистический анализ полученных данных проводился с использованием программ StatTech v.2.6.1 (ООО «Статтех», Россия), SPSS Statistics 26.0 (IBM, США). Рассчитаны медиана (Me) с межквартильным размахом (Q1-Q3), среднее со стандартным отклонением (M±SD) и доверительным интервалом (95% ДИ). Для выявления межгрупповых различий использован U-критерий Манна-Уитни, t-критерий Стьюдента. Категориальные данные описывались с указанием абсолютных значений и процентных долей. Сравнение процентных долей при анализе четырехпольных таблиц сопряженности выполнялось с помощью точного критерия Фишера (при значениях ожидаемого явления менее 10). Прогностическая модель, характеризующая зависимость количественной переменной от факторов, разрабатывалась с помощью метода линейной регрессии. Для оценки диагностической значимости количественных признаков при прогнозировании определенного исхода применялся метод анализа ROC-кривых. Разделяющее значение количественного признака в точке cut-off определялось по наивысшему значению индекса Юдена. Нулевую статистическую гипотезу об отсутствии различий и связей опровергали при р<0,05.
Результаты
На этапе сбора информации причин обращения за медицинской помощью у пациентов с IgAN выделить специфические гастроинтестинальные симптомы (боль в животе, метеоризм, запор, диарея, потеря массы тела), которые могли бы направить клинициста в сторону дополнительных методов диагностики, в т.ч. определения СМ ЦК в крови, не удалось в обеих группах. На рис. 1 продемонстрировано, что пациенты I группы чаще жаловались на общую слабость, отеки и субъективно ощущали повышение АД. Во II группе чаще выявляли дискомфорт в поясничной области, дизурию и изменение цвета мочи.
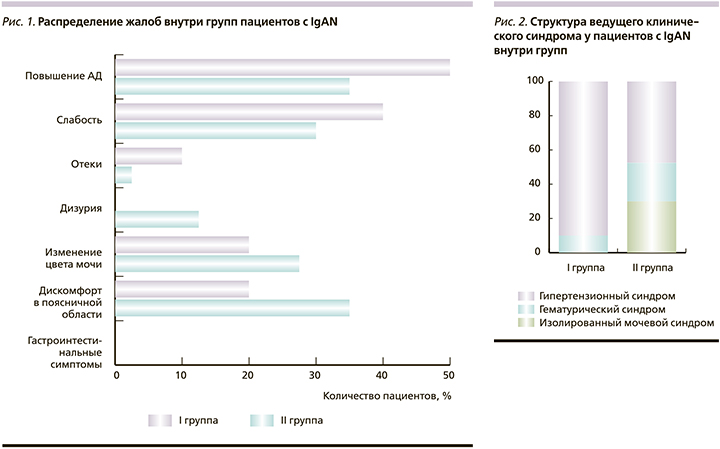
Нам удалось выяснить, что у пациентов I группы клиническая манифестация IgAN отмечалась в виде гипертензивного синдрома, в то время как у пациентов II группы частота гипертензивного синдрома была ниже и сопоставимой с изолированным мочевым и гематурическим синдромами (рис. 2).
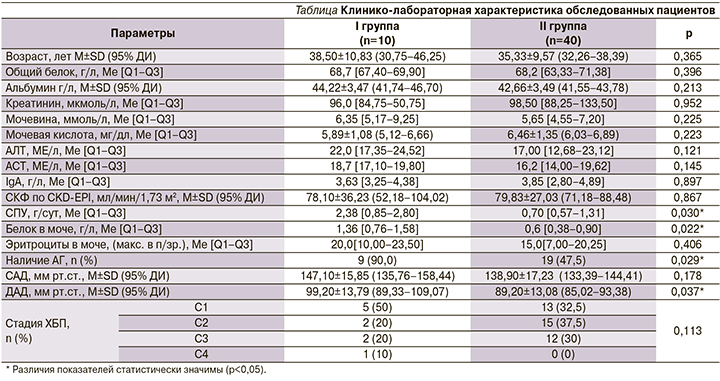
АТ IgA к ТТГ, превышающие 20 отн. ед/мл; АТ IgA к ДПГ, превышающие 25 отн. ед/мл; АТ IgA к эндомизию >1:5, АТ к ретикулину IgA и IgG>1:10 мы принимали за «положительные» значения. Положительные СМ выявлены у 20% больных IgAN. В 100% случаев положительными СМ стали АТ IgA к ДПГ, у одного пациента отмечалось одновременное повышение антител АТ IgA к ДПГ и АТ IgA к ТТГ. Ни в одном из случаев не было отмечено повышения уровня АТ к ретикулину и эндомизию (рис. 3).
Всем пациентам I группы выполнялась фиброгастродуоденоскопия, нарушения архитектоники кишки (уплощение или исчезновение циркулярных складок слизистой оболочки 12ПК, появление поперечной исчерченности складок, ячеистого рисунка или микронодулярной структуры слизистой) обнаружено не было. Пяти пациентам произведен забор биоптатов залуковичного отдела 12ПК, согласно гистологической классификации Marsh, все они были отнесены к Marsh 0-1 [11].
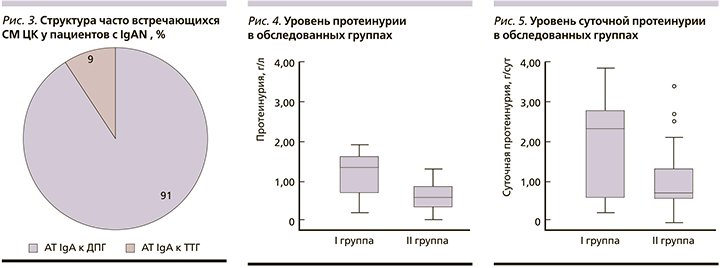
В таблице приведены основные клинико-лабораторные данные обследованных пациентов.
Статистически значимых различий по основным показателям биохимического анализа крови обнаружено не было. Уровни протеинурии, отражавшие активность нефропатии у пациентов I группы, превалировали по сравнению с показателями II группы. Средняя концентрация белка в моче пациентов I группы составила 1,36 (0,76-1,58) г/л и статистически значимо превышала ее у пациентов II группы - 0,6 (0,38-0,90) г/л (р=0,022) (рис. 4). Средняя концентрация белка в суточной порции мочи/ пациентов I группы составила 2,38 (0,85-2,8) г/сут и статистически значимо превышала ее аналогичный уровень у пациентов II группы 0,7 (0,57-1,31) г/ сут (р=0,030) (рис. 5).
Оценена зависимость суточной протеинурии от уровня антител IgA к ДПГ с помощью линейного регрессионного анализа. Наблюдаемая зависимость суточной протеинурии от уровня АТ IgA к ДПГ описывается уравнением линейной регрессии: Ycny=0,885+0,022XAT IgA к ДПГ, где Y — величина суточной протеинурии (г/сут), ХАТ IgA к ДПГ - АТ IgA к ДПГ (отн. ед/мл).
При увеличении уровня АТ IgA к ДПГ на 1 отн.ед/мл следует ожидать увеличение суточной протеинурии на 0,022 г/сут. Полученная регрессионная модель характеризовалась коэффициентом корреляции rxy=0,466, что соответствовало умеренной тесноте связи по шкале Чеддока. Модель была статистически значимой (p<0,001). Полученная модель объясняет 21,8% наблюдаемой дисперсии суточной протеинурии (рис. 6).
Нами была сопоставлена частота артериальной гипертензии (АГ) в зависимости от выявления повышенных СМ у пациентов с IgAN. В соответствии с полученными данными частота АГ была статистически значимо выше в I группе по сравнению со II (р=0,029). Шансы наличия АГ в I группе были выше в 9,947 раза по сравнению с группой II (95% ДИ: 1,150-86,012) (рис. 7).
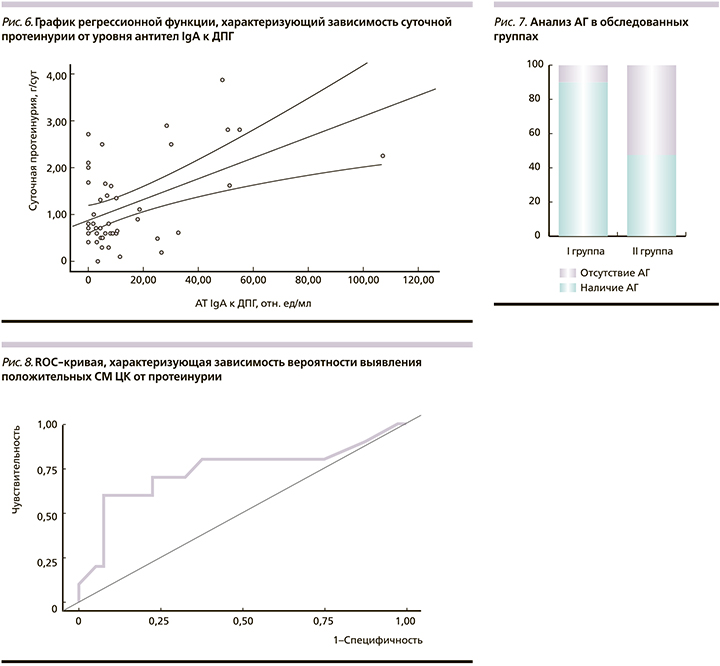
Среднее диастолическое АД было статистически значимо выше в I группе: 99,20±13,79 (89,33-109,07) мм рт.ст. по сравнению со II группой: 89,20±13,08 (85,02-93,38) мм рт.ст. (р=0,037). По уровню систолического АД значимых различий выявлено не было.
При оценке зависимости вероятности выявления положительных СМ ЦК от уровня протеинурии с помощью ROC-анализа была получена следующая кривая (рис. 8).
Площадь под ROC-кривой составила 0,736±0,097 с 95% ДИ: 0,546-0,927. Полученная модель была статистически значимой (p=0,022). Пороговое значение протеинурии в точке cut-off, которому соответствовало наивысшее значение индекса Юдена, составило 0,96 г/л. Наличие маркеров ЦК прогнозировалось при значении протеинурии выше данной величины или равном ей. Чувствительность и специфичность модели составили 70,0 и 77,5% соответственно.
Обсуждение
Влияние ЦК на клиническое течение IgA-нефропатии вызывает научный интерес с позиций потенциально схожего патогенеза с активацией MALT-системы (mucosa-associated lymphoid tissue - лимфоидная ткань, ассоциированная со слизистыми оболочками), участия глютена как триггерного фактора в развитии гломерулонефрита или как причину, усугубляющую уже имеющееся гломерулярное заболевание. Ранее считалось, что ЦК - болезнь, характерная исключительно для детей, однако в настоящее время известно, что данная патология встречается во всех возрастных группах, включая пожилых людей. Более 70% новых случаев ЦК диагностируется в возрасте старше 20 лет [12]. У части пациентов заболевание было пропущено в детском возрасте, у других - развилось во взрослом возрасте. В западных странах распространенность гистологически подтвержденной ЦК составляет 0,6%, а серологический скрининг увеличивает частоту данной патологии до 1,0% [12]. Отмечено, что у пациентов с IgAN распространенность ЦК достигает 3,6% [13]. R. Nurmi et al. (2021) предоставили данные оригинального исследования, где частота выявления аутоиммунитета против ЦК у пациентов с IgAN составила 8% [14]. Согласно нашим предварительным данным, частота выявления целиакийных антител у пациентов с IgAN составила 20%. Проанализировав литературу, нами отмечена тенденция, согласно которой с каждым новым исследованием в этой области частота выявления целиакийных антител у пациентов с IgAN повышалась, а диагноз ЦК чаще выставлялся на основании положительной серологии без проведения морфологического исследования СОТК.
Изучение распространенности ЦК ограничено определенными (доступными) диагностическими методами в конкретном исследовании. Сделан следующий вывод: на сегодняшний день нет общепризнанных алгоритмов диагностики данной ассоциации, в т.ч. с позиции выбора лабораторных тестов. Нам удалось выяснить, что авторы чаще всего использовали АТ IgA к ТТГ и АТ IgA к эндомизию [15, 16]. Вероятно, это связано с тем, что данные тесты обладают высокой чувствительностью и специфичностью, рекомендованы в качестве теста первой линии с целью отбора пациентов для дальнейшего эндоскопического обследования [17]. Мы использовали в качестве скрининга ЦК набор серологических тестов: АТ IgA к ТТГ, ATIgA к ДПГ, АТ к IgA эндомизию и АТ IgA и IgG к ретикулину. В нашем исследовании в подавляющем большинстве выявлялись АТ IgA; ДПГ. В исследовании Е.А. Сабельниковой и соавт. (2014) показано, что иммунологический тест - определение АТ IgA к ДПГ высокоспецифично и чувствительно для диагностики ЦК у взрослых. Проведенный анализ уровня и частоты повышения уровня АТ к ДПГ и ТТГ классов IgA и IgG показал, что в сыворотке крови лиц с впервые диагностированной ЦК частота повышенных титров АТ к ДПГ и к ТТГ класса IgA была одинаковой и составила 92,5% [18]. Исследования показывают, что специфичность и чувствительность метода определения АТ IgA к ДПГ составляют 90 и 92% соответственно [18]. Имеются отдельные работы, указывающие на то, что АТ к ДПГ появляются раньше, чем АТ к ТТГ, а также быстрее исчезают при соблюдении безглютеновой диеты, и это должно учитываться при мониторинге пациентов, соблюдающих диету [19]. Принимая во внимание отсутствие специфической симптоматики со стороны желудочно-кишечного тракта, отсутствие отягощенного наследственного анамнеза по ЦК, мы не использовали генетическое исследование в качестве скринингового метода, т.к. данный метод диагностики предназначен для исключения ЦК в сложных диагностических случаях. При этом наличие гаплотипов HLA DQ2/DQ8 характерно для 30% здорового населения [18]. Диагностика ЦК базируется на оценке клинических данных, результатах серологических и морфологических исследований. Для постановки диагноза ЦК изолированного повышения титра СМ недостаточно. На сегодняшний день ведутся споры о выделении «потенциальной» формы ЦК, для которой характерно бессимптомное течение, наличие положительных СМ с наличием в генотипе аллелей HLA - DQ2/DQ8, но в отсутствие (Marsh 0) или минимальных (Marsh 1) изменениях со стороны СОТК [18]. Чтобы подчеркнуть диагностическую значимость выявленных СМ, зарубежные авторы используют термины «целиакийный аутоиммунитет», «субклиническая целиакия», мы в свою очередь в ранее опубликованных работах использовали термин «нарушение обмена глютена», т.к. клинической симптоматики, изменений СОТК еще нет, а иммунологические маркеры ЦК уже выявляются. Независимо от применяемого термина нам удалось выявить статистически значимые различия внутри групп по основным показателям активности нефропатии. Полученные данные демонстрируют тот факт, что группа, где выявлялись СМ ЦК проявления IgAN, характеризовалась более выраженной протеинурией и высокими цифрами АД, теми показателями, которые влияют на скорость прогрессирования ХБП.
Заключение
Полученные нами данные подтверждают тот факт, что у пациентов с IgAN в 20% выявляются СМ ЦК. Несмотря на то что у пациентов с положительными СМ отсутствовали гастроинтестинальные симптомы, а выполнение фиброгастродуоденоскопии с морфологическим исследованием биоптата залуковичного отдела 12ПК не дало убедительных данных за нарушение архитектоники кишечника и специфических гистологических изменений, характерных для ЦК, нам удалось выявить статистически значимые различия клинико-лабораторных характеристик больных IgAN с положительными и отрицательными СМ ЦК. Их повышение у пациентов IgAN в большей степени сопровождается более выраженной протеинурией и АГ, характеризуя активность нефропатии и тем самым потенциально ускоряя прогрессирование ХБП. Скрининговое обнаружение СМ без нарушения архитектоники кишечника и специфических морфологических изменений кишечного биоптата может стать дополнительным диагностическим и прогностическим маркером для пациентов с IgAN и позволит расширить возможности терапевтического воздействия. В то же время необходимо продолжить исследования этой проблемы как на клиническом, так и на экспериментальном уровне.


