Анемия – клинико-гематологический синдром, характеризующийся снижением концентрации гемоглобина в единице объема крови. Анемией страдает население как слаборазвитых, так и экономически развитых стран. Она развивается у людей любого возра-ста, но значительно чаще ею страдают дети и беременные женщины [1, 2]. У детей уровень гемоглобина необходимо оценивать в зависимости от возраста. Анемия диагностируется при снижении гемоглобина ниже 110 г/л у детей в возрасте до 5 лет, ниже 115 г/л – в возрасте от 5 до 12 лет, ниже 120 г/л – старше 12 лет [2, 3] (табл. 1).
На основании анализа эритроцитарных индексов все анемии разделяются на микроцитарные (гипохромные), нормоцитарные (нормохромные) и макроцитарные (гиперхромные) (табл. 2) [4].
Анемия является неспецифическим симптомом, она может быть проявлением многих патологических состояний, как связанных с первичным поражением системы кроветворения, так и не зависящих от нее.
Несмотря на разнообразие вариантов анемии, существует всего лишь три механизма ее развития:
- Нарушение эритропоэза (выработка эритроцитов красным костным мозгом).
- Укорочение жизни эритроцитов или их гемолиз (разрушение).
- Острое или хроническое кровотечение.
При некоторых видах анемии возможно сочетание этих механизмов. Анемии у детей с хронической патологией желудочно-кишечного тракта (ЖКТ) встречаются часто, иногда являются единственным первым признаком хронического заболевания. Частота анемии при патологии ЖКТ, по разным данным, составляет от 6 до 74 % [5] (табл. 3).
У детей с хронической патологией ЖКТ чаще всего наблюдаются анемии вследствие дефицита железа, витаминов (В12, фолиевой кислоты), постгеморрагические анемии (острые и хронические), анемии хронических заболеваний. Данные состояния могут быть спровоцированы как кровопотерей (чаще хронической на фоне эрозивно-язвенных процессов ЖКТ, полипоза, микродиапедезных кровотечений), так и недостатком поступления и всасывания микроэлементов и витаминов.

По данным ВОЗ, железодефицитная анемия (ЖДА) занимает первое место среди всех анемий. Она характеризуется нарушением эритропоэза из-за дефицита железа вследствие несоответствия между поступлением и расходом железа, снижением наполнения гемоглобина железом [4, 6].
Основные причины развития железодефицитных состояний:
- нарушения питания (нарушение поступления железа с продуктами питания);
- глистные инвазии (повышенный расход железа, микрокровопотери);
- патология ЖКТ (ограничение поступления железа с пищей на фоне диеты, хронические кровопотери – эрозии, язвы, микродиапедезные кровотечения; нарушение всасывания железа за счет атрофических изменений слизистой ЖКТ).
Наиболее частой причиной развития ЖДА у детей с хронической патологией служат кровопотери, которые могут возникать из верхних и нижних отделов ЖКТ. Причиной кровопотерь в 85 % случаев является патология верхних отделов ЖКТ (пищевод, желудок, 12-перстная кишка), в 14 % – толстая кишка и только в 1 % случаев – тонкая кишка. Патология со стороны верхних отделов ЖКТ (эрозивно-язвенные поражения, варикозно-расширенные вены пищевода) чаще приводит к развитию массивной острой кровопотери, что проявляется острой постгеморрагической анемией [7–9]. При острой постгеморрагической анемии одномоментно теряется большой объем (более 10 %) крови. Это ургентное состояние, требующее немедленного устранения источника кровотечения. Под хронической постгеморрагической анемией подразумевают длительно сохраняющуюся потерю небольших объемов крови, превышающую способность организма восстанавливать утраченную кровопотерю [10, 11]. Развитие хронической постгеморрагической и ЖДА при патологии верхних отделов ЖКТ встречается значительно реже, чем при хронической патологии тонкой и толстой кишки [11]. В 35–90 % случаев кровотечения из толстой кишки останавливаются самостоятельно, но часто вновь возобновляются, приводя к развитию стойкой анемии смешанного генеза (постгеморрагической и железодефицитной) [12]. Хронические ВЗК нередко протекают под маской функциональных нарушений кишечника, а анемию у этих детей рассматривают как отдельное заболевание.
Клинический пример 1. Мальчик 1 года 10 месяцев обратился к гастроэнтерологу в связи дефицитом массы, жалобами на стул со склонностью к запорам и избирательный аппетит. Беременность и роды протекали нормально. Грудное вскармливание до настоящего времени. Мама употребляла в пищу большое количество молочных продуктов. У ребенка с 2-месячного возраста отмечено снижение уровня гемоглобина до 105 г/л, цветового показателя – до 0,8. С 5-месячного возраста у ребенка появились высыпания на коже в виде проявлений атопического дерматита, в кале периодически выявлялись примесь крови в виде точек и темных прожилок. Мама отменила в своем питании все продукты на основе коровьего молока и говяжье мясо, но ввела в свой рацион питания до 1 литра цельного козьего молока. Через 2 недели у ребенка отмечено нарастание беспокойства, срыгиваний (сразу после еды и «отсроченных»), появление рвоты до 5 раз в сутки.
С того момента отмечено отставание в прибавке массы, постоянная примесь крови и слизи в кале в большем количестве. К году в анализе крови гемоглобин – 77 г/л, цветовой показатель – 0,7. Врач порекомендовал прием препарата железа. Через 10 дней терапии железом мама самостоятельно отменила лечение в связи с тем, что стул стал темным. В возрасте 1 года 10 месяцев у ребенка дефицит массы 23 %, уровень гемоглобина – 103 г/л, цветовой показатель – 0,79, уровень сывороточного железа снижен – 6,8 мкмоль/л (норма – 6,9–29), ферритин низкий – 7 нг/мл (норма – 30–130). На основании результатов проведенного обследования диагностирована ЖДА, которая стала следствием микродиапедезных кровотечений за счет гастроинтестинальной формы пищевой аллергии, что в дальнейшем привело к нарушению питания, избирательности аппетита (мальчик отказался от мяса), развитию функциональных запоров.
На фоне соблюдения диетических рекомендаций (полная элиминация молочных продуктов, назначение аминокислотной смеси Неокейт адванс) явления атопического дерматита купировались, самочувствие ребенка улучшилось, за месяц прибавка в массе составила 500 граммов, аппетит повысился, стул самостоятельный 1 раз в сутки. После проведения курса терапии препаратом железа на основе гидроксид-полимальтозного комплекса Мальтофером внутрь из расчета 5 мг на кг массы в сутки через 3 месяца полная нормализация гемоглобина, содержания сывороточного железа и ферритина крови.
Воспалительные заболевания кишечника часто сопровождаются развитием анемии. Анемия при ВЗК выявляется в 35–50 % случаев, несколько чаще развивается при язвенном колите (ЯК), чем при болезни Крона (БК) [11–13]. По нашим данным, у 37,6 % детей с хроническим колитом выявлена ЖДА, однако латентный дефицит железа – у 97 % [14, 15]. Механизм развития анемии при ВЗК связан не только с кровопотерей, нарушением поступления железа в организм (на фоне жесткой диеты, воспаления слизистой кишечника), но и вследствие длительного повышения уровня провоспалительных цитокинов (ФНО-α, интерлейкинов-1, -6, -10, γ-интерферона), что приводит к нарушению метаболизма железа и угнетению костномозгового кроветворения, т.е. к развитию анемии хронических заболеваний (АХЗ) [13].
В настоящее время исследуется роль гепсидина как недостающего связующего звена в сложном механизме эритропоэза. Гепсидин – это 20–22- или 25-аминокислотный мелкий пептид, синтезируемый в печени и определяемый в сыворотке крови и моче. Он обладает противомикробным действием, его уровень повышается при любых воспалительных заболеваниях. Гепсидин является прямым медиатором в патогенезе АХЗ, непосредственно снижая абсорбцию железа в тонкой кишке и блокируя выход его из макрофагов [16, 17]. Анемия хронических заболеваний встречается при хронических воспалительных процессах различных органов (легких, почек, печени, ЖКТ), в т.ч. вызванных инфекционными агентами, при системных заболеваниях соединительной ткани, эндокринной патологии и при новообразованиях различной локализации, аллергических и аутоиммунных заболеваниях ЖКТ. Чаще встречаются нормохромные анемии или умеренно гипохромные [18]. По распространенности АХЗ у пациентов с хронической патологией ЖКТ занимают второе место после ЖДА [19]. Анемия хронических заболеваний характеризуется снижением уровня сывороточного железа, ОЖСС, трансферрина и повышением содержания сывороточного ферритина. Ферритин относится к острофазным белкам воспаления, поэтому повышенный уровень сывороточного ферритина при АХЗ служит проявлением воспаления, что не позволяет его использовать в качестве показателя запасов железа [20].
Ошибочная диагностика ЖДА при АХЗ может повлечь назначение препаратов железа (парентерально) с последующим развитием вторичного гемосидероза. В настоящее время для дифференциальной диагностики ЖДА и АХЗ используется новый лабораторный параметр – растворимый рецептор трансферрина (sTfR) [21]. Результаты исследований свидетельствуют о высокой диагностической ценности данного теста [22].
Не все гипохромные анемии железодефицитные. Наличие гипохромной анемии не исключает гипохромную анемию другого происхождения. Необходимо проведение дифференциальной диагностики между ЖДА и сидероахрестическими анемиями, при которых содержание железа в организме находится в пределах нормы или даже имеется его избыток [3]. В силу различных причин железо не используется для построения гема в молекуле гемоглобина, что приводит к образованию гипохромных эритроцитов с низким содержанием гемоглобина. Неиспользованное железо запасается организмом, откладывается в органах и тканях, приводя к развитию гемосидероза. Дифференциальный диагноз гипохромных анемий нужно проводить между ЖДА, АХЗ, талассемией, анемией на фоне хронической интоксикации лекарственными препаратами или солями тяжелых металлов. В практике педиатра наиболее часто встречаются ЖДА и АХЗ, дифференциальный диагноз между ними приведен в табл. 4 [23].
 Заболевания тонкой кишки, сопровождающиеся развитием синдрома мальабсорбции, приводят к дефициту белка, микроэлементов и витаминов, регулирующих эритропоэз (железа, меди, цианкобаламина, фолиевой кислоты и др.), вследствие чего дефицитная анемия – закономерный процесс при целиакии, экссудативной энтеропатии. При патологии стенки тонкой кишки (экссудативная энтеропатия) анемия носит железодефицитный характер за счет хронической потери с лимфой сывороточного железа и трансферрина через эктазированные лимфатические сосуды кишечника. Анемия при целиакии выявляется у 40–67 % детей [24, 25]. Вследствие атрофии тонкой кишки отмечается значительное нарушение всасывания железа, фолиевой кислоты, витамина В12, аминокислот и других нутриентов, необходимых для полноценного эритропоэза. Однако и сама анемия сопровождается развитием энтеропатии в виде дегенеративно-дистрофических процессов в пищеварительном канале, приводящих к ахлоргидрии, снижению активности пепсина, амилазы, трипсина, нарушению процессов пищеварения и абсорбции, создавая порочный круг для больных целиакией. Доказано, что в наибольшей степени страдает всасывание железа, что определяет преимущественно железодефицитный характер анемии при целиакии [26]. При латентнотекущей целиакии ЖДА выявляется у 2,8 % больных как первый признак заболевания [27].
Заболевания тонкой кишки, сопровождающиеся развитием синдрома мальабсорбции, приводят к дефициту белка, микроэлементов и витаминов, регулирующих эритропоэз (железа, меди, цианкобаламина, фолиевой кислоты и др.), вследствие чего дефицитная анемия – закономерный процесс при целиакии, экссудативной энтеропатии. При патологии стенки тонкой кишки (экссудативная энтеропатия) анемия носит железодефицитный характер за счет хронической потери с лимфой сывороточного железа и трансферрина через эктазированные лимфатические сосуды кишечника. Анемия при целиакии выявляется у 40–67 % детей [24, 25]. Вследствие атрофии тонкой кишки отмечается значительное нарушение всасывания железа, фолиевой кислоты, витамина В12, аминокислот и других нутриентов, необходимых для полноценного эритропоэза. Однако и сама анемия сопровождается развитием энтеропатии в виде дегенеративно-дистрофических процессов в пищеварительном канале, приводящих к ахлоргидрии, снижению активности пепсина, амилазы, трипсина, нарушению процессов пищеварения и абсорбции, создавая порочный круг для больных целиакией. Доказано, что в наибольшей степени страдает всасывание железа, что определяет преимущественно железодефицитный характер анемии при целиакии [26]. При латентнотекущей целиакии ЖДА выявляется у 2,8 % больных как первый признак заболевания [27].
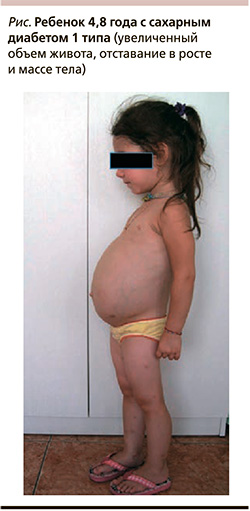
Клинический пример 2. Девочка 4,8 года наблюдается в КДПО ТДГБ Москвы (главный врач – профессор И.М. Османов). Ребенок от физиологической беременности и родов, родилась с нормальными массо-ростовыми показателями. На грудном вскармливании до трех месяцев жизни, затем ребенок получал адаптированные молочные смеси и с 5–6 месяцев введены в питание глютенсодержащие каши. До 3,5 лет развитие ребенка соответствовало возрасту. В 3,5 года выявлен сахарный диабет 1 типа, ребенок наблюдался в эндокринологическом центре, инсулинотерапия подобрана со стабильной компенсацией по гликемии. Однако через 4 месяца от начала заболевания у ребенка выявляются увеличение в объеме живота, учащенный разжиженный стул, далее отставание в массе и росте (см. рисунок). Вес – 14,7 кг (10,8 perc, -1,24 SD), рост – 95 см (0,4 perc, -2,66 SD). Ультразвуковое исследование органов брюшной полости выявило диффузные изменения поджелудочной железы, расцененные педиатром как панкреатит, в связи с чем ребенку были назначены ферментные препараты на основе панкреатина, прием которых не привел к ожидаемому эффекту. В анализе крови через 7 месяцев обнаружена анемия гипохромная, микроцитарная средней степени (Hb 80 г/л), отмечен кариес временных зубов. К 4,5 годам стало отмечаться извращение вкуса.
С учетом нарастания клиники мальабсорбции, задержки физического развития, развития стойкой анемии проведено исследование крови для исключения целиакии. Выявлены антитела к тканевой трансглутаминазе IgA > 500 (при норме 0–10 ЕД/мл), антитела к эндомизию Ig G > 1 : 5, что послужило показанием к проведению эндоскопического обследования с биопсией из двенадцатиперстной кишки. По данным морфологического исследования была выявлена атрофическая энтропатия Marsh 3B–3C, что стало подтверждением диагноза целиакии у данного ребенка. Кроме того, нами проведено генотипирование по HLA-системе, обнаружен генотип DQ2о. В связи с подтвержденной целиакией и наличием ЖДА средней степени тяжести назначен Мальтофер внутримышечно.
Мегалобластные анемии встречаются при патологии ЖКТ и представляют собой группы заболеваний, характеризующихся нарушением синтеза ДНК, в результате чего нарушается деление всех быстропролиферирующих клеток (гемопоэтических, клеток кожи, ЖКТ, слизистых оболочек). Кроветворные клетки относятся к наиболее быстро размножающимся элементам, поэтому анемия, а также нередко нейтропения и тромбоцитопения выходят в клинике на первый план [10]. Основной причиной мегалобластной анемии служит дефицит цианкобаламина или фолиевой кислоты.
Пернициозная анемия (от лат. perniciosus – гибельный, опасный), или В12-дефицитная анемия, или мегалобластная анемия, или болезнь Аддисона–Бирмера, или (устаревшее название) «злокачественное малокровие» – заболевание, обусловленное нарушением кроветворения из-за недостатка в организме витамина В12. Особенно чувствительны к дефициту этого витамина костный мозг и ткани нервной системы. Заболевание чаще встречается среди людей пожилого возраста с атрофическим гастритом в связи с недостаточным поступлением в организм витамина В12. Запасы витамина В12 составляют от 2000 до 5000 мкг, более половины из них хранятся в печени. Запасы печени прогрессивно увеличиваются с возрастом, но ежедневно через желчевыводящие пути теряется от 1 до 4 мкг витамина В12.
В соответствии с Международной статистической классификацией болезней, травм и состояний, влияющих на здоровье, 10-го пересмотра [28] выделяют следующие формы анемий, связанных с дефицитом витамина В12:
- D 51.0. Витамин-В12-дефицитная анемия вследствие дефицита внутреннего фактора;
- D 51.1. Витамин-В12-дефицитная анемия вследствие избирательного нарушения всасывания витамина В12 с протеинурией;
- D 51.2. Дефицит транскобаламина II;
- D 51.3. Другие витамин-В12-дефицитные анемии, связанные с питанием;
- D 51.8. Другие витамин-В12-дефицитные анемии;
- D 51.9. Витамин-В12-дефицитная анемия неуточненная.
Основные причины развития В12 дефицитной анемии представлены в табл. 5.
Клинический пример 3. Девочка 15 лет обратилась к врачу с жалобами на привкус металла во рту, ощущение волоса на языке. Отмечает общую слабость, онемение кончиков пальцев, головокружения и при физической нагрузке онемение стоп. Девочка соблюдает вегетарианскую диету в течение последних 6 месяцев, в течение последнего месяца беспокоят запоры, чередующиеся с поносами. Из анамнеза известно, что в 12-летнем возрасте ребенок перенес травму живота, была проведена резекция части подвздошной кишки (15 см) и аппендэктомия. Через 3 года в анализе крови выявлено снижение гемоглобина до 72 г/л, снижение эритроцитов до 2,5 × 1012, цветовой показатель, норма – 0,86. В биохимическом анализе крови отмечено повышение общего билирубина до 48 мкмоль/л (норма – до 21), снижение уровня общего белка до 6,0 г/дл (норма – 6,6–9,0 г/дл), уровни ферритина и сывороточного железа в пределах нормы. При проведении эзофагогастродуоденоскопии выявлен поверхностный дуоденит. При УЗИ органов брюшной полости обнаружены признаки гипомоторной дисфункции желчного пузыря.
В копрограмме обнаружена слизь в большом количестве, немного непереваренной растительной клетчатки и мыл. В анализе крови выявлены антитела к аскаридам в диагностически значимом титре. Состояние расценено как течение нормохромной анемии средней степени тяжести, аскаридоз.

Девочка получила противоглистную терапию Немазолом 400 мг однократно. Педиатром назначен препарат железа Актиферрин в возрастной дозировке перорально на 2 месяца, лечение продолжалось в течение двух месяцев без эффекта. С учетом отсутствия эффекта от проводимой терапии проведено определение уровня витамина В12 в крови, что подтвердило наличие у ребенка В12-дефицитной анемии (резекция – 15 см подвздошной кишки в раннем детстве). Уровень В12 оказался сниженным в 1,5 раза от нормы. На фоне внутримышечного введения витамина В12 через 2 недели отмечено значительное улучшение состояния ребенка. Девочка стала более активной, снизилась утомляемость, купировались боли в животе. Через 4 недели от начала терапии парестезии сохранялись только при физических нагрузках, уровень гемоглобина поднялся до 114 г/л, цветовой показатель равен 1,0.
Данное клиническое наблюдение показывает ошибки ведения данного ребенка, поскольку не была учтена возможность В12-дефицитной анемии. При нормальных цифрах цветового показателя, уровня ферритина и сывороточного железа был поставлен диагноз ЖДА и начато лечение препаратами железа, которое оказалось неэффективным.
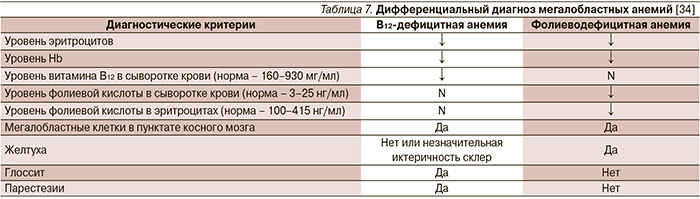
Фолиеводефицитная анемия – заболевание, характеризующееся мегалобластным типом кроветворения в результате нарушения синтеза ДНК (табл. 6). Чаще развивается у лиц молодого возраста, детей, у беременных женщин [30]. Фолаты всасываются в двенадцатиперстной кишке и верхнем отделе тощей кишки. В эпителиальных клетках полиглутаматы восстанавливаются до дигидро- и тетрагидрофолатов, которые связываются с белками и транспортируются в форме метилтетрагидрофолата, где с цианкобаламином участвуют в биосинтезе пуриновых и пиримидиновых нуклеотидов, в превращениях аминокислот (гистидина в глутаминовую кислоту), необходимых для образования ДНК. Общее количество фолиевой кислоты в организме человека – около 70 мг, третья часть представлена печеночными запасами. В условиях дефицита фолиевой кислоты нарушается процесс эритропоэза и развивается мегалобластный тип кроветворения [31].

В соответствии с Международной статистической классификацией болезней, травм и состояний, влияющих на здоровье, 10-го пересмотра [28] выделяют следующие формы анемий, связанных с дефицитом фолиевой кислоты:
- Фолиеводефицитная анемия (D 52).
- D 52.0. Фолиеводефицитная анемия, связанная с питанием.
- Мегалобластная алиментарная анемия.
- D 52.1. Фолиеводефицитная анемия медикаментозная (при необходимости идентифицировать лекарственное средство используют дополнительный код внешних причин [класс XX]).
- D 52.8. Другие фолиеводефицитные анемии.
- D 52.9. Фолиеводефицитная анемия неуточненная.
Клинический пример 4. Мальчик 10 месяцев поступил в гастроэнтерологическое отделение ТДГБ (зав. отд. – Л.А. Катаева) в связи с задержкой моторного развития. Отмечены вялость, отказ от еды, периоды беспокойства. Ребенок от физиологически протекавшей беременности родился массой 3100 граммов ростом 50 см, до трех месяцев находился на грудном вскармливании. Летом мама с ребенком уехала в деревню к родственникам, где в связи с гипогалактией вскармливала малыша цельным козьим молоком. Прикормы не вводились. В возрасте 10 месяцев впервые обратились в поликлинику. Вес ребенка составил 7100 граммов (недостаток массы – 26,7 %), отмечена выраженная бледность кожных покровов, язык малинового цвета без наложений. Резко снижен тургор кожи, живот увеличен в объеме. В анализе крови гемоглобин – 78 г/л, эритроциты – 2,05 × 1012, цветовой показатель – 1,14. В биохимическом анализе отмечено снижение уровня белка до 6,0 г/дл (норма – 6,4–8,4 г/дл). Сывороточное железо в норме. С учетом неправильного вскармливания ребенка, данных анамнеза, свидетельствовавших о вскармливании цельным козьим молоком, что может приводить к развитию фолиеводефицитной анемии Якш–Гайема, ребенку проведено определение содержания витаминов В12 и фолиевой кислоты в крови. Уровень витамина В12 оказался в пределах нормы, содержание фолиевой кислоты в эритроцитах снижено до 58 нг/л (норма – 100–450 нг/л). Таким образом, у ребенка диагностирована фолиеводефицитная анемия, что послужило закономерным следствием вскармливания ребенка цельным козьим молоком в отсутствие введения прикорма. В козьем молоке содержание фолиевой кислоты крайне низкое – 6 нг/г, в коровьем и женском молоке существенно выше – 50 нг/г [33]. Ребенку назначена смесь на основе гидролиза сывороточных белков Нутрилон пепти аллергия, перорально фолиевая кислота в дозе 5 мг 1 раз в день в течение месяца, витамин D3 Аквадетрим. На фоне проведенной терапии через месяц ребенок прибавил в массе 900 граммов, стал активным, самостоятельно ходить без поддержки, уменьшились беспокойство и капризность. В анализе крови гемоглобин 105 г/л, эритроциты – 3 × 1012. В биохимическом анализе крови уровень общего белка поднялся до 6,8 г/дл.
Лечение анемии у детей с патологией ЖКТ невозможно без терапии основного заболевания, вследствие которого она возникла. Тяжесть анемии коррелирует со степенью активности заболевания (особенно это ярко проявляется у больных ВЗК). При этом необходимо учитывать всевозможные механизмы развития анемии: кровопотерю, перераспределение железа, диетические особенности рациона питания, нарушение всасывания микронутриентов в кишечнике. Чаще всего у детей с патологией ЖКТ анемии носят сочетанный характер. Например, у пациентов с ВЗК вначале заболевания анемия может носить нормохромный постгеморрагический характер.
С течением времени возникает дефицит железа, далее развивается АХЗ. У больных болезнью Крона в сочетании с целиакией возможно развитие не только железодефицитных состояний, но и В12-дефицитной анемии, особенно после резекции кишечника [13, 35, 36].
Лечение основного заболевания должно включать устранение (уменьшение) активности воспаления, нормализацию моторики ЖКТ, процессов переваривания и всасывания в просвете кишки. В случаях тяжелых постгеморрагических анемий возможно применение гемотрансфузий. В данном случае в первую очередь необходимо купировать кровотечение и далее проводить коррекцию анемии. В связи со временным эффектом, высоким риском осложнений и возможности перегрузки железом применение их ограничено.
Лечение анемических состояний при заболеваниях ЖКТ должно включать назначение препаратов железа в связи с преимущественным железодефицитным характером анемии (табл. 7). При развитии ЖДА возместить дефицит железа без лекарственных железосодержащих препаратов невозможно [37]. Эффективность лечения препаратами железа зависит от тяжести анемии, выбранного препарата железа и способа его введения. При атрофии тонкой кишки назначение пероральных препаратов железа неэффективно, т.к. из-за нарушения процессов всасывания железо не переносится из просвета кишки в кровь. Максимальная адсорбционная способность кишечника по всасыванию железа в среднем составляет 1–2 мг в сутки, что явно недостаточно для эффективной коррекции анемии [3]. Пероральные препараты могут самостоятельно вызывать или усугублять воспалительные изменения слизистой кишечника, т.к. их избыток в просвете кишки способствует развитию свободно радикальных реакций вплоть до оксидативного стресса. Более чем 20 % больных прекращают прием препаратов железа из-за возникновения осложнений от их приема, не добившись коррекции ЖДА [38]. В наибольшей степени эти осложнения наблюдаются при применении двухвалентных солей железа (сульфат железа и др.). Гидроксид-полимальтозные соединения трехвалентного железа не вызывают подобных осложнений и с точки зрения безопасности могут применяться, однако эффективность их ограничена при воспалении стенки кишки.
Таким образом, часто пациентам с патологией ЖКТ целесообразно применение парентеральных форм железа в остром периоде заболевания, с дальнейшим переходом на пероральные формы. Большим преимуществом обладают внутривенные препараты железа — сахарат железа (Венофер), которые не зависят от всасывания, способны быстро и эффективно восполнять дефицит железа и его запасы (возрастание уровня трансферрина). Энтеральные препараты железа показаны больным гастроэнтерологической патологией для коррекции дефицита железа и лечения легкой и среднетяжелой ЖДА в отсутствие кровотечений в верхних отделах ЖКТ и выраженных нарушений кишечного всасывания [39, 40].
Назначение пероральных препаратов детям с гастроэнтерологической патологией требует соблюдения определенных условий:
- Препараты железа должны быть безопасными, не вызывать токсических и оксидативных реакций, в т.ч. и за счет неконтролируемого всасывания.
- Препараты железа не должны оказывать раздражающего действия на слизистые оболочки ЖКТ.
- Препараты железа должны обладать высокой биодоступностью и хорошо всасываться.
- На данный момент на рынке существует множество препаратов железа, как двухвалентного, так и трехвалентного.
Для применения препаратов железа в педиатрии только несколько соответствует всем предъявляемым требованиям. Оптимально применение гидроксид-полимальтозных соединений трехвалентного железа (Мальтофер), которые имеют разные формы выпуска, что позволяет легко дозировать препарат для детей разного возраста. Однако применение только препаратов железа к детям с хронической патологией ЖКТ будет эффективным лишь при преобладающем железодефицитном характере анемии [41]. В других случаях, особенно при длительном рецидивирующем течении ВЗК и развитием не столько дефицита железа, сколько АХЗ, не приводит к значимой и стойкой коррекции анемии, но и чревато перегрузкой железом с развитием гемосидероза [41].
Пошаговая терапия АХЗ при ВЗК:
Шаг 1. Лечение основного заболевания. Успех терапии будет зависеть от степени компенсации ВЗК [42].
Шаг 2. Лечение препаратами железа парентерально, т.к. в связи с неполным усвоением пероральные формы будут оказывать токсический эффект и усугублять изменения слизистой кишки [36, 43, 44].
Шаг 3. Наиболее эффективным и обоснованным патогенетически для коррекции АХЗ является назначение эритропоэтина, что компенсирует его недостаточную эндогенную продукцию и способствует повышению чувствительности клеток красного костного мозга к эритропоэтину. Однако нужно помнить, что назначение эритропоэтина неизбежно приводит к высокому потреблению железа эритроидными предшественниками и быстрому истощению его запасов в организме [42]. Результатом служит железодефицитный эритропоэз, что возвращает нас к шагу 2. Параллельно с эритропоэтином обязательно назначение внутривенных препаратов железа, которое тем более показано больным со смешанным генезом анемии. Применение эритропоэтина в сочетании с препаратами железа приводит к более быстрому достижению нормальных показателей гемоглобина [18, 36].
Дозировка на курс введения препарата железа рассчитывается по формуле Ganzoni [45, 46, 48]. Дефицит железа (в мг) = масса тела (в кг) × 0,24 × (долженствующий гемоглобин – фактический гемоглобин в г/л) + 500 мг.
Показания к назначению препаратов железа парентерально [48, 49]:
- тяжелое течение анемии;
- высокая активность ВЗК;
- одновременная терапия эритропоэтином;
- непереносимость пероральных форм железа;
- недостаточный эффект от применения пероральных форм железа;
- предпочтения пациента (редко).
В данном случае в первую очередь необходимо купировать кровотечение и далее проводить коррекцию анемии.
Пациентам со смешанным генезом анемии при синдроме мальабсорбции показано применение витамина В12 и фолиевой кислоты [47]. При адекватном лечении уже в течение первых 3 суток наблюдается увеличение числа ретикулоцитов в крови, на 7–10-й день отмечается ретикулоцитарный криз (пик ретикулоцитоза). К 3–4-й неделям лечения имеет место увеличение уровня гемоглобина на 20 г/л. Прием препаратов железа необходимо продолжать еще в течение 3–6 месяцев после нормализации уровня гемоглобина — пока насыщение трансферрина железом не превысит 30 % и концентрация ферритина не достигнет 50 нг/мл (показатель восстановления тканевых запасов железа) [48, 49].


