Введение
Интерес исследователей к глютен-ассоциированным заболеваниям растет год от года. Распространенность их увеличивается во всем мире, что, вероятно, связано с несколькими факторами: накоплением в популяции лиц с гаплотипом HLA DQ2/DQ8, увеличением потребления и селекцией сортов пшеницы, богатых глиадином, изменением технологии выпечки хлеба. Безусловно, определенный вклад имеет и улучшение диагностических возможностей медицинских работников и осведомленности пациентов. Опрос Gallup, проведенный в июле 2015 г., показал, что 20% американцев выбирают безглютеновую диету. Потребление безглютеновой пищи явно растет экспоненциально [1]. Тем не менее в Европе и США средняя частота целиакии среди населения в целом составляет примерно 1% [2]. Это может свидетельствовать о самодиагностике непереносимости глютена населением и может, вероятно, отражать распространенность чувствительности к глютену без целиакии (ЧГБЦ). Все это диктует необходимость разработки новых алгоритмов обследования пациентов для своевременного обнаружения и лечения глютен-ассоциированных заболеваний.
Злаковые являются самыми потребляемыми зернами во всем мире. Эти продукты богаты источниками глютена — основного питательного компонента для клеточного синтеза и осуществления большинства биохимических реакций. Он включает два основных компонента: проламины — белки, растворимые в 60-80%-ном растворе этанола, и глютенины — белки эндосперма, растворяющиеся только в слабых кислотах или щелочах [3]. Эти белки характеризуют аминокислотный состав зерновых, а именно высокое содержание аминокислотных последовательностей пролина и глутамина, определяющих токсичность глиадина
(в пшенице), секалина (во ржи), гордеина (в ячмене) и авенина (в овсе) для больных целиакией. Однако не все белки, относящиеся к глютенинам и проламинам, токсичны для организма человека. Проламины риса и кукурузы практически не содержат глутамина и пролина, но содержат больше лейцина и аланина - безопасных аминокислот для больных с непереносимостью глютена [4]. Компоненты глютена устойчивы к воздействию протеолитических ферментов желудочно-кишечного тракта, у некоторых людей могут проникать сквозь эпителиальный барьер, вызывая иммунную реакцию.
Термин «глютен-ассоциированные заболевания» включает три различных состояния: целиакию, аллергию на пшеницу и ЧГБЦ (рис. 1) [5, 6]. Наиболее изученная из них целиакия.
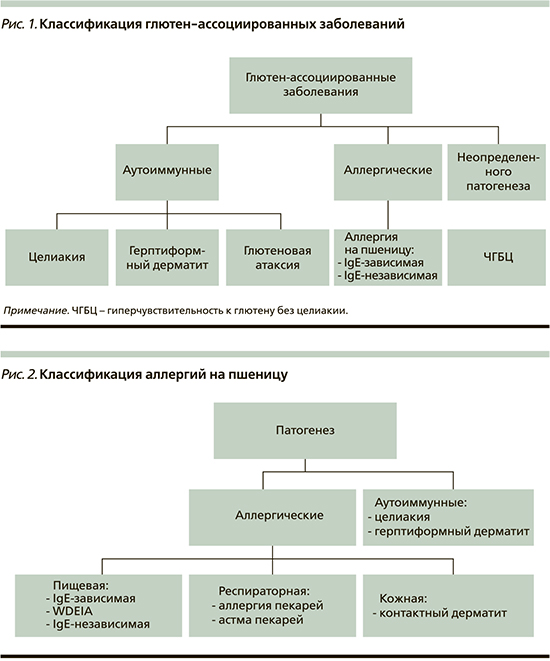
Целиакия
По определению Всемирной гастро-энтерологической организации и российских согласительных документов [7], целиакия представляет собой хроническую иммуноопосредованную энтеропатию, вызванную употреблением клейковины злаков генетически восприимчивыми лицами [8].
Распространенность целиакии коррелирует с частотой носительства гаплотипов двух молекул DQ2-DQ8 (HLADQ2 и HLA-DQ8) и высоким уровнем потребления глютена [9—15]. Также она характеризуется наличием специфических антител, таких как антитела к тканевой трансглутаминазе (tTG) IgA, антитела к эндомизию (EMA) IgA, антитела к дезаминированным пептидам глиадина (DPG) IgG. Согласно недавно проведенному метаанализу, распространенность целиакии, диагностированной на основании положительных результатов тестов на иммуноглобулины класса А к ферменту тканевой трансглутаминазы и/ или антитела к эндомизию, составляет 1,4% [16].
Клинические формы целиакии имеют широкий диапазон симптомов. Выделяют типичную, атипичную, скрытую и потенциальную формы. Типичная форма характеризуется наличием гастроинтестинальных симптомов, таких как рвота, диарея, вздутие живота, абдоминальная боль и потеря массы тела, возникающих в ответ на прием продуктов, содержащих глютен. Напротив, атипичная форма в основном характеризуется внекишечными проявлениями: повышенной утомляемостью, гипертрансаминаземией, анемией, герпетиформным дерматитом, множественными дефектами эмали, афтозным стоматитом, остеопорозом, необъяснимым бесплодием (у женщин), чувством онемения, нейропатией, идиопатическими судорогами, психиатрическими нарушениями. Скрытая форма целиакии описана у бессимптомных пациентов с положительными результатами серологических исследований и признаками воспаления тонкой кишки по данным биопсии. Потенциальная форма целиакии наблюдается у пациентов с положительными результатами серологических исследований в отсутствие клинических проявлений и явных признаков воспаления по результатам биопсии [17].
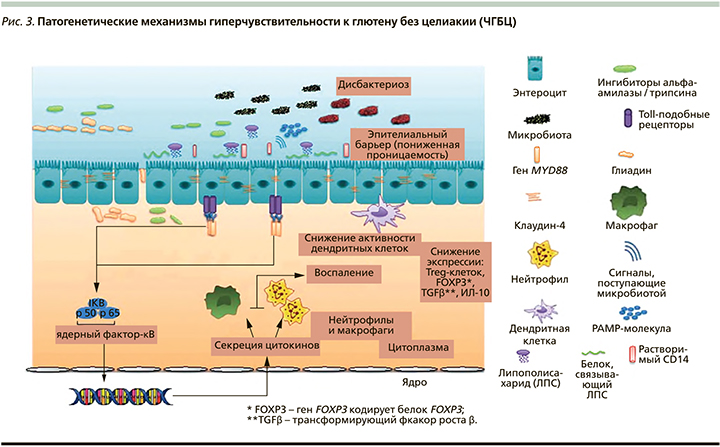
Аллергия на пшеницу
Аллергия на пшеницу в отличие от целиакии протекает по I и IV типам гиперчувствительности. В зависимости от пути поступления аллергена в организм выделяют пищевые, респираторные и кожные аллергии (рис. 2) [6].
Пищевая аллергия подразделяется на IgE-зависимую и IgE-независимую. Кроме того, выделяют пшенично-зависимую анафилаксию, вызванную физической нагрузкой (WDEIA), которая была выделена как самостоятельная форма в последней классификации EAACI (European Academy of Allergy and Clinical Immunology). WDEIA - редкий синдром. Он обычно диагностируется у взрослых или подростков. Клинически характеризуется анафилактическими реакциями (крапивница, отек Квинке, шок), возникающими через 10-60 минут после физической нагрузки, которой предшествовал прием пшеницы. Количество съеденной пшеницы и интенсивность упражнений не имеют значения. Омега-5-глиадин - основной аллерген при WDEIA: он обнаруживается у всех пациентов. Сывороточные концентрации глиадин-специфического IgE коррелируют с тяжестью клинического ответа при WDEIA [6].
Аллергия обычно диагностируется у детей. Клиническая картина зависит от возраста [6]. Симптомы развиваются в течение 1-2 часов после приема пшеницы. У маленьких детей преобладают гастроэнтерологические симптомы, такие как рвота, диарея или, реже, боли в животе. Примерно у 40% детей наблюдаются кожные симптомы в виде крапивницы, эритемы, ангионевротического отека, зуда или обострения атопического дерматита, интенсивность которых снижается с возрастом [18]. Дети старшего возраста страдают в основном дерматитом, который сопровождается респираторными расстройствами (хрипы, стридор, постоянный кашель, хриплый голос, дыхательная недостаточность, заложенность носа) и в наиболее тяжелых случаях — анафилаксией. У подростков и взрослых преобладают наиболее тяжелые формы аллергии, такие как симптомы анафилаксии (у 45-50%), что характерно для аллергии на пшеницу. Кишечные и кожные симптомы менее распространены в этих возрастных группах. Такая гиперчувствительность может сочетаться с аллергией на другие злаки: чаще всего на рожь и/или кукурузу.
В сыворотке крови больных IgE-опосредованной аллергией на пшеницу обнаружены многочисленные IgE-антитела, которые связываются с белками всех фракций зерна пшеницы, чаще всего с глиадинами. Список Всемирной организации здравоохранения включает 27 аллергенов пшеницы [19]. Клиническая значимость многих из них до сих пор не определена.
Чувствительность к глютену без целиакии
Во всем мире интерес к безглютеновой диете растет не только потому, что повышается уровень осведомленности населения, но и благодаря знаменитостям, использующим ее в качестве метода снижения веса или повышения своих спортивных результатов на соревнованиях. Многие люди решают исключить глютен из своего рациона, считая это принципом здорового питания, при этом не имея никаких клинических проявлений при нарушении диеты. Термин «чувствительность к глютену без целиакии» был введен для того, чтобы охватить всех пациентов, имеющих тягостные ощущения после употребления в пищу глютена, но не имеющих подтвержденного диагноза «целиакия». До сих пор остается неясным механизм развития этого состояния, а значит, и не разработан оптимальный алгоритм диагностики.
В настоящее время диагноз ЧГБЦ устанавливается путем исключения целиакии и аллергии на глютен, потому что специфический биомаркер пока не найден. Согласно критериям Солерно, принятых 06-07.10.2014 в Италии на Международном совещании по глютен-ассоциированным заболеваниям, в настоящее время диагностическим критерием ЧГБЦ можно считать улучшение самочувствия пациента при соблюдении безглютеновой диеты [5].
Интересно, что при ЧГБЦ антитела DPG IgG и генотип HLA-DQ2 и/или HLA-DQ8 встречаются у 50% пациентов [16]. Кроме того, некоторые исследователи предполагают, что причиной может быть не глютен, а другие компоненты. Ими могут быть ферментированные олигодимоно-сахариды (Fermentable Oligo-Di-Monosaccharides), полиолы FODMAP [20], ингибитор амилазы-трипсина (amylase-trypsin inhibitors - ATIs) [21], а также другие компоненты пшеницы, известные как агглютинин-углеводный связывающий белок и экзорфины, воздействующие на иммунную систему, вызывая повреждение эпителия кишечника, что может усугублять течение ЧГБЦ [22].
ATIs являются альбумином, содержащимся в пшенице, которые составляют до 4% от общего количества белков в зернах. Воздействуя на макрофаги и дендритные клетки через То11-подобные рецепторы-4, он стимулирует выработку цитокинов, включая интерлейкин-8 (ИЛ-8) и фактор некроза опухоли а (ФНО-а) [23].
FODMAP - короткоцепочечные сахара, содержащие в молекуле 10 атомов углерода. Ученые из Австралии провели тщательный анализ этой группы углеводов, которые, несмотря на свою различную структуру, вызывали одинаковые тягостные симптомы со стороны желудочно-кишечного тракта. К наиболее часто встречающимся из этого списка относятся фруктоолигосахариды (FOS), галактоолигосахариды (GOS), лактоза, фруктоза, полиолы, сорбит и маннитол [24]. Эти соединения не перевариваются и не абсорбируются в желудочно-кишечный тракте, вызывая брожение и вздутие. Однако в отношении этой диеты нельзя сделать однозначный вывод. Считается, что FODMAP положительно влияют на метаболизм липидов, понижая уровень сывороточного холестерина, триглицеридов и фосфолипидов [25]. FOS и GOS как и пребиотики способствуют нормальной колонизации кишечника бифидо- и лактобактериями, ограничивая пролиферацию Clostridium spp. и Escherichia coli [24]. Короткоцепочечные жирные кислоты как продукты ферментации FODMAP кроме метаболических обладают защитными свойствами против рака толстой кишки [26].
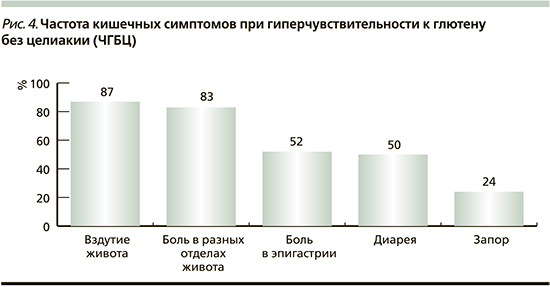
В свою очередь агглютинины зародышей пшеницы (WGA) связываются с гликопротеинами, такими как человеческая N-ацетилнейраминовая кислота, на поверхности клетки, индуцируют высвобождение провоспалительных цитокинов (ФНО-а, ИЛ-1в, -12 и ИФН-Y), нарушая целостность эпителиального слоя кишечника [27]. Есть исследователи, считающие, что WGA индуцирует высвобождение провоспалительных цитокинов (ФНО-а, ИЛ-1в, -12 и ИФН-Y) и увеличивает проницаемость эпителиального барьера (рис. 3).
Вероятнее всего, пусковым механизмом патогенеза ЧГБЦ служит воздействие на кишечный эпителий продуктов, содержащих глютен, что приводит к иммуно- и/или неиммуноопосредованным реакциям. В то время как при целиакии имеет место быть повышенная проницаемость кишечника вследствие разрушения кишечного эпителия, при ЧГБЦ наблюдается повышенная проницаемость эпителиального барьера, что находит отражение в повышенной экспрессии плотного соединительного компонента клаудина-4 в ряде исследований. В свою очередь известны предположения, согласно которым глиадиновые пептиды, связанные с провоспалительным цитокиновым CXCR3-рецептором, способствуют выделению зонулина, тем самым нарушая связь между клетками и увеличивая проницаемость эпителия [28]. Изменения в микробиоте кишечника (дисбактериоз), вызванные потреблением глютена, тоже могут влиять на течение заболевания. R. Chibbar et al. в своем обзоре осветили влияние микробиоты на течение глютен-ассоциированных заболеваний. В тонком кишечнике P. aeruginosa имеет свойство частично сбраживать глютен, тем самым повышая его иммуногенность. Напротив, Lactobacillus снижает иммуногенность пептидов, вырабатываемых P. aeruginosa. Также известно, что патогенные бактерии активируют врожденную иммунную систему через активацию TLR [29, 30]. В целом на сегодняшний день патогенез ЧГБЦ представляется как преимущественно врожденный системный ответ, основанный на TLR, потенциально индуцируемый изменениями в микробиоте. Описанные патофизиологические нарушения и дисбактериоз вызывают местное, кишечное и системное воспаление и дисфункцию кишечномозговой оси. Это находит отражение в клинике данного заболевания [31].
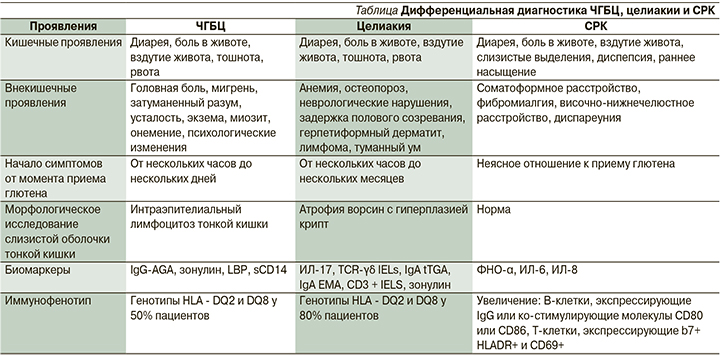
Так, к клиническим проявлениям при ЧГБЦ относятся вздутие живота и боль в верхней или нижней части живота, диарея и/или запор, тошнота, афтозный стоматит, провоцируемые употреблением в пищу продуктов, содержащих глютен (рис. 4). Кроме того, существуют и внекишечные симптомы, такие как foggy mind, который описывается как неспособность концентрироваться, уменьшение мнемонических возможностей и общая слабость, а также усталость, головная боль, беспокойство, онемение, суставная/мышечная боль и кожная сыпь/ дерматит (рис. 5) [32]. Такие симптомы часто встречаются и при других заболеваниях желудочно-кишечного тракта. Один из них - синдром раздраженного кишечника (СРК). Дифференциальная диагностика между этими двумя состояниями - настоящий «вызов» для врача-клинициста.

В отсутствие специфического биомаркера ЧГБЦ является диагнозом исключения. «Золотым» стандартом диагностики, согласно критериям Солерно, является использование алгоритма с постепенным введением глютенсодержащих продуктов, в которых содержится 8 г глютена [33]. Однако кишечные и внекишечные симптомы могут сохраняться примерно у 70% пациентов после 1 года безглютеновой диеты [34]. По данным Molina-Infante и Carroccio, проанализировавшим 10 рандомизированных клинических испытаний, исследовавших данную методику, только 16% пациентов имели глютенспецифические симптомы и у 40% из них была плацебореакция в ответ на возвращение глютенсодержащих продуктов в рацион [35]. Все вышеизложенное свидетельствует о необходимости разработки более точной методики диагностики.
Таким образом, ЧГБЦ - это малоизученный синдром, включающий различные кишечные и внекишечные проявления, обычно возникающие вскоре после приема глютенсодержащих продуктов и быстро исчезающих после их отмены, возникающий у лиц, у которых были исключены как целиакия, так и аллергия на пшеницу. Симптомы, характерные для СРК, обычно являются частью клинической картины (см. таблицу). Некоторые авторы считают, что именно ЧГБЦ ответственна за треть случаев СРК у взрослых [35].
Лечение глютен-ассоциированных заболеваний
На сегодняшний день единственным методом лечения пациентов с глютен-ассоциированными заболеваниями является соблюдение безглютеновой диеты. Но некоторые исследования демонстрируют, что при ее соблюдении пациентам часто не хватает цельного зерна и клетчатки, микроэлементов (например, витамина D, витамина B12 и фолата) и минералов (например, железа, цинка, магния и кальция) [36]. Кроме того, безглютеновые продукты могут включать сахара и насыщенных жиров больше, чем их глютенсодержащие аналоги, что может способствовать набору веса [37].
Таким образом, в настоящее время продолжается поиск оптимальной терапии целиакии и ЧГБЦ. В качестве возможной мишени рассматриваются эндопептидазы, в частности латиглютеназа (ALV003), способная переваривать глютен в просвете кишечника, что, однако, не сопровождается улучшением гистологической картины по данным исследований [38]. Было продемонстрировано, что некоторые пробиотические штаммы могут снижать иммуногенность глютена, способствовать заживлению слизистой оболочки и облегчать симптомы пациента [39], применение которых ограниченно в связи с возможным содержанием глютена при изготовлении данных препаратов. Для изменения иммуногенного потенциала глютеновых пептидов исследуют различные методы, которые приводят к его снижению с помощью микроволн, Y—излучения, гидролиза с лактобациллами и грибковыми протеазами либо альтераций генетического секвенирования. Исследования показывают, что монтелукаст, антагонист лейкотриеновых рецепторов, используемый для лечения бронхиальной астмы, может подавлять продукцию интраэпителиальными лимфоцитами медиаторов воспаления и, возможно, ускорять заживление слизистой оболочки [40]. Одним из перспективных препаратов является ZED1227.
M.D. Detlef Schuppan в своем исследовании описывает селективный ингибитор трансглутаминазы-2. В исследование был включен 41 пациент с хорошо контролируемой целиакией. Лечение препаратом ZED1227 ослабляло вызванное глютеном повреждение слизистой оболочки двенадцатиперстной кишки, что было доказано гистологически. Тем не менее добиться полной гистологической ремиссии пока не удалось. К наиболее распространенным нежелательным явлениям отнесены головная боль, тошнота, диарея, рвота и боль в животе [41].
Имеются предположения, согласно котороым иммуномодуляция может восстанавливать устойчивость к глютену. TIMP-GLIA-терапевтическое средство, основу которого составляют наночастицы. Оно разработано для изменения чувствительности к глютену и стимулирует иммунную толерантность, доставляя инкапсулированный глиадин к толерогенным иммунным клеткам. Продолжаются исследования фазы I [42]. Также было продемонстрировано, что ИЛ-15 является ключевым компонентом выживаемости внутриэпителиальных лимфоцитов и повреждений слизистой оболочки. Препараты, действие которых направлено на блокирование этого цитокина, находятся в процессе разработки для резистентной к диетотерапии целиакии. Но пока испытание фазы Ila ингибитора ИЛ-15, AMG 714, у пациентов с рефрактерной целиакией не показало изменений доли аберрантных внутриэпителиальных лимфоцитов в группе лечения по сравнению с группой плацебо [43].
Заключение
Рост осведомленности о глютен-ассоциированных заболеваниях и интереса населения к ведению здорового образа жизни посредством безглютеновой диеты привлекает все большее внимание специалистов по всему миру. Дифференциальная диагностика ЧГБЦ и СРК в настоящее время остается сложным и малоизученным вопросом. До сих пор не найден доступный и точный биомаркер для исключения ЧГБЦ.
Ведется активный поиск молекул-мишеней для терапии глютен-ассоциированных заболеваний. Все это диктует необходимость дальнейшего изучения данной проблемы для возможной консолидации знаний и разработки диагностических алгоритмов.



