Введение
Рак шейки матки (РШМ) – четвертая по распространенности злокачественной опухолью (6,5%) среди женщин в мире. Несмотря на достижения в области профилактики, скрининга, диагностики и лечения при РШМ, данное заболевание остается одной из важных проблем здравоохранения [1–3]. По данным GLOBOCAN-2020, заболеваемость РШМ составляет 3,1% (604 127 новых случаев) в мире, смертность – 3,4% (341 831 случай). В структуре заболеваемости злокачественными новообразованиями в России за последние 10 лет отмечается тенденция к увеличению заболеваемости РШМ (111,6 на 100 тыс. населения в 2009 г., 126,8 – в 2019-м) [4].
В России ранний РШМ выявляют у 15,8% первичных больных, местнораспространенные и метастатические формы РШМ – в 39,5% наблюдений.
В соответствии с рекомендациями ESMO стандартом лечения РШМ стадий IIB–IVA по FIGO является химиолучевая терапия (ХЛТ), улучшающая 5-летнюю выживаемость на 6% (с 60 до 66%). Несмотря на существующий стандарт ХЛТ местнораспространенного РШМ, в литературе встречается достаточно большое число публикаций, посвященных вопросам комбинированного лечения данной патологии [5]. В исследовании китайских авторов 800 пациенток были распределены на 2 группы: получивших неоадъювантную химио-терапию (НАХТ) с последующим хирургическим лечением и получивших только хирургическое лечение. Безрецидивная (БРВ) и общая выживаемость (ОВ) за 5 лет составила 80,30 и 81,00% против 81,10 и 78,50% соответственно (p>0,05). Следует отметить, что в группе НАХТ количество послеоперационных осложнений было в 2 раза меньше (7,30 против 13,62%, p=0,002), снижались интраоперационная кровопотеря и длительность операции [6]. Преимущества НАХТ с последующим хирургическим лечением по сравнению только с хирургическим лечением были продемонстрированы в мета-анализе 6 исследований III фазы (FIGO stage of the subjects: Sardi’s trial [7], РШМ IB1- и IB2-стадий; Napolitano’s trial [8], РШМ IB–IIIB стадий; Cai’s trial [9], РШМ IB1- и IB2-стадий; Katsumata’s trial [10], РШМ IB2-, IIA2-, IIB-стадий; Eddy’s trial [11], РШМ IB2–IIB-ст, в которые вошли 1036 пациенток [12]. Анализ показал, что БРВ улучшалась при проведении неоадъювантного лечения (отношение рисков [HR]=1/40,76; 95% доверительный интервал [ДИ]: 0,62–0,94; p=0,01), а различия в ОВ оказались несущественными (HR=1/40, 85; 95% ДИ: 0,67–1,07; p=0,17) [10, 13]. H. Sun et al. сравнили ОВ и БРВ у 21 пациентки с РШМ IIВ-стадии. Больные были разделены на две группы: НАХТ+хирургическое лечение и только хирургическое лечение. После 2 лет наблюдения ОВ и БРВ в 1-й группе были существенно выше: 100 и 90,9% против 90 и 80% [14]. F. Landoni et al. проанализировали 333 случая лечения РШМ IIА-, IIB-стадий. В 1-й группе пациентки получали НАХТ с последующим хирургическим лечением, во 2-й – ХЛТ. БРВ оказалась выше в 1-й группе (p=0,0001) и у пациенток, получавших НАХТ (p=0,0001) [15]. Таким образом, пациентки с оптимальным ответом после НАХТ и хирургического лечения РШМ II стадии по FIGO не нуждаются в дальнейшем лечении. Дополнительные циклы химиотерапии могут быть полезными для пациенток с субоптимальным ответом и остаточным внутришейным поражением шейки матки. Кроме того, G. Ferrandina et al. в своем клиническом исследовании подтвердили безо-пасность и эффективность ХЛТ как 1-го этапа в мультимодальном подходе к лечению местнораспространенного РШМ. В исследование была включена 161 больная, полный/частичный ответ наблюдался у 153 пациенток, радикальное хирургическое лечение выполнено в 152 случаях. При гистологическом исследовании у 111 (73%) из 152 пациенток отмечено отсутствие микроскопической остаточной опухоли. Пятилетняя БРВ составила 83%, а 5-летняя ОВ – 90% [16]. Наряду с этим лучевая терапия, являясь апробированным и высокоэффективным методом лечения РШМ на ранних стадиях, имеет резко ограниченные возможности при осложненном течении местнораспространенных форм РШМ в виде распада и кровотечения [17].
Как можно увидеть из представленного краткого обзора основных публикаций, посвященных вопросам комбинированного лечения РШМ, вопрос о целесообразности сочетания различных методов лечения данной категории пациенток остается дискутабельным.
Разработанные нами методологические подходы хирургического лечения РШМ как компонента комбинированного лечения обеспечивают высокую степень радикализма и являются одним из возможных вариантов увеличения показателей выживаемости пациенток.
Цель исследования: увеличение показателей выживаемости путем повышения степени радикальности хирургического лечения больных IIA–IIIВ-стадий РШМ.
Методы
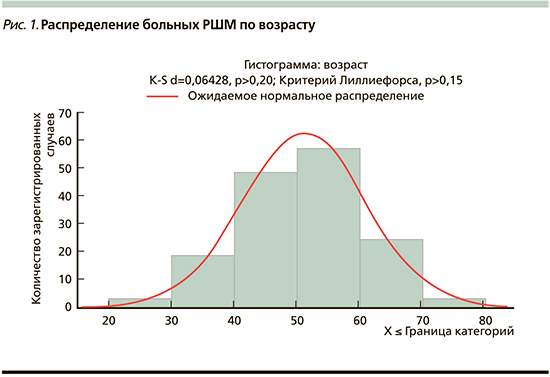
В исследование включены 155 больных РШМ IIA–IIIВ-стадий, проходивших лечение в Ташкентском городском филиале Республиканского специализированного научно-практического медицинского центра онкологии и радиологии (ТГФ РСНПМЦОиР) с 2017 по 2020 г. Пациентки давали информированное согласие на участие в исследовании. В исследование вошли пациентки в возрасте от 26 до 73 лет (средний возраст – 51,3±9,9 года, медиана – 51 год). 71 (45,8%) пациентка находилась в возрасте до 50 и 84 (54,2%), старше 50 лет (рис. 1).
Сопутствующая патология в виде ишемической болезни сердца (ИБС) выявлена у 22 (14,2%) больных с достоверным преобладанием у пациенток старшей возрастной группы – 16 (19,1%) против 6 (8,5%) пациенток до 50 лет (р=0,048). Сахарным диабетом страдали 11 (7,1%) пациенток, ожирением –16 (10,3%) без существенного различия между возрастными группами (см. таблицу).
Cтадирование РШМ осуществляли на основании принятых классификаций (FIGO – классификации Международной федерации гинекологов и акушеров 2018 г., TNM [12–14]). Всем больным проведено комплексное обследование: оценка жалоб, сбор анамнеза, гинекологический осмотр, морфологическое и ультразвуковое исследование (УЗИ), цистоскопия, ректоскопия, магнитно-резонансная томография (МРТ) брюшной полости и малого таза, компьютерная томография (КТ) органов грудной клетки.
Больные были разделены на две группы. В 1-й группе (n=110) больным на 1-м этапе проведено 2–3 курса химиотерапии с внутривенной инфузией цитостатиков (паклитаксел в дозе 175 мг/м2 внутривенно капельно на фоне стандартной премедикации; карбоплатин (AUC6) внутривенно капельно каждый 21 день. При достижении эффекта больным выполняли хирургическое лечение. Во 2-й группе (n=45) у больных на фоне проведения ПХТ по аналогичной схеме выявлено прогрессирование заболевания, в связи с чем назначили ХЛТ (дистанционная лучевая терапия на линейном ускорителе электронов ЛУЭВ-15М1 до суммарной очаговой дозы 14–50 Гр [в среднем 45,2±5,2 Гр] на точку А с радиомодификацией цисплатином 1 раз в неделю в дозе 40 мг/м2) с последующим хирургическим лечением. Возраст пациенток двух групп статистически не различался (51,9±10,3 и 49,9±8,9 года соответственно, р=0,262). У большинства больных (139 [89,7%]) гистологическая форма РШМ соответствовала плоскоклеточному неороговевающему раку (99 [90%] и 40 [88,9%] соответственно), у 16 (10,3 %) пациенток – аденокарциноме. РШМ был преимущественно представлен умеренно дифференцированным типом в 70 (45,1%) случаях (48 [43,6%] и 22 [48,9%] соответственно). В 1-й группе в 2 раза преобладали высокодифференциированные опухоли (G1), составив 29 (26,4%) и 6 (13,3%) в обеих группах, с тенденцией к достоверности (р=0,057). РШМ IIА-стадии был диагностирован у 35 (22,5%) больных (20 [12,9%] и 15 [9,6%]), IIB – у 102 (65,8%) (78 [50,3%] и 24 [15,5%]), IIIА – у 16 (10,3%) (12 [7,7%] и 4 [2,6%]), IIIВ у 2 (1,3%) больных 2-й группы, т.е. преобладали стадии IIВ и IIIА. Оценку эффекта осуществляли по окончании 2–3 курсов ПХТ. Основным критерием ответа опухоли на лекарственную терапию считали изменение объема новообразования шейки матки, определенного по данным клинического обследования, УЗИ и МРТ. Использовали критерии эффективности химиотерапии системы RECIST1.1 (Response Evaluation Criteria In Solid Tumors) (Eisenhauer E.A. et al., 2009).
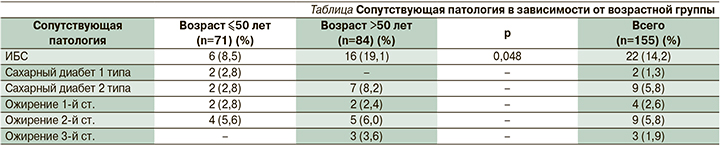
Критерием резектабельности считали достижение регресса опухоли более 60%, отсутствие инфильтрации в параметрии и уменьшение парааортальных лимфатических узлов до 1 см. Далее пациентки обеих групп были прооперированы в объеме расширенной экстирпации матки с придатками по запатентованному нами методу. Ниже приводятся основные этапы хирургического лечения: При рассечении брюшины под круглой связкой матки выполняется ее мобилизация на всем протяжении. Далее выполняется иссечение клетчатки с лимфатическими узлами и сосудами по ходу круглой связки матки, где нижней границей диссекции является нижняя надчревная артерия. Круглая связка матки пересекается и лигируется. Острым путем рассекается поддерживающая связка яичника и широкая связка матки для доступа к забрюшинному пространству. Выполняется поэтапная диссекция клетчатки с лимфатическими узлами и лимфатическими сосудами с наружной и внутренней поверхности подвздошных артерий и вен (рис. 2). Воронкотазовая связка яичника мобилизуется на всем протяжении, пересекается и лигируется. Далее приступают к диссекции поясничной, парааортальной клетчатки с лимфатическими узлами и лимфатическими сосудами (рис. 3). При этом обнажаются левая подвздошная артерия, нижняя брыжеечная артерия, левый мочеточник, большая поясничная мышца, левая почечная вена. Острым путем выполняется лимфодиссекция клетчатки с лимфатическими узлами и лимфатическими сосудами по ходу внутренней подвздошной артерии и вены. Выполняется диссекция в области запирательной ямки, латерально-крестцовой, околошеечной, паравагинальной, верхней и нижней ягодичной клетчатки с лимфатическими узлами и лимфатическими сосудами (рис. 4).
Кардинальная связка непосредственно у стенок таза коагулируется и пересекается. Маточная артерия у места отхождения от внутренней подвздошной артерии пересекается и лигируется. Выполняется дальнейшая мобилизация мочеточника до места впадения в мочевой пузырь с одновременным иссечением окружающей клетчатки. Острым путем рассекается брюшина по пузырно-маточной складке, и выполняется отсепаровка мочевого пузыря до нижней трети влагалища. Далее матку отводят к лону, рассекается задний листок широкой маточной связки, острым путем отсепаровывается передняя стенка прямой кишки. При этом хорошо визуализируется параректальное пространство, которое с латеральных сторон ограничено крестцово-маточными связками. Затем выполняется аналогичный объем диссекции справа. Отличительной особенностью справа является диссекция поясничной и паракавальной клетчатки с лимфатическими узлами и лимфатическими сосудами, покрывающей общую подвздошную и нижнюю полую вены. По завершении этапа диссекции справа и слева накладываются швы на боковые стенки нижней трети влагалища для окончательного гемостаза из ветвей влагалищной артерии. Выполняется экстирпация матки с придатками на границе средней и нижней третей влагалища. Перитонизация культи влагалища осуществляется с использованием заднего листка широкой маточной связки и брюшины мочевого пузыря. Средняя продолжительность операции и госпитализации составила 168±30 минут и 10±5 дней.
Эффективность предоперационного лечения оценивали по степени лечебного патоморфоза в операционном материале. Послеоперационная химиотерапия проведена 90 (58,1%) из 155 больных РШМ – 61 больной 1-й группы (39,4%) в рамках периоперационной химиотерапии (3–4 курса по прежней схеме. Общее число курсов – 6) и 29 больным 2-й группы (18,7%; 6 курсов адъювантной химиотерапии). Показатели выживаемости пациентов оценивали по методу Kaplan–Meier, различия выживаемости в группах определяли с помощью log-rank теста. Без признаков прогрессирования выживаемостью считали период от начала лечения до регистрации прогрессирования заболевания. Показатели выживаемости рассчитывали от начала лечения до момента завершения исследования или смерти для ОВ, а также прогрессирования заболевания для ВБП.
Результаты
Время наблюдения за пациентками составило в среднем 27,4±10,1 года (от 3,6 до 51,1 месяца, медиана – 28,7 месяца). Прогрессирование заболевания наступило у 16 больных (10,3%), составив 6 (5,5%) больных в 1-й группе и 10 (22,2) во 2-й (р=0,004) соответственно. Среди наиболее частых послеоперационных осложнений у пациенток наблюдались осложнения со стороны мочевыделительной системы, лимфатические кисты и свищи.
Нарушения мочеиспускания наблюдались у 78 (50,3%) и 31 (20%) больных 1-й и 2-й групп соответственно. Лимфокисты встречались у 20 (18,2%) больных 1-й группы и у 10 (22,2%) 2-й. Пузырно-влагалищный свищ зарегистрирован у 7 больных: в 1-й группе – у 5 (4,6%); во 2-й – у 2 (4,4%). Лимфорея наблюдалась у 2 больных (по одной в каждой из групп). Длительность лимфореи в среднем составила 23,1±4,9 дня и продолжалась от 5 до 35 дней (в 1-й группе 22,8±5,2, во 2-й – 23,5±4,2, р=0,432). Во 2-й группе встречались специфические осложнения после ХЛТ, такие как цистит (15 [33,3%]) и ректит (8 [17,8%]) больных соответственно.
Указанные осложнения купировались и не влияли на последовательность этапов лечения и сроки госпитализации. После неоадъювантного лечения при оценке степени лечебного патоморфоза в удаленном гистопрепарате наиболее чаcто отмечены III и IV степени лечебного патоморфоза. У 44 (40%) и 17 (37,8%) пациенток 1-й и 2-й групп зарегистрирована III степень лечебного патоморфоза; у 36 (32,7%) и 21 (46,6%) больных – IV степень. Эффективность различных вариантов лечения IIA–IIIB-стадий РШМ была оценена на основании показателей ОВ, ВБП.
За время наблюдения умерли 30 (19,4%) больных РШМ. Причем треть из них (10 [33,3%]) умерли от осложнений хирургического этапа лечения, т.е. 7 (41,2%) и 3 (23,1%) больных обеих групп соответственно. Осложнения, приведшие к летальному исходу: ТЭЛА у 2 (1,8%) и 1 (2,2%), некроз мочевого пузыря у 1 (0,9%) больной 1-й группы, кишечный свищ у 1 (2,2%) больной 2-й группы, перфорация прямой кишки, перитонит у 1 (2,2%) больной 1-й группы, тромбоз нижних конечностей у 1 (0,9%) больной 2-й группы, сепсис у 3 (2,7%) пациенток 1-й группы.
На рис. 5 и 6 приведены ОВ и ВБП больных IIA–IIIВ-стадий РШМ.
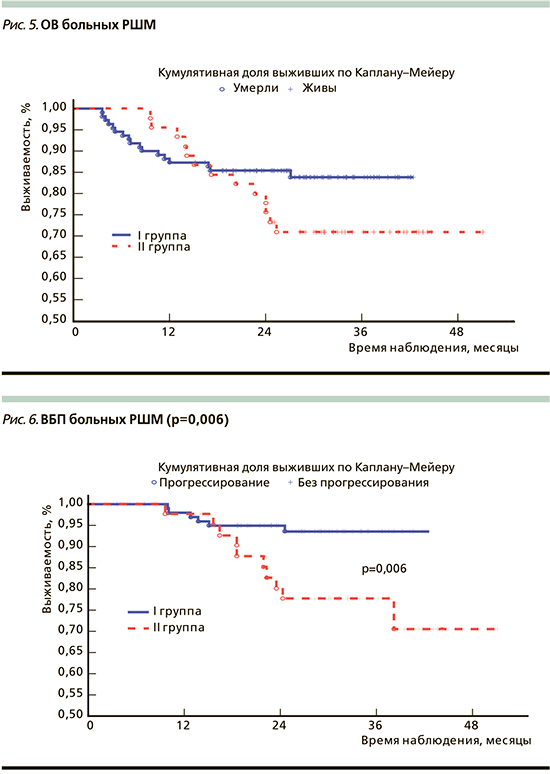
3-летняя ОВ больных РШМ была хуже во 2-й группе по сравнению с 1-й группой, составив 83,80±3,7 и 71,0±6,8%, однако различия не достигли статистической значимости (р=0,131).
Трехлетняя ВБП была достоверно ниже у больных IIA–IIIВ-стадий РШМ, получавших ХЛТ с последующим хирургическим лечением, составив 77,7%±6,6% по сравнению с пациентками после НАХТ и хирургического лечения, у которых ВБП составляла 93,5±2,6% (р=0,006).
Обсуждение
Еще одним аргументом в пользу проведения НАХТ больным РШМ является исследование Д.Л. Оводенко и соавт. с включением 173 пациенток с плоскоклеточным РШМ стадий IB2, IIB и IIIB. Радикальные операции после НАХТ были выполнены 160 (92,5%) пациенткам. У 55 (34,4%) больных адъювантая лучевая терапия не проводилась в связи с отсутствием факторов высокого и среднего рисков при патоморфологическом исследовании. Это позволяет сохранять возможность ее применения при рецидиве заболевания. Показатель 5-летней безрецидивной выживаемости составил 79,6% [18]. Пилотное исследование по оценке осложнений у больных РШМ после операции Вертгейм–Мейигса опубликовано в 1994 г. Операцией Вертгейма–Мейигса называется радикальная гистеректомия, сопровождающаяся выделением мочеточников латерально на всем протяжении от воронко-тазовой связки до мочевого пузыря, мобилизацией кардинальных связок у стенок таза, удалением большей части околоматочной клетчатки и верхней трети влагалища, удалением внутренних и наружных подвздошных лимфатических узлов. Показанием к выполнению данной операции является инвазивная карцинома шейки матки IB-, IIA-стадий. В исследовании P. Jesus et al., включившем 168 женщин после операции Вертгейма–Мейигса, у 19 (11,3%) были обнаружены метастазы в тазовые лимфатические узлы, у 149 лимфатические узлы были интактными. Частота рецидивов составила 21% в «положительных» лимфатических узлах и 6% у пациенток с «отрицательными» лимфатическими узлами. Осложнения возникли у 35 пациенток (20,83%) и составили: атония мочевого пузыря у 9,52%; свищи у 5,59%; недержание мочи у 4,76%; стеноз мочеточника у 2,97%; расхождение у 2,38% и лимфедема у 1,19% больных. Интраоперационные осложнения возникли в 4,76% случаев и включали повреждения мочевого пузыря, мочеточника и магистральных сосудов [19]. В работе С. Frutuoso et al. 58 больным была выполнена операция Вертгейма–Мейигса, причем тазовая лимфаденэктомия была выполнена 70% пациенток, парааортальные узлы были иссечены у остальных 30%. Среднее количество иссеченных лимфатических узлов составило 17±9. Инвазия тазовых узлов была обнаружена в 9% парааортальных лимфоузлах [20].
В нашем исследовании всем 155 больным выполнялась диссекция тазовых и парааортальных лимфатических узлов, причем пораженные парааортальные лимфатические узлы имели место у 47 (30%) больных, составив 17 (11%) и 30 (19%) больных в обеих группах. Пораженные тазовые лимфатические узлы были у 62 (40%) больных, составив 25 (16%) и 37 (24%) в обеих группах. Количество исследованных лимфатических узлов составило от 42 до 68.
Основной задачей разработанного нами метода хирургического лечения является тотальное иссечение тазовой клетчатки, парааортальной клетчатки с лимфатическими узлами и лимфатическими сосудами у всех больных с IIA–IIIB-стадиями РШМ. Таким образом, данная методика позволила выполнить радикальную онкологическую операцию с точки зрения онкохирургии и расширила показания к ее проведению. Данный способ комбинированного лечения местнораспространенных форм РШМ за номером FAP01612 зарегистрирован в государственном реестре полезных моделей Республики Узбекистан от 24.04.2021.
Заключение
Краткий анализ работ, посвященных комбинированному лечению больных РШМ IIA–IIIB-стадий, и собственные клинические наблюдения позволяют сделать вывод о его эффективности и безопасности. Предложенная нами методика хирургического лечения позволяет радикально оперировать больных РШМ даже при местнораспространенных формах, тогда как классическая операция Вертгейма–Мейигса применяется при ранних стадиях.



