Введение
Рак предстательной железы (РПЖ) занимает 2-е место по числу выявленных злокачественных опухолей у мужчин. В 2020 г. доля РПЖ от общего числа выявленных онкологических заболеваний составила 7,3%, т.е. это четвертый показатель после рака молочной железы (11,7%), рака легкого (11,4%) и колоректального рака (10,0%). Среди мужчин доля РПЖ от общего числа выявленных онкологических заболеваний составила 14,1%, уступив только раку легкого (14,3%) [1]. В большинстве случаев пациентам с местнораспространенными формами РПЖ удается достичь локального контроля. У пациентов с рецидивом после проведенного радикального лечения (операция, лучевая терапия), а также с впервые выявленным метастатическим заболеванием, к целям лечения относятся увеличение выживаемости и сохранение качества жизни [2].
Особого внимания заслуживает кастрационно-резистентный рак предстательной железы (КРРПЖ) – форма заболевания, критериями определения которой являются уровень тестостерона <50 нг/дл в сочетании с биохимическим (3 последовательных повышения уровня ПСА с разницей в 1 неделю с увеличением на 50% в двух измерениях от надира при уровне ПСА >2,0 нг/мл) или рентгенологическим прогрессированием (появление новых очагов: два и более новых очагов в костной ткани или очага в мягких тканях согласно критериям RECIST). Метастатический КРРПЖ в 90% случаев характеризуется появлением костных метастазов. Развитие костных метастазов нередко ассоциировано с выраженным болевым синдромом, патологическими переломами, что ухудшает качество жизни пациентов, может быть причиной инвалидизации пациентов и приводит к снижению общей выживаемости (ОВ). На сегодня существует несколько терапевтических опций в лечении пациентов с мКРРПЖ: химиотерапия (ХТ), ингибиторы андрогенного сигнала (ИАС), системная альфа-радиотерапия, а также PARP (поли-[АДФ рибоза] полимераз), ингибиторы для пациентов с выявленными мутациями BRCA1/BRCA2. Было проведено несколько исследований, доказывающих, что существует минимальное преимущество выживаемости пациентов, которые продолжают применение агонистов лютеинизирующего гормона рилизинг-гормона (аЛГРГ) после наступления кастрации [4, 5]. Для применения в качестве первой линии терапии пациентов с мКРРПЖ в Российской Федерации, согласно рекомендациям Ассоциации онкологов России по лечению РПЖ, применяются абиратерон ацетат в сочетании с преднизолоном, энзалутамид, доцетаксел. Радий-223 [Ra223] является одним из препаратов выбора во второй линии терапии наряду с кабазитакселом, а также допустимой опцией лечения в третьей линии терапии (после прогрессирования на доцетакселе и ИАС) [6].
Радия хлорид [Ra223] – альфа-эмиттер, по строению схожий с кальцием, что позволяет ему образовывать комплексное соединение с минералом костной ткани гидроксиапатитом. Благодаря данному соединению радий-223 [Ra223] избирательно воздействует на костную ткань, в особенности на костные метастазы РПЖ, характеризующиеся зонами активной ремодуляции костной ткани. Данный радиофармпрепарат обладает высоким значением энергии переноса ɑ-частиц (80 кэВ/мкм), вызывающим высокую частоту разрыва двухцепочечной молекулы ДНК, что приводит к сильному цитотоксическому эффекту на поврежденные клетки, при этом за счет короткой длины пробега ɑ-частиц здоровые клетки остаются неповрежденными. Результатом терапии является высоколокализованный противоопухолевый эффект на костные метастазы предстательной железы.
Системная альфа-радиотерапия при РПЖ применяется в мире с 2013 г. Радий-223 был зарегистрирован на основании результатов международного проспективного рандомизированного двойного слепого исследования III фазы ALSYMPCA, включившего 921 больного мКРРПЖ с 2 симптомными метастазами в кости и более без висцеральных метастазов. Пациентов рандомизировали в соотношении 2:1 на терапию радием-223 в сочетании с наилучшей поддерживающей терапией (НПТ; 50 кБк/кг, 1 раз в 4 недели, 6 инъекций) или плацебо с НПТ. По сравнению с плацебо радий-223 достоверно увеличивал ОВ (медиана ОВ=4,9 и 11,3 месяца соответственно), снижал риск смерти на 30% (отношение рисков=0,70; 95% доверительный интервал – 0,58–0,83), значимо снижал риск скелетных осложнений и достоверно увеличивал время до первого скелетного осложнения [7]. Преимущество ОВ было достоверно выше у пациентов, получивших 5 и более инъекций радия-223, по сравнению с больными, которым было выполнено менее 5 введений препарата (17,9 и 6,2 месяца соответственно; р<0,0001). Позитивная находка исследования ALSYMPCA в следующем: терапия радием-223 не лишает возможности последующей терапии доцетакселом, не увеличивая частоты гематологических осложнений [8].
В Российской Федерации радий-223 применяется в отношении пациентов с мКРРПЖ с 2016 г. во второй и последующих линиях терапии. Однако в рекомендациях NCCN препарат разрешен к применению и в первую линию пациентами с мКРРПЖ с изолированным поражением костей скелета.
Несмотря на отсутствие данных об оптимальной последовательности назначения препаратов в терапии пациентов с мКРРПЖ, существует несколько аргументов в пользу раннего назначения альфа-радиотерапии при развитии кастрационно-резистентной фазы заболевания с использованием терапевтического окна до появления висцеральных метастазов, риск развития которых увеличивается по мере прогрессирования опухолевого процесса [9]. Раннее назначение радия-223 не лимитирует возможности дальнейшего использования ХТ. После завершения терапии в рамках исследования ALSYMPCA 23% пациентов группы радиотерапии и 2% больных группы плацебо получали доцетаксел. Достоверных различий частоты и степени тяжести гематологической токсичности в процессе ХТ между группами зарегистрировано не было [10]. Радий-223 может быть приемлемой альтернативой второй линии лекарственной терапии (ИАС нового поколения) при КРРПЖ с метастазами в кости, резистентной к энзалутамиду или абиратерону. Данных об эффективности альфа-радиотерапии после ИАС с высоким уровнем доказательности нет. Однако существенное различие механизмов действия радия-223 и ИАС позволяет предположить отсутствие перекрестной резистентности.
Цель исследования: оценить эффективность и безопасность применения радия-223 (Ксофиго) в отношении пациентов с мКРРПЖ в рамках рутинной клинической практики.
Методы
В ГАУЗ СО «СООД» радий-223 (Ксофиго) начал использоваться в терапии мКРРПЖ у пациентов с множественными метастазами в кости с 2019 г. За 2 года в нашем лечебном учреждении пролечены 129 пациентов с мКРРПЖ, которым было проведено 475 введений радия-223 (Ксофиго). В данный анализ нами были включены 54 пациента с мКРРПЖ, которые получили от 1 до 6 инъекций радия-223 [Ra-223] в рамках рутинной клинической практики.
Возраст пациентов, получавших терапию Ксофиго, cоставил от 48 до 83 лет (средний возраст – 66 лет). Объективный статус по шкале ECOG для большинства пациентов был 0–1, 96% (n=52), и лишь у 4% (n=2) на момент начала терапии радием-223 был ECOG 2. Стоит отметить, что, опираясь на данные регистрационного исследования ALSYMPCA, максимальные терапевтический эффект от терапии радием-223 получили пациенты с функциональным статусом по шкале ECOG 0 и 1.
Большинство пациентов, находившихся в нашем отделении, имели более 6 костных метастазов – 92,6% (n=50), у четырех было менее 6 метастатических очагов в костях, это составило 7,4% пациентов от общего количества (рис. 1).
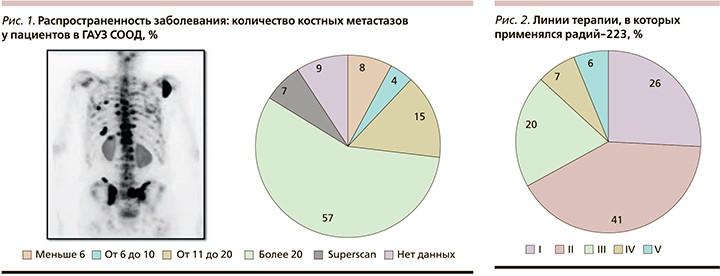
Нами также был проведен анализ исходного уровня щелочной фосфатазы (ЩФ). Пациенты распределились следующим образом: у 42 человек – 77,7%, ее уровень составил менее 220 ЕД/л, у 12 пациентов – 22,3%; более 220 ЕД/л.
Симптомные пациенты (имевшие болевой синдром по визуально-аналоговой шкале [ВАШ] от 2 до 5 баллов) составили большинство среди наших пациентов – 85% (n – 46), что соответствовало критериям включения в исследование ALSYMPCA. Однако данные исследования IIIb-фазы подтверждают, что пациенты с асимптоматическим течением мКРРПЖ также получают преимущество от терапии радием-223 по показателю ОВ (медиана ОВ в группе пациентов с отсутствием болевого синдрома составила 16 месяцев). На основании полученных результатов исследования iEAP в Клинических рекомендациях Ассоциации онкологов России (АОР) были расширены показания к применению радия-223, которые включают пациентов как с наличием, так и с отсутствием болевого синдрома.
Большинству наших пациентов не была проведена радикальная простаткэтомия на момент начала терапии радием-223 – 83,4% (n=45). И только 9 (16,6%) пациентам простатэктомия была выполнена.
Пациенты получали радий-223 в различных линиях терапии при мКРРПЖ: в первой линии терапию радием-223 получили 14 (26%) пациентов, во второй – 22 (41%), в третьей – 11 (20%), в четвертой – 4 (7%), в пятой – 3 (6%) (рис. 2).
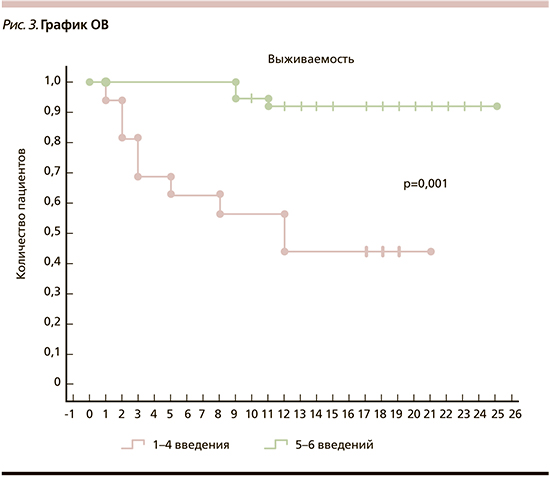
У пациентов, получивших радий-223 во второй линии, первая линия терапии была представлена: ХТ (доцетаксел) у 17 (77%) пациентов, ИАС у 5 (23%).
При анализе данных пациенты были разделены на две группы. Первая группа: пациенты, получившие 1–4 введения радия-223, 16 (29,6%) человек. Вторая группа: пациенты, получившие 5– 6 введений радия-223, – 38 (70,4%) человек.
Результаты
Мы оценивали ответ на терапию радием-223 в обеих группах по результатам контрольных радиологических исследований. Для оценки динамики со стороны костных очагов и исключения висцерального метастазирования части пациентов проводилась остеосцинтиграфия c Тc99 и компьютерная томография органов грудной клетки (КТ ОГК), компьютерная томография органов брюшной полости (КТ ОБП), магнитно-резонансная томография органов малого таза (МРТ ОМТ), другой части пациентов выполнялось ПЭТ-КТ с GA-PSMA68, которые проводились перед первым введением радия-223 и через 4 недели после завершения терапии. Критерии прогрессирования: появление новых костных очагов, увеличение уровня накопления РФП, появление висцеральных метастазов. Нежелательные явления оценивались по шкале CTC AE 5.0.
В группе пациентов, получивших 1–4 введения, проведена оценка 11 пациентам. Пяти пациентам оценка не проводилась по причине ранней смерти. Шестью (54%) пациентами достигнута стабилизация, у 1 (9%) – положительная динамика, у 4 (37%) выявлена отрицательная динамика.
В группе пациентов, получивших 5–6 введений: у 17 (45%) больных отмечена стабилизация процесса, у 10 (26%) – положительная динамика, среди этой когорты пациентов в одном случае выявлен полный радиологический ответ по данным остеосцинтиграфии (клинический случай представлен ниже), у 11 (29%) выявлена отрицательная динамика.
Нежелательное явление (НЯ) 3-й степени тяжести (анемия) было зарегистрировано только у 1 (1,8%) пациента (см. таблицу).

В процессе терапии радием-223 оценивалась динамика уровня ЩФ в обеих группах. У 33 (61%) пациентов ЩФ была без изменения уровня от исходного значения, у 17 (32%) отмечалось ее снижение, у 4 (7%) наблюдалось увеличение уровня ЩФ. Повышение уровня ЩФ коррелировало с радиологическим прогрессированием.
Летальность составила 22% (n=12).
В группе 1–4 введений умерли более половины пациентов – 9 (56%). Период наблюдение составил от 1 до 21 месяца (от даты первого цикла). Медиана ОВ составила 12 месяцев (рис. 3). В группе 5–6 введений смерть наступила только у 3 (8%) пациентов. Период наблюдение составил от 10 до 25 месяцев. Медиана ОВ не была достигнута (рис. 3).
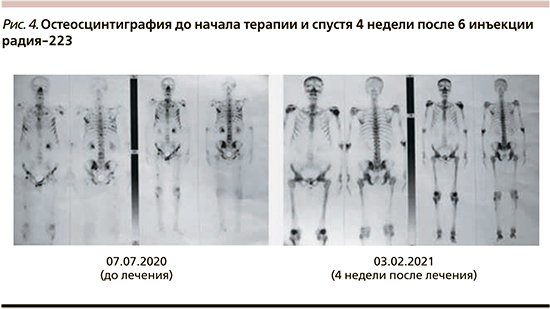
Причиной смерти всех пациентов стало прогрессирование РПЖ.
Клинический случай
Пациент Д. 60 лет. Диагноз: злокачественное новообразование предстательной железы, cT3N1M1, IV стадия, метастазы в кости.
ПСА исходное – 8 нг/мл. Гистологическое заключение – аденокарцинома. По шкале Глисона 9 баллов (4+5).
09.12.2016 проведена трансуретральная резекция (ТУР) предстательной железы. КТ ОГК, КТ ОБП, и МРТ ОМТ от 20.12.2016: признаки рака простаты с распространением на парапростатическую клетчатку и семенные пузырьки, метастатическое поражение костей скелета. ПЭТ/КТ с GA-PSMA68 от 11.01.2017: накопление фармпрепарата в подвздошных лимфоузлах справа (2,56), в остаточной ткани предстательной железы (3,10), в костях – вертлужная впадина справа (1,64), левая седалищная кость (1,5), L3 (3,55), Th7 (3,23).
На стадии мГЧРПЖ (метастатического гормоночувствительного рака предстательной железы) с января 2017 г. начата терапия в объеме максимальной андрогенной блокады (МАБ), 6 курсов монохимиотерапии (МХТ) доцетакселом, терапия бисфосфонатами. Прогрессирование зарегистрировано в июне 2018 г., когда по данным ПЭТ/КТ от 21.06.2018 было установлено появление новых метастатических очагов в затылочной кости, в правой лопатке.
С июля 2018 г. (мКРРПЖ) терапия энзалутамидом, бисфосфонатами, дегареликсом. Уровень ПСА от 30.03.2019 – 12,38 нг/мл. 10.2019 отмечен рост ПСА до 52 нг/мл.
С октября 2019 по февраль 2020 г. (мКРРПЖ) проведено 6 курсов МХТ кабазитакселом, продолжена терапия золедроновой кислотой, дегареликсом. Наблюдалось резкое увеличение ПСА от 06.07.2020 до 132,93 нг/мл. По данным сцинтиграфии, от 07.07.2020 выявлено множественное поражение костей скелета (более 20) – кости свода черепа, левой ключицы, ребер, лопаток, позвоночного столба, таза, трубчатых костей. КТ ОМТ от 28.07.2020: состояние после ТУР, КТ-признаки кальцинатов оставшейся паренхимы предстательной железы. Уровень ПСА от 31.07.2020 – 151 нг/мл, тестостерон от 07.08.2020 – 0,56 нмоль/дл, ЩФ от 31.07.2020 – 941 ЕД/л.
С 14.08.2020 по 30.12.2020 проведено 6 курсов терапии радием-223.
Через 4 недели после завершения терапии радием-223 выполнена контрольная остеосцинтиграфия. Выявлен полный радиологический ответ (рис. 4).
Заключение
Радий-223 [Ra223] продемонстрировал эффективность у пациентов с мКРРПЖ. Максимальный эффект от терапии наблюдался у пациентов, получивших 5 и более введений. При этом отмечены хорошая переносимость препарата и невысокий уровень токсичности.
Планируется дальнейшая оценка ОВ и времени до возникновения первого скелетного события в обеих группах.



