Введение
Для формирования прогноза и определения эффективной стратегии лечения пациентов при местнораспространенном раке желудка (МРРЖ) используются различные системы стадирования. Среди них наиболее широко используется система стадирования TNM UICC/AJCC [1]. Однако даже в пределах одной и той же стадии РЖ может существенно различаться в отношении прогноза после проведенного хирургического лечения. Было показано, что для более точного и индивидуализированного прогноза в систему стадирования можно включать молекулярные маркеры, геномные подтипы и дополнительные клинико-патологические параметры, такие как возраст, пол, размер первичной опухоли, расположение опухоли, количество удаленных и пораженных лимфатических узлов, объем хирургической резекции, признаки лимфоваскулярной инвазии и проведение адъювантной химиотерапии [2–6]. Кроме того, в классификации РЖ по системе TNM 7-й и 8-й редакций (2010 и 2017 гг. соответственно) имеются разночтения в отношении выявленных метастазов в большой сальник. Согласно 7-й редакции, выявленные метастазы в большой сальник должны относиться к отдаленным метастазам и классифицироваться как М1-заболевание. В 8-й редакции инвазия первичной опухоли в большой или малый сальник классифицируется как Т3, но его метастатическое поражение не учтено и в настоящее время, ориентируясь на анатомическое отношение сальника к висцеральной брюшине, его поражение большинством онкологов расценивается как проявление метастазов по брюшине [1].
В этой обзорной статье мы на когорте ретроспективных больных рассматриваем и анализируем соответствующие биомаркеры РЖ, в т.ч. поражение большого и малого сальников, влияние их на выживаемость пациентов с целью выявления факторов прогноза, которые могут дополнять текущую анатомическую систему определения стадии TNM.
РЖ является биологически агрессивным видом злокачественной опухоли и имеет тенденцию быстро распространяться локальным инвазивным ростом с вовлечением соседних структур, лимфогенно метастазировать в регионарные и отдаленные лимфатические узлы, часто формировать перитонеальные метастазы и гематогенно-отдаленные метастазы.
Проникновение опухоли через желудочную серозную оболочку значимо увеличивает риск перитонеального распространения, а также возникновения метастазов в лимфатических узлах. Zinninger et al. в 1954 г. впервые оценили распространение опухоли внутри желудочной стенки и обнаружили различные степени глубины ее поражения [7]. Распространение опухоли часто происходит через интрамуральные лимфатические узлы или в субсерозных слоях [8, 9]. Результаты многочисленных исследований говорят, что от 60 до 90% пациентов с РЖ имеют распространенность первичной опухоли в серозную оболочку, соседние органы и по меньшей мере 50% имеют метастазы в регионарные лимфатические узлы. В одном из самых больших анализов (10 783 больных раком желудка в Корее) 57% пациентов имели метастазы в лимфатические узлы, а среднее количество вовлеченных лимфатических узлов составляло 5 [10, 11].
Характер лимфогенного метастазирования также варьируется в зависимости от локализации первичной опухоли. В исследовании 1137 пациентов с опухолями желудка, расположенными в верхней, средней и нижней третях желудка, выявлены метастазы в лимфатические узлы в 12, 10 и 8% случаев соответственно [12, 13].
РЖ рецидивирует локально и системно. В корейском исследовании MSKCC анализировали 1038 пациентов, перенесших R0-гастрэктомию с D2-лимфодиссекцией. У 496 пациентов было зарегистрировано прогрессирование заболевания, полностью проанализировано 367 случаев прогрессирования (74%). Локорегиональное прогрессирование было зарегистрировано у 199 (54%) больных, отдаленные метастазы – у 188 (51%), перитонеальные метастазы – у 108 (29%). В ходе многофакторного анализа показано, что перитонеальное распространение ассоциировано с женским полом, большим распространением первичной опухоли по критерию Т, дистальной локализацией и диффузным типом опухоли. Локорегиональное прогрессирование было ассоциировано с проксимальной локализацией, более ранней Т-стадией, кишечным типом опухоли. В корейском исследовании, в котором были проанализированы 2038 пациентов после выполненной радикальной гастрэктомии, у 508 больных выявлено прогрессирование. 33% пациентов имели локорегиональное прогрессирование, 44% – перитонеальное распространение, 38% – отдаленное метастазирование [14, 15].
МРРЖ определяется как клиническая стадия ≥T2 с признаками поражения регионарных лимфатических узлов (N+) или без них. Это важно для практикующих врачей, т.к. ведение таких пациентов становится мультидисциплинарным. Степень диссекции лимфатических узлов и оптимальное количество оцениваемых лимфатических узлов оставались предметом дискуссий в течение последних нескольких десятилетий. В настоящее время решение об оптимальной степени диссекции лимфатических узлов основано на международном консенсусе в поддержку лимфаденэктомии D2, значимости количества оцениваемых лимфатических узлов и опыте хирурга в исходе лечения пациентов с МРРЖ.
Хотя не существует общепринятого минимального количества удаленных лимфатических узлов, необходимого для точного определения стадии РЖ, диссекция ≥15 лимфатических узлов коррелирует с более точной диагностикой по критерию N.
Анализ данных базы SEER показал тенденцию к улучшению общей выживаемости (ОВ) пациентов с массой удаленных лимфатических узлов [16–19].
Рекомендации по лечению МРРЖ основаны на клинической стадии заболевания у пациента. Однако присутствует индивидуализация подхода, которая учитывает ключевые факторы пациента (возраст, функциональный статус) и характеристики опухоли (локальное, региональное, отдаленное поражение, биология опухолевого процесса: гиперэкспрессия HER2, признаки микросателлитной нестабильности). Следовательно, соответствующее обследование и правильное клиническое стадирование рака желудка важны для определения оптимального времени радикальной резекции и выбора периоперационной лекарственной тактики.
Перед планированием любого лечения все пациенты с подозрением на РЖ должны пройти обследование, которое включает эндоскопию с биопсией и проведение компьютерной томографии (КТ) грудной клетки, брюшной полости и таза, обеспечивающих морфологическую оценку, визуализацию расположения опухоли, степень поражения стенки желудка, вероятность и степень поражения лимфатических узлов и метастатический статус. КТ-диагностика с целью предоперационного стадирования имеет специфичность/чувствительность от 43 до 82% для стадии по критерию T.
Для дальнейшего планирования лечения возможно выборочно использовать эндоскопический ультразвук (EUS) и рутинно рекомендовать диагностическую лапароскопию с цитологическим исследованием брюшины. Эти шаги позволяют дифференцировать раннюю стадию с более поздней стадией поражения (cT1 по сравнению с cT2 или более распространенными поражениями, N0 по сравнению с N+-заболеванием), а также определяют наличие или отсутствие скрытых перитонеальных метастазов. В современной практике EUS выполняется с целью подтверждения ранних форм рака и отбора пациентов для проведения эндоскопической резекции. Согласно исследованиям, частота метастазов в лимфатические узлы достигает следующих значений для соответствующей стадии cT заболевания: T1a (5%), T1b (24%), T2 (52%), T3 (67%), T4a (74%), и T4b (82%), также наименее вероятно поражение лимфатических узлов, когда размер первичной опухоли <2 см при высокодифференцированных аденокарциномах, отсутствии изъязвления (1,7%) и с большей вероятностью имеют метастазы в лимфоузлы, если размер опухоли больше >4 см, имеется низкодифференцированная аденокарцинома, проксимальное расположение и признаки лимфоваскулярной инвазии [20].
Диагностическая лапароскопия стала частью алгоритма определения стадии для пациентов с МРРЖ и обоснована пониманием того, что скрытые перитонеальные метастазы присутствуют почти у 52% пациентов без КТ-признаков отдаленных метастазов при визуализирующих исследованиях [21]. В современной практике все пациенты, которым запланирована неоадъювантная терапия, проходят диагностическую лапароскопию, и если макроскопически не обнаруживаются очаги канцероматоза на перитонеальных поверхностях, проводится промывание брюшины, чтобы исключить микроскопическое поражение по данным цитологического исследования.
Согласно сообщениям Нацио-нальной базы данных по раку США (NCDB), до 65% пациентов с РЖ имеют местнораспространенное заболевание (Т3/Т4) и у 85% этих пациентов на момент постановки диагноза уже присутствуют метастазы в регионарные лимфатические узлы. [21] После проведения радикального хирургического лечения средняя выживаемость таких пациентов составляет 24 месяца (5-летняя выживаемость –20–30%).
Целью нашего исследования стала оценка влияния клинико-морфологических маркеров (локализация опухоли, стадия заболевания по критерию Т, N, поражение большого/малого сальника, морфологический тип опухоли) на выживаемость пациентов с диагнозом МРРЖ после проведенного радикального хирургического лечения.
Методы
Для ретроспективного анализа выбраны 124 пациента в возрасте от 29 до 86 лет (средний возраст – 65,69±10,09; 95% ДИ: 63,90–67,49) с диагнозом РЖ I–III стадий, получавших только хирургическое лечение в период с 2015 по 2018 г. в условиях СПбГБУЗ ГКОД.
У 32 (26,1%) пациентов первичная опухоль локализовалась в области кардиоэзофагеального соединения, у 61 (48,9%) – в области тела желудка, у 31 (25,0%) – в области привратника.
После проведенного морфологического исследования послеопреационного материала у 14 (11,3%) пациентов верифицирована высокодифференцированная аденокарцинома, у 38 (30,6%) – умереннодифференцированная, у 54 (43,6%) – низкодифференцированная аденокарцинома, у 15 (12,1%) больных – перстневидноклеточный рак и у 3 (2,4%) выявлена муцинозная аденокарцинома низкой степени дифференцировки.
Всем пациентам проведено радикальное хирургическое лечение (резекция/гастрэктомия) с последующим стадированием заболевания по системе TNM (7-я редакция) с дополнительной оценкой поражения большого/малого сальника. У 18 (14,5%) пациентов зарегистрирована IA-стадия опухолевого заболевания, у 10 (8,1%) – IB-стадия, у 23 (18,5%) – IIA, у 15 (12,1%) – IIB, у 27 (21,8%) – IIIA, у 26 (21,0%) – IIIB и у 5 (4,0%) – IIIC-стадии.
Результаты
С целью оценки влияния клинико-морфологических факторов на выживаемость больных МРРЖ на первом этапе исследования нами был проведен однофакторный анализ и сравнение кривых выживаемости, построенных по методу Каплана–Мейера с помощью log-rank теста.
При оценке прогностической ценности локализации опухолевого процесса получены следующие результаты. Медиана ОВ, опухоль которых локализовалась в области привратника, составила 55 месяцев (95% ДИ: 36–55) и на 22 месяца превысила медиану ОВ пациентов с опухолью кардиоэзофагеального перехода: 23 месяца (95% ДИ: 19,0–24,0), однако данные различия были незначимыми (р=0,1671). Медиана ОВ пациентов, опухоль которых локализовалась в области тела желудка, на момент оценки не достигнута (время наблюдения – 39–53месяца).
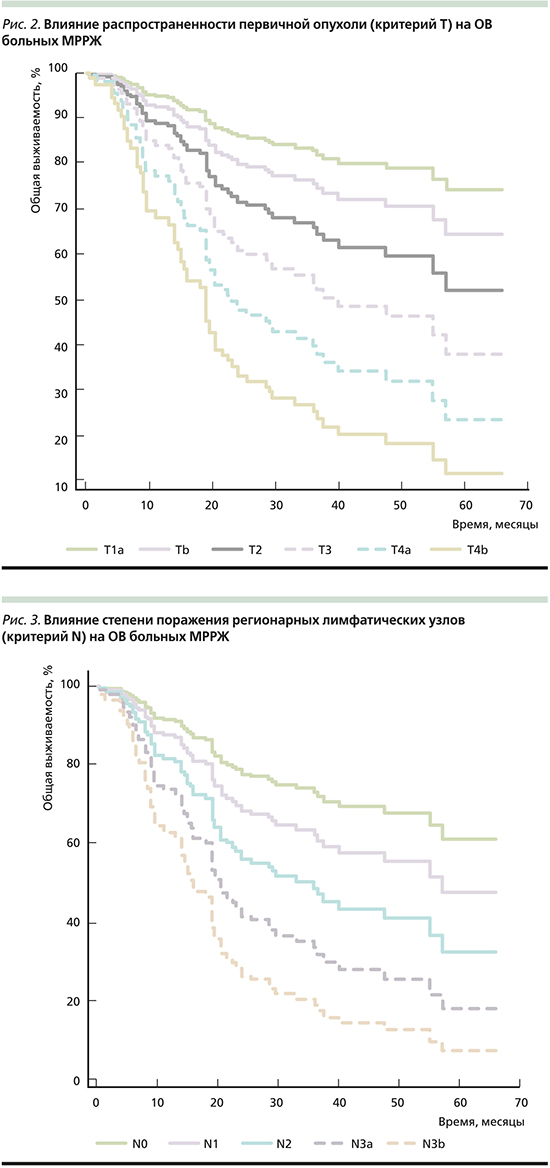
При оценке влияния распространенности первичного опухолевого очага по дискриптору «Т» на ОВ больных МРРЖ выявлено, что медианы ОВ у пациентов, опухоль которых соответствовала критериям T1a, T1b и T2, на момент оценки не достигнута при общем сроке наблюдения от 35 до 65 месяцев. Медиана ОВ пациентов, первичная опухоль которых соответствовала Т3, составила 29,5 месяцев (95% ДИ: 19,5–57,0), что на 9 месяцев превысило медиану ОВ пациентов, первичная опухоль которых соответствовала T4b: 20,5 месяцев (95% ДИ: 7,0–37,5) и на 20 месяцев превысило медиану ОВ пациентов с первичной опухолью T4a: медиана ОВ – 9 месяцев (95% ДИ: 5,5–55,0) (р=0,0001; ОР=0,38: 95% ДИ: 0,14–0,98).
Медиана ОВ пациентов, у которых не было выявлено поражение регионарных лимфатических узлов, на момент оценки не достигнута (срок наблюдения – 47–59 месяцев), что достоверно превышает медианы ОВ пациентов, у которых поражение регионарных лимфатических узлов расценено как N1 (медиана ОВ – 40 месяцев, 95% ДИ: 15,5–57,0; ОР=2,84: 95% ДИ: 1,43–5,68), N2 (медиана ОВ – 29,5 месяцев, 95% ОВ: 19,0–37,5; ОР=2,89: 95% ДИ: 1,47–5,69), N3a (медиана ОВ –19,0 месяцев, 95% ДИ: 9,5–29,0; ОР=4,75: 95% ДИ: 2,27–9,95) и N3b (медиана ОВ – 6,5 месяцев, 95% ДИ: 4–14; ОР=20,63: 95% ДИ: 1,57–271,2); р<0,0001.
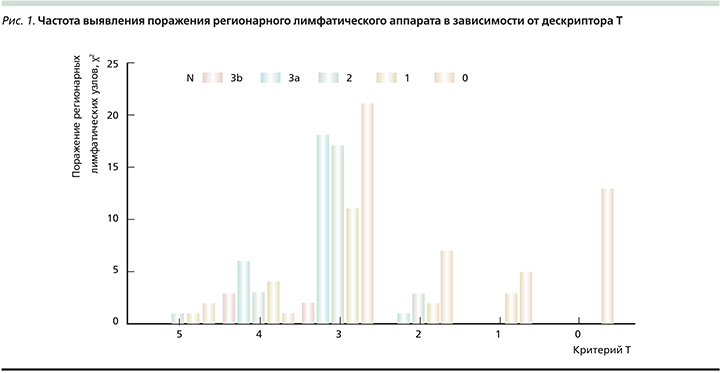
Кроме того, нами оценена зависимость частоты выявления поражения регионарных лимфатических узлов (N) от размера первичной опухоли (T) с помощью критерия хи-квадрат: значимо чаще поражение регионарного лимфатического аппарата морфологически выявляется у пациентов с Т3a-первичной опухолью, а непосредственно поражение лимфатических узлов наиболее часто укладывается в критерии N2 и N3a (рис. 1).
Степень дифференцировки опухоли значимого влияния на показатель ОВ не оказала (р=0,2888). Однако у пациентов с верифицированной высодифференцированной аденокарциномой медиана ОВ на момент оценки не достигнута (период наблюдения – 35–56 месяцев), медиана ОВ у пациентов с умеренно дифференцированной аденокарциномой составила 57 месяцев (95% ДИ: 25,5–57,0), с перстневидноклеточным раком желудка – 37,5 (95% ДИ: 9,0–37,5), с низкодифференцированной аденокарциномой – 29,5 (95% ДИ: 16,0–55,0), с муцинозной аденокарциномой – 18 месяцев (95% ДИ: 6,5–18,0).
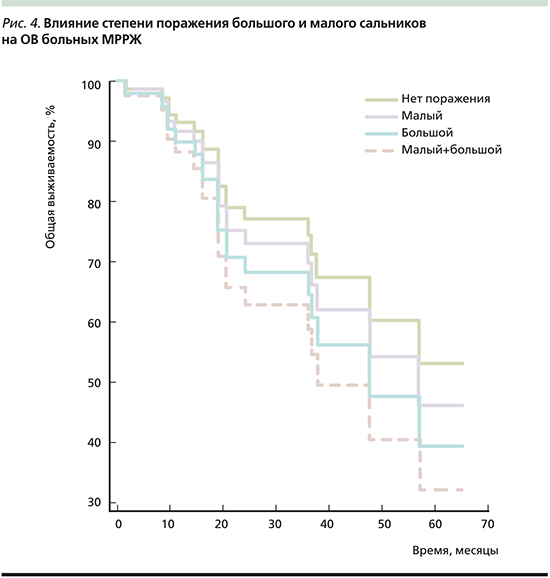
Нами была выявлена значимая прогностическая ценность степени метастатического поражения малого и большого сальников (р<0,0001). Медиана ОВ пациентов без поражения сальников на момент оценки не была достигнута (период наблюдения – 42–54 месяца). Медиана ОВ пациентов с поражением только малого сальника составила 57 месяцев (95% ДИ: 19–57), что на 28 месяцев превысило медиану ОВ пациентов с изолированным поражением большого сальника (29 месяцев, 95% ДИ: 29,0–29,0) и на 38 месяцев превысила медиану ОВ пациентов с сочетанным поражением малого и большого сальников (19 месяцев, 95% ДИ: 11,0–36,5).
Все факторы, оказавшие в ходе однофакторного анализа значимое влияние на показатель ОВ, были включены в модель пропорциональных рисков Кокса: размер первичной опухоли (Т), уровень поражения регионарного лимфатического аппарата (N), а также наличие поражения большого или малого сальника. В целом значимость всей модели была несомненной: р<0,0001. Значимое прогностическое влияние оказали показатели, характеризующие распространенность опухолевого процесса: критерий Т (р=0,0090) и критерий N (p=0,0016; рис. 2, 3).
Несмотря на то что в многофакторном анализе поражение большого и малого сальников не оказало значимого влияния на ОВ больных МРРЖ, данный вопрос требует дальнейшего изучения, поскольку в модели Кокса более благоприятным влиянием на показатель ОВ оказывало поражение большого, а не малого сальника, что позволяет увеличивать ОВ на 12–60% (р=0,4046; рис. 4).
Обсуждение
Если мы обратимся к данным литературы, то схожий опыт центра в Турции [22] по анализу данных 345 больных после гастрэктомии также продемонстрировал медиану общей выживаемости в 51 месяц, а показатели 1-, 3- и 5-летней выживаемости составили 85, 55 и 45% соответственно. Средняя ОВ, как и в нашем исследовании, не была достигнута при стадиях IA и IB. Согласно однофакторному анализу, размер опухоли (p<0,001), стадия T (p<0,001), стадия N (p<0,001), стадия TNM (p<0,001), степень (p<0,001) и наличие лимфоваскулярной инвазии (p=0,005) были определены как факторы, влияющие на выживаемость. Согласно многофакторному анализу, Т-стадия была определена как независимый прогностический фактор для общей выживаемости и было отмечено трехкратное увеличение смертности среди пациентов с Т4-стадией по сравнению с пациентами со стадией T1 (p=0,001). Статус заболевания по критерию N охарактеризован как еще один независимый прогностический фактор для общей выживаемости: смертность увеличилась в 4,2 раза у пациентов с категорией N3 и в 2,7 раза у пациентов с категорией N2 по сравнению с пациентами с категорией N0 (p<0,001). Однако поражение сальника в данном исследовании не учитывалось.
Традиционно оментэктомия выполняется как часть субтотальной/тотальной гастрэктомии с лимфаденэктомией. Считается, что полное удаление большого сальника необходимо для устранения микрометастазов [23]. Однако нет единого мнения относительно реальной пользы оментэктомии для улучшения выживаемости и уменьшения риска рецидивов.
Более того, несколько исследований продемонстрировали отсутствие разницы в ОВ или выживаемости без прогрессирования между тотальной и частичной оментэктомией при гастрэктомии [23–27]. Несмотря на то что есть некоторые исследования, в которых сравнивались отдаленные результаты и выживаемость при тотатальной и парциальной оментэктомии в хирургии рака желудка, конкретные исследования, касающиеся частоты метастатического поражения сальника, отсутствуют. Haverkamp et al. [28] проспективно оценивали наличие опухолевого поражения лимфатических узлов сальника и опухолевых депозитов у 50 пациентов, перенесших гастрэктомию. У 1 (2%) было метастатическое поражение лимфоузлов сальника (стадия IB) и у 4 (8%) имелись депозиты опухоли сальника (стадии IB, IIA, IIB и IIIA). Пациенты с опухолевыми депозитами имели значительно более низкие показатели одногодичной безрецидивной выживаемости по сравнению с пациентами без опухолевого поражения сальника (0 против 58,7%; p=0,003). Однако не было обнаружено значимой разницы в одногодичной ОВ (25,0 против 67,4%; р=0,079). Авторы не обнаружили никаких прогностических факторов для метастазов в сальник [29].
В другом проспективном исследовании под названием OMEGA было проанализировано наличие метастазов в сальник у 100 пациентов. Метастазы были обнаружены у 5 (5%) пациентов (2 с метастатическим лимфоузлом и 3 с депозитами опухолевых клеток). Все опухоли были не ниже pT3-стадии, метастаз в сальник также достоверно коррелировал с локализацией в проксимальном отделе желудка (p=0,002), диаметром опухоли ≥5 см, стадией заболевания III–IV (p=0,010) и категорией pM1 (р<0,001) [26].
Настоящее исследование подтверждает результаты исследования OMEGA. Обнаружена значимая корреляция с размером опухоли (все пациенты с метастазами в сальник были отнесены к стадии pT3/T4, что позволяет задуматься о возможности отказа от тотальной оментэктомии при опухолях стадии T1/T2). Фактически пациенты с наличием метастазов в сальнике имели запущенное заболевание, и была значимая корреляция со стадией N и клинической стадией. Тем не менее при подавляющем большинстве опухолей pT3/T4 не было метастатических сальников, что позволяет предполагать, что при многих опухолях T3/T4 можно также избегать тотальной оментэктомии. Суть вопроса в том, как идентифицировать этих пациентов до операции, поскольку размер опухоли был единственным фактором риска, связанным с поражением сальника. Другие важные параметры, такие как наличие венозной инвазии, метастатическое поражение лимфатических узлов, можно оценить только после операции. Редкость случаев также предполагает, что другие факторы могут быть связаны с поражением сальниковых лимфоузлов.
Заключение
Основываясь на кривой ОВ пациентов с метастазами в большой сальник, можно утверждать, что при поражении лимфатических узлов сальника развивается системное заболевание с очень неблагоприятным прогнозом. Целью проведения тотальной оментэктомии является удаление микрометастазов и, следовательно, избежание рецидивов, в основном перитонеальных. Поскольку всем пациентам этой когорты выполнялась тотальная оментэктомия, можно предположить, что удаление всего сальника во время радикальной гастрэктомии не предотвращает развития рецидива и смерти от прогрессирования заболевания.


