Введение
Настоящий аналитический обзор посвящен важным вопросам оценки эффективности лечения в нейроонкологии. Оценка эффективности противоопухолевого лечения нужна для выполнения клинических исследований, а также в повседневной практике для определения эффективности проводимого лечения [1]. Для такой оценки необходимо выработать критерии, которые, с одной стороны, были бы просты и удобны в использовании, с другой – как можно более полно учитывали бы особенности опухолей ЦНС в отношении как нейровизуализации, так и их клинического течения (динамика неврологического статуса, использование кортикостероидов, применение иммунотерапии и пр.).
Считается, что исторически первыми в онкологии для клинических исследований были предложены критерии RECIST – Response evaluation criteria in solid tumors (критерии оценки ответа солидных опухолей [на лечение]). Это набор определений и понятий, разработанных для оценки ответа опухоли на проводимое лечение: ответ («response»), стабилизация или прогрессирование («progression»).
Критерии RECIST впервые были опубликованы в феврале 2000 г. Международной кооперацией экспертов, включавшей следующие организации: Европейская Организация по Исследованию и Лечению Рака (European Organisation for Research and Treatment of Cancer, EORTC), Национальный Институт Рака США (National Cancer Institute of the United States, NCI), Группа Клинических Исследований Национального Института Рака Канады (National Cancer Institute of Canada Clinical Trials Group) [2]. На сегодня в подавляющем большинстве клинических исследований в онкологии используют критерии RECIST в редакции 2009 г. [3].
Однако на самом деле и в этой области, вероятно благодаря бурному развитию нейровизуализации в начале 1990-х гг., критерии оценки динамики опухолей ЦНС были предложены намного ранее – в 1990 г. (!). Такими критериями стали предложенные D.R. Macdonald et al. «Response criteria for phase II studies of supratentorial malignant glioma» (Критерии ответа [на лечение] для клинических исследований II фазы в лечении супратенториальной злокачественной глиомы).
При бурном развитии нейроонкологии с массой клинических исследований в начале текущего столетия с улучшением данных нейровизуализации, накоплением новых знаний и опыта в лечении опухолей ЦНС стало ясным, что необходимо выработать новые критерии для оценки эффективности противоопухолевого лечения в нейроонкологии. В 2008 г. была образована группа международных экспертов, включившая специалистов Radiation Therapy Oncology Group, RTOG (Группа Радиологов-Онкологов, США и Канада), а также European Association on Neurooncology (EANO). И в 2009–2010 гг. были опубликованы результаты этой экспертной работы в виде новых критериев RANO (Response Assessment Criteria for Neurooncology). В нашей стране критерии RANO впервые представлены в докторской диссертации Г.Л. Кобякова в 2012 г. [4] и официально рекомендованы в Клинических рекомендациях по лечению опухолей ЦНС Минздрава России в редакциях от 2018 и 2020 гг. [5, 6].
Наш обзор посвящен терминологии и принципам оценки эффективности противоопухолевого лечения в нейроонкологии, согласно критериям RANO.
Общие принципы оценки эффективности противоопухолевого лечения в онкологии. Критерии RECIST
На основании различных инструментальных методов оценки опухолевых очагов в общей онкологии для оценки динамики опухоли используют стандартные критерии оценки солидных опухолей RECIST в редакции 2014 г. (RECIST 1.1). Данные критерии используются при компьютерной и магнитно-резонансной томографии, в некоторых случаях – при традиционной рентгенографии [2, 3, 7].
Ключевые понятия RECIST 1.1 включают:
1. Целевые (таргетные) очаги (не более 5, не более 2 на орган и наиболее воспроизводимые).
2. Измеряемые очаги (размер не менее 10 мм для солидного очага, патологический лимфоузел более 15 мм по короткой оси, литический или смешанный очаг в кости с мягкотканым компонентом не менее 10 мм).
3. Неизмеряемые очаги (остеобластические очаги, поражение мозговых оболочек, плевральный и перикардиальный выпот, асцит и перитонеальные метастазы и лим- фогенный карциноматоз).
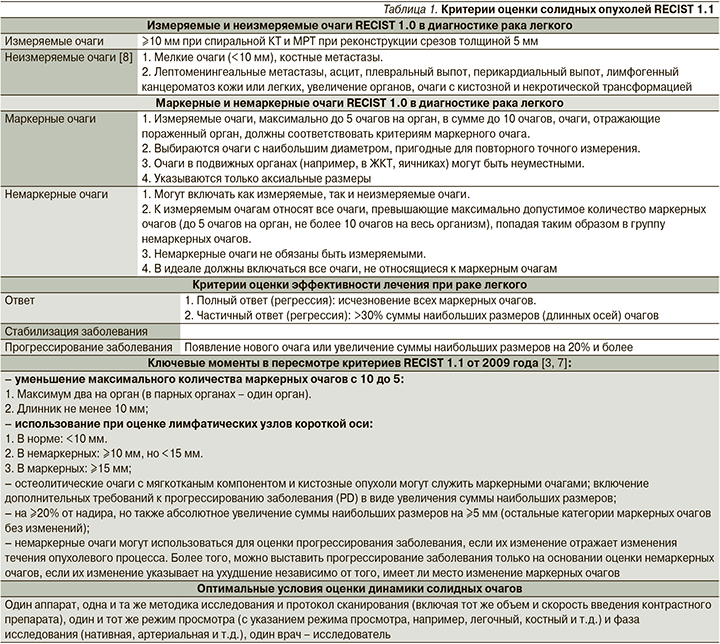
Ключевые правила измерения в RECIST 1.1 включают следующие понятия (табл. 1):
- в солидном очаге оценивается только наибольший диаметр.
- в лимфоузле оценивается только наиболее короткий диаметр.
- в костном очаге оценивается только солидный компонент.
Критерии оценки солидных опухолей RECIST представлены в табл. 1.
В системе RECIST при выполнении КТ-исследования обязательно использование внутривенного контрастирования с единой методикой постконтрастного сканирования. Для сливающихся/разделившихся очагов сравнивается наиболее длинный диаметр общего очага с суммой наиболее длинных размеров новых очагов. Сумма диаметров всех выбранных таргетных очагов принимается за исходную точку отсчета для последующей оценки эффекта лечения по сравнению с ней.
Все другие очаги считаются нетаргетными и учитываются в дальнейшем как таковые, нетаргетные [3, 7].
Мы намеренно представляем подробно эти данные, чтобы показать, что, например, для первичных опухолей ЦНС данная система оценки не удобна и трудно применима.
Критерии Macdonald в нейроонкологии
Мы уже указывали, что исторически первым подходом к оцифрованной оценке динамики опухоли вообще стали критерии, предложенные группой экспертов для применения в клинических исследованиях лечения злокачественных глиом. Этот исторический факт безусловно базировался, во-первых, на том, что злокачественные глиомы только анекдотически распространяются за пределы нервной системы, во-вторых, на том, что все современные технологии визуализации анатомических структур человека развивались прежде всего в виде нейровизуализационных достижений, а потом уже распространялись на другие отделы организма человека. Так, первый компьютерный томограф был предложен для сканирования головного мозга, первые МРТ также применялись сначала на относительно стабильных (неподвижных) структурах головного и спинного мозга, а затем адаптировались для других органов и систем.
Итак, эти критерии были впервые опубликованы в 1990 г. [9]: было предложено измерять очаги по контрастной КТ (МРТ с контрастом еще не была внедрена в повседневную практику!). Оценивались накапливающие контраст очаги по произведению двух перпендикулярных диаметров на наибольшем по площади срезе опухоли – базовая оценка.
Далее при последующих контрольных исследованиях делалось заключение об эффективности:
- Полный ответ (ПО) – отсутствие очага накопления контраста.
- Частичный ответ (ЧО) – уменьшение произведения перпендикулярных диаметров более, чем на 50%.
- Стабилизация болезни (СБ) – уменьшение произведения перпендикулярных диаметров менее чем на 50%, или увеличение не более чем на 25%.
- Прогрессирование болезни (ПБ) – увеличение произведения перпендикулярных диаметров более, чем на 25%.
Со времени внедрения в качестве основного метода исследования в нейроонкологии МРТ эти критерии продолжали использоваться в клинических исследованиях, хотя и с некоторыми модификациями. Дело в том, что не все глиомы и вообще не все опухоли ЦНС накапливают не только рентгеноконтрастный препарат, но и гадолиниум [9, 10]. Поэтому предлагались уточнения для оценки глиом низкой степени злокачественности. Но по мере накопления опыта и событий на фоне лечения стало ясным, что критерии Macdonald стали необъективными в типичных клинических ситуациях. Так, при проведении крупного международного исследования III фазы, обычно цитирующегося сейчас как исследование Stupp по применению одновременной химиолучевой терапии с темозоломидом больных с впервые выявленной глиобластомой, был отмечен феномен псевдопрогрессирования, на котором мы остановимся ниже. А в течение серии исследований по эффективности антиангиогенной терапии бевацизумабом больных с рецидивом глиобластомы и с первичной глиобластомой [12–18] было также выявлено явление «псевдоответа» опухоли на лечение. Все это легло в основу разработки критериев RANO.
Критерии RANO в нейроонкологии
Тенденцией экспертов в нейроонкологии стала разработка критериев RANO сначала для глиом высокой степени злокачественности (с учетом опыта использования критериев Macdonald) [10], а затем дальнейшая адаптация этих данных для глиом низкой степени злокачественности, менингиом, для метастатического поражения головного мозга, при использовании иммунотерапии (iRANO) и пр.
Оценка опухолевых очагов осуществляется с применением тех же ключевых понятий (измеряемые таргетные, или ключевые очаги и неизмеряемые, нетаргетные (неключевые) очаги по данным контрольной МРТ головного/спинного мозга с контрастным усилением, что и в системе RECIST) [10]. Сопоставление перечисленных систем критериев оценки RECIST, Macdonald, RANO приведено в табл. 2.
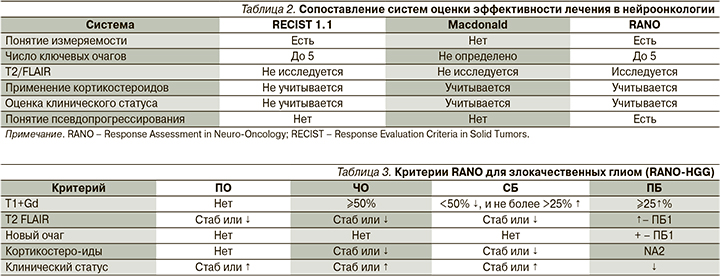
Принципиальные отличия критериев RANO от RECIST (и от критериев Macdonald):
- измерение контрастнакапливающего очага в виде суммы двух перпендикулярных диаметров на наибольшем по площади срезе опухоли;
- включение в оценку клинического статуса (критерий прогрессирова-ния – нарастание неврологической симптоматики);
- включение в оценку использования кортикостероидов (могут улучшать клинический статус при МКРЛ, например, или при лимфоме ЦНС, могут приводить к временному уменьшению размеров интракраниальных очагов);
- оценка помимо контрастного режима Т1, режима T2/FLAIR (это важно, так как на фоне антиангиогенных препаратов, например бевацизумаба, контрастирование очага может снижаться, но его общие размеры при этом могут увеличиваться);
- введено понятие псевдопрогрессирования – временного увеличения размеров контрастируемой части опухоли в первые 1–2 месяца после проведения химиолучевой терапии темозоломидом (или только лучевой терапии) с последующей стабилизацией или уменьшением на фоне продолжающегося стандартного лечения [11–16].
Остановимся на этих важных аспектах, проиллюстрировав их клиническими примерами.
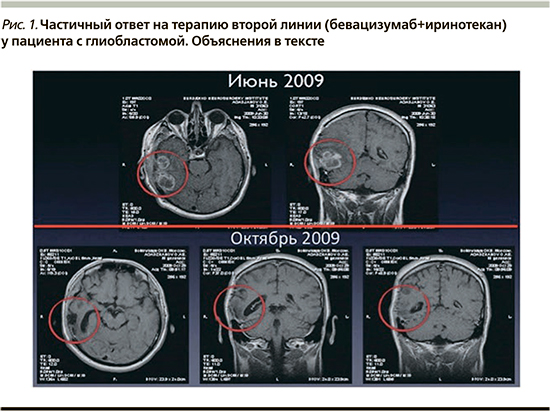
На рис. 1 приведены данные МРТ головного мозга пациента с рецидивом глиобластомы: МРТ после проведения ХЛТ с темозоломидом, трех курсов темозоломида 5/23 – рецидив опухоли. В нижнем ряду – контрольная МРТ после четырех введений Авастина и Иринотекана – уменьшение размеров опухоли в режиме как Т1 с контрастом, так и Т2, Т2 FLAIR (существенное уменьшение зоны перифокального отека). По критериям RANO – частичный ответ на лечение.
Чтобы быть последовательными в нашем обзоре критериев оценки эффективности в нейроонкологии, приведем еще одну таблицу (табл. 3) – собственно таблицу параметров, которые учитываются в критериях оценки RANO (в данном случае первоначальный вариант для оценки эффективности лечения глиом высокой степени злокачественности) [17, 18].
Для критерия «Полный ответ (ПО)» требуется:
T1+Gd – полное отсутствие измеряемых или неизмеряемых очагов накопления контраста; нет новых очагов; стабильные или улучшившиеся очаги в T2/FLAIR, не накапливающие контраст; пациенты не должны получать кортикостероиды (или в дозах только для возмещения физиологической нормы); клинический статус стабильный или с улучшением. Важно: у пациентов с неизмерямыми очагами (только) не может быть достигнут ПО или ЧО, а только СБ.
Для критерия «Частичный ответ (ЧО)» требуется:
≥50%-ное уменьшение измеряемого очага по сравнению с исходной оценкой (получается как сумма перпендикулярных диаметров всех измеряемых очагов накопления контраста) по крайней мере через 4 недели от этой исходной оценки; отсутствие прогрессирования неизмеряемых очагов; отсутствие новых очагов контрастирования; стабильная или улучшившаяся картина очагов в режиме T2/FLAIR по сравнению с исходными данными на фоне стабильных или снижающихся доз кортикостероидов; доза кортикостеридов при контроле не должна быть выше, чем на момент исходной МРТ; клинический статус – стабильный или с улучшением.
Для критерия «Стабилизация болезни (СБ)» требуется:
Не подпадает под ПО, ЧО, ПБ; стабильная или улучшившаяся картина очагов в режиме T2/FLAIR по сравнению с исходными данными на фоне стабильных или снижающихся доз кортикостероидов. В случае если дозы кортикостероидов были увеличены на основании нарастания симптоматики без подтверждения МРТ и последующее контрольное обследование установит признаки прогрессирования, последним МРТ, при котором следует заключить о СБ (а не о прогрессировании), таковым становится сканирование, когда доза была эквивалентна дозе при базовом обследования, а последующая «стабилизация» уже засчитывается как прогрессирование.
Для критерия «Прогрессирование болезни (ПБ)» требуется:
хотя бы одно из следующего: ≥25%-ное увеличение сумм полученных перпендикулярных диаметров всех измеряемых очагов по сравнению с наименьшим измерением, зафиксированным или при исходном (базовом) обследовании, или по сравнению с измерением при наилучшем ответе, на стабильных или увеличенных дозах кортикостероидов; значительное увеличение зоны патологического сигнала в режиме T2/FLAIR при стабильных или увеличивающихся дозах кортикостероидов по сравнению с исходным сканированием или лучшим ответом после начала терапии, не вызванным коморбидными явлениями (например, постлучевыми изменениями, демиелинизацией, ишемическими изменениями, инфекционным процессом, судорогами, послеоперационными изменениями или другими побочными эффектами от какого-то проводимого лечения); любой новый очаг накопления контраста; явное клиническое ухудшение, не связанное с другими причинами, кроме опухоли (например, судорожными припадками, побочными эффектами сопроводительной терапии, осложнениями проводимого основного лечения, «церебро-васкулярными» событиями, инфекцией и т.д.), или потребовавшее увеличения доз кортикостероидов; неявка на обследование в результате смерти или ухудшения состояния; или явное прогрессирование неизмеряемой части опухоли [17–20].
Из-за трудностей в количественной оценке прогрессирования неизмеряемых очагов (зоны патологического сигнала в режиме T2/FLAIR) критерии RANO-HGG предполагают, что любое качественное увеличение зоны патологического сигнала в режиме T2/FLAIR представляет собой прогрессирование. Это отсутствие количественной меры зоны неизмеряемого прогрессирования служит ограничением существующих критериев RANO-HGG. Кроме того, существует дискуссия относительно полезности оценки зоны патологического сигнала в режиме T2/FLAIR в исследованиях с участием агентов, к не влияющих на проницаемость сосудов. Оценка перифокальной зоны также проблематична в исследованиях с иммунотерапией, поскольку иммунологические подходы, вероятно, увеличивают перитуморальный отек, который не может быть легко дифференцирован от прогрессирования зоны неизмеряемой части опухоли.
В результате этот компонент критериев RANO-HGG часто исключается из исследований иммунотерапии.
Важным в системе критериев RANO-HGG является понятие псевдопрогрессировния. Под этим феноменом понимают временное увеличение зоны контрастирования и/или зоны перифокального отека в режиме T2/FLAIR, возникающие в пределах зон проведенного лучевого лечения (обычно одновременного химиолучевого лечения темозоломидом) в течение 1–2 месяцев после окончания радиотерапии. Если на фоне стандартной продолжающейся противоопухолевой терапии (адъювантная терапия темозоломидом) при стабильных или снижающихся дозах кортикостероиднов на повторном МРТ (обычно через 4 недели) выявляется улучшение или по крайней мере отсутствие дальнейшего нарастания МР-семиотики, то такая ситуация расценивается как псевдопрогрессирование. Если же при повторном МРТ выявляются признаки дальнейшего увеличения очага накопления контраста и/или зоны неизмерямой опухоли (перифокального отека), то ситуация интерпретируется как прогрессирование [16–20]. Ниже приведен клинический пример псевдопрогрессирования (рис. 2).
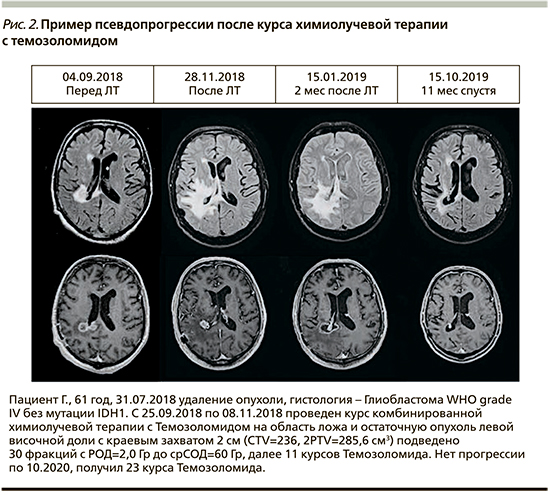
Итак, изменения, возникшие на МРТ вследствие псевдопрогрессирования, со временем регрессируют, в то время как истинное прогрессировние болезни приводит к нарастанию МР-семиотики. Считается, что нет достоверных инструментов визуализации, которые бы однозначно провели грань между прогрессированием и псевдопрогрессированием (ASL-перфузия, диффузия только помогают обсуждать проблему, но не решают ее).
Считаем полезным использование ПЭТ/КТ с метионином, но при условии, что эта технология была применена на дооперационном или на этапе планирования ЛТ, чтобы была возможность оценки событий в динамике.
Критерии RANO для глиом низкой степени злокачественности (RANO-LGG)
ЗА последние 10 лет существенно прояснились молекулярные основы глиом низкой степени злокачественности. Это было отражено в последней редакции классификации ВОЗ опухолей ЦНС, 2016 [21]. Для глиом низкой степени злокачественности спефичны как сама морфологическая картина, так и молекулярно-генетические особенности. Речь, конечно, прежде всего идет об мутациях генов изоцитратдегидрогеназы (IDH), а также о синхронной потере плеча хромосомы-1 и хромосомы-19 в олигодендроглиомах (1p/19q) [21]. Еще до того как были обнаружены мутации IDH, мы уже знали, что глиомы низкой степени злокачественности отличаются от глиом высокой степени злокачественности по клиническому течению (очень медленное прогрессирование, годами создается впечатление об отсутствии признаков прогрессирования при контрольных МРТ), по данным МРТ характеризуются или отсутствием, или только минимальным локальным накоплением РФП, с зоной изменений, соответствующих опухоли, более ясно представленной в режиме T2/FLAIR в виде очага гиперинтенсивного сигнала, нередко с довольно четкими границами. С учетом клинического течения МРТ-признаки глиом низкой степени злокачественности могут требовать дифференциального диагноза с демиелинизирующими процессами, постишемическими изменениями или поздними лучевыми реакциями мозга на радиотерапию [3, 6].
Критерии RANO для глиом высокой степени злокачественности оказались не достаточно адаптированными для интерпретации событий в лечении глиом низкой степени злокачественности. Поэтому для этой группы опухолей критерии RANO были модифицированы: в первую очередь учитывается выраженность изменений на T2/FLAIR-изображениях, а не зона накопления контраста [22]. Дополним это еще и тем, что при лечении глиом низкой степени злокачественности объективный ответ на лечение (>50%-ного уменьшения зоны патологического сигнала) наблюдается очень редко, поэтому эксперты RANO предложили ввести для этой категории опухолей понятие «малый ответ» на лечение (уменьшение зоны патологического сигнала >25% но <50%; табл. 4).

Дополним представленные выше рассуждения экспертов RANO о различиях глиом низкой степени злокачественности соображениями, основанными на нашем опыте, проиллюстрировав ситуацию следующим клиническим примером.
Приведем снимки пациентки Ш. 51 года (рис. 3), которая годами наблюдалась в одной и той же клинике, выполняла ежегодно МРТ головного мозга в стандартных режимах, и, по заключениям рентгенологов, не отмечалось «существенных изменений» на протяжении почти 10 лет. Методической ошибкой врачей-рентгенологов было сравнение только с последними данными, без взгляда на проблему сквозь годы. Видно, что, если сравнить МРТ-данные с интервалом в 5 лет, то отрицательная динамика изменений зоны патологического сигнала в режиме T2/FLAIR совершенно очевидна. Чтобы показать, насколько это важно, приведем МРТ той же пациентки через год после возобновления химиотерапии: видна тенденция к «малому ответу» опухоли на лечение.
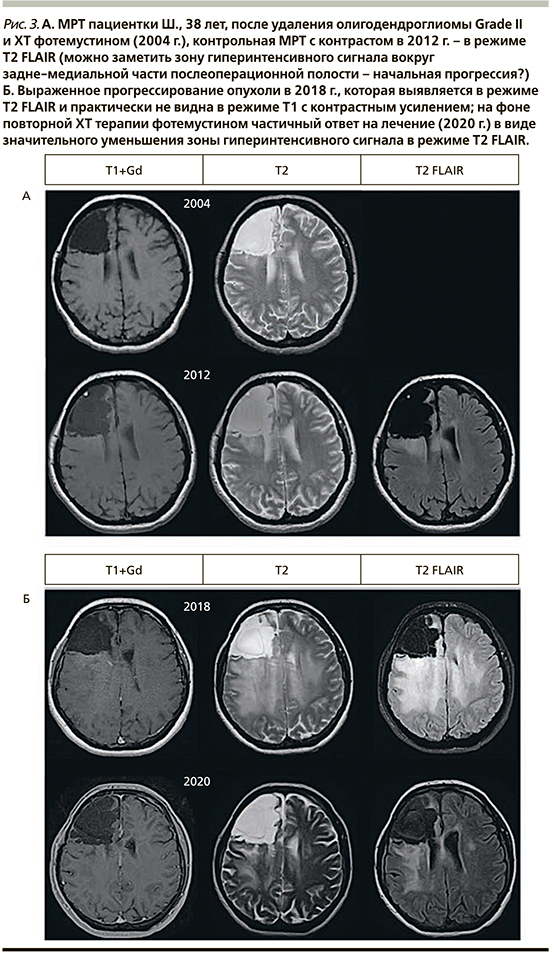
Так что, по нашему мнению, при интерпретации событий у пациентов с глиомами низкой степени злокачественности нужно реферировать данные нейровизуализации к как можно более ранним данным с интервалом для сравнения в несколько лет.
Критерии RANO для метастатического поражения ЦНС (RANO-BM, метастазов в головной мозг, или МГМ)
Метастазы в ЦНС представляют собой важное и инвалидизирующее неврологическое осложнение системного рака, встречающееся у до 40% пациентов с солидными опухолями [23]. При выявлении МГМ лечение обычно включает местную терапию, как то хирургическая резекция или лучевая терапия. В то же время в последние годы при ряде злокачественных новообразований (рак легкого, меланома, рак молочной железы) выявлено несколько драйверных мутаций, разработаны таргетные препараты. Эти последние применяются и у больных МГМ, но их роль считается ограниченной в связи с феноменом гематоэнцефалического барьера. Тем не менее оценка динамики интракраниальных очагов у пациентов с МГМ является актуальной задачей клинических исследований и повседневной практики. Следует отметить также, что на протяжении большого периода времени пациенты с солидными опухолями исключались их протоколов клинических исследований при выявлении МГМ [24–25], т.е. оставались за возможностью оценки эффективности системных подходов к лечению. Это привело к ограниченному пониманию эффективности тех или иных противоопухолевых препаратов в этой популяции и определению надежных конечных точек с целью как можно надлежащим образом получить ответ на заболевание.
До создания рабочей группы RANO-BM в клинических исследованиях в общей онкологии часто использовали критерии RECIST для оценки ответа, имели ограничения и сложности при применении к МГМ, включая необходимость суммирования как ЦНС, так и системных поражений в один показатель, поскольку они рассматривались как единый патологический процесс [24]. Были и другие недостатки в подходе к включению пациентов с БМ в исследование с учетом присущей им гетерогенности гистологии и популяции пациентов, а также предпочтения поставщиков услуг в отношении визуализации и частоты мониторинга [23, 24]. Поскольку исследования могли включать любой из доступных критериев оценки ответа, это привело к отсутствию единообразия в сравнении эффектов лечения в разных исследованиях.
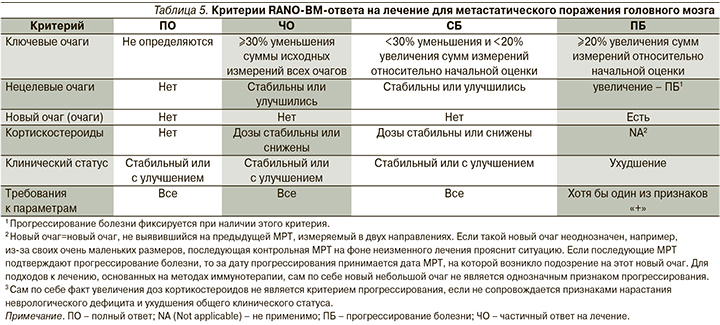
Рабочая группа RANO-BM впервые предложила стандартные критерии для определения ответа и прогрессирования в исследованиях МГМ, основанные на консенсусном мнении [21, 23, 24]. Как и в случае с RANO-HGG, учитывается клиническое состояние пациента и применение кортикостероидов. В отличие от RECIST мозг рассматривается как отдельная анатомическая область, что позволяет оценивать состояние болезни системно и в мозге в некотором роде отдельно. RANO-BM определяет измеримое заболевание как поражение размером 1 см или больше [24]. Кроме того, критерии содержат рекомендации по количеству мишеней, применению кортикостероидов и вопросам, связанным с псевдопрогрессированием при радиохирургии и иммунотерапии [24]. Как и в случае RANO-HGG, эти критерии предназначены в первую очередь для определения ответа пациентов, включенных в клинические испытания, но могут применяться и к пациентам, получающим рутинную клиническую помощь (табл. 5).
Целью локальной терапии, в частности хирургии и лучевой терапии (радиохирургии и облучения всего головного мозга при его метастатическом поражении), является задержка внутричерепного прогрессирования и улучшение местного контроля заболевания. Рабочая группа RANO-БМ Chukwueke&Wen, при рассмотрении клинических испытаний, в которых исследуются локальные подходы к лечению МГМ, предлагают различные конечные точки и рекомендации по определению конечных точек в зависимости от планируемого вмешательства, дизайна и фазы исследования [26]. Ранние фазы исследований, вероятно, направлены на улучшение контроля интракраниальных очагов, в то время как более поздние фазы могут отдавать приоритет токсичности, функциональным и отчетным исходам пациентов (PROs) [26]. Использование передовых методов визуализации также рекомендуется RANO-BM, особенно при оценке рентгенологических изменений, которые могут отражать эффект лечения, вызывая псевдопрогрессирование. Предложены методы МР-перфузии, МР-спектроскопии и позитронно-эмиссионной томографии (ПЭТ) [26].
Стремясь стандартизировать и улучшить клинические испытания, в которых исследуются современные таргетные препараты для пациентов с МГМ, RANO-BM предлагает следующее: стратегию определения потенциальной активности при поражении ЦНС рассматриваемого препарата, понимание потенциальной реакции заболевания как интра-, так и экстракраниально, потенциал профилактики МГМ у пациентов с высоким риском заболевания и, наконец, соответствующие конечные точки [26]. Поскольку ожидается, что заболеваемость пациентов, живущих с контролируемыми системными злокачественными опухолями, будет расти, стратегии контроля или профилактики БМ станут все более важными.
Критерии RANO для лептоменингеального метастазирования
Лептоменингеальное распространение солидных опухолей – опасное и позднее осложнение развивающей солидной опухоли с поражением ЦНС, наиболее часто встречающееся при раке молочной железы и раке легких, а также при гематологических злокачественных новообразованиях [25]. Первичные опухоли головного мозга могут также распространяться в спинномозговую жидкость (ликвор) или по мягким мозговым оболочкам, особенно медуллобластома. На сегодняшний день выявлено малоэффективных системных методов лечения, и рекомендации по ведению пациентов часто включают лучевую терапию, введение химиотерапии в ликвор или системную терапию.
Рабочая группа RANO-LM недавно предложила критерии количественной оценки данного патологического состояния и инструкции по определению ответа на лечение и прогрессирования [25]. Эти критерии включают неврологическую шкалу, такую как NANO [26] вместе с нейровизуализацией (мозг и позвоночник) и цитологией ликвора, которая производится при каждой оценке. Хотя эти критерии включают компоненты, которые вносят важный вклад в рутинную клиническую оценку пациентов с лептоменингиальным распространением рака, они еще не подтверждены достаточным количеством независимых исследований [26, 27, 28]. На данный момент сложность шкалы RANO-LM, вероятно, ограничивает ее полезность для рутинной клинической помощи за пределами клинических испытаний.
Критерии RANO для иммунотерапии – iRANO
Наблюдается все более широкое использование иммунотерапии в лечении солидных опухолей, а также быстро растущее число одобрений FDA США [29]. Иммунотерапия, включающая вакцины, онколитические вирусы и программируемую смерть (PD), лиганд программируемой смерти 1 (PD-L1) и цитотоксические антитела к Т-лимфоцитам 4 (CTLA-4), исследуется при первичных и метастатических опухолях головного мозга. Хотя существует значительный энтузиазм по поводу использования этих агентов, понимание рентгенографических изменений, связанных с их использованием, представляет собой проблему [29, 30]. Исходя из опыта солидной опухолевой онкологии, особенно меланомы, истинному рентгенологическому ответу иногда предшествует преходящее ухудшение.
Рабочая группа RANO по иммунотерапии (iRANO) стремилась разработать инструкции для определения ответа с целью предотвращения преждевременного решения о неэффективности иммунотерапии. Эти критерии аналогичны установленным RANO-HGG, LGG и МГМ: используются понятия полного ответа, частичного ответа, стабильного заболевания и прогрессирования болезни в качестве конечных заключений. Особенность ведения пациентов с опухолями ЦНС на фоне иммунотерапии, по мнению экспертов iRANO, заключается в том, что в течение первых 6 месяцев лечения иммунотерапией, если результаты сканирования хуже, но пациент при этом клинически стабилен, он может оставаться на лечении и внимательно наблюдаться с помощью регулярных МРТ в течение следующих 3 месяцев. Только если последующее сканирование подтвердит прогрессирование заболевания, они должны быть исключены из исследования. Эти рекомендации потребуют подтверждения. Тем не менее они дают полезные советы по ведению пациентов, получающих иммунотерапию, не только в ходе клинических испытаний, но и при получении рутинной клинической помощи [29].
Оценка неврологического статуса в нейроонкологии
Хотя критерии Macdonald и RANO включают клинический статус в определение прогрессирования, нет никакой количественной меры, чтобы определить это. Для устранения этого ограничения и количественной оценки клинических исходов была создана неврологическая оценка в нейроонкологии (NANO) [28]. Рабочая группа NANO разработала специальную шкалу клинической оценки заболевания, использующую части рутинного неврологического обследования для измерения неврологической функции в нескольких областях. В соответствии с этой шкалой обученный медицинский работник может протестировать пациентов в следующих областях: походка, сила, ощущения, поле зрения, сила мышц лица, языка, атаксия верхних конечностей, причем баллы в каждой области варьируются от 0 до 3 или от 0 до 2 [28]. Шкала NANO была включена в клинические испытания и показала свою высокую воспроизводимость и надежность. Несмотря на то что шкала NANO не предназначена для замены существующих стандартных неврологических оценок в клинике, это объективный и простой инструмент, который может быть интегрирован в клинические испытания для пациентов с нейроонкологией, тем самым потенциально обеспечивая более объективную оценку клинического статуса для определения прогрессирования заболевания. Конечная роль NANO будет зависеть от продолжающихся усилий по валидации этого инструмента в клинических исследованиях.
RANO-кортикостероиды
Кортикостероиды в различных дозах являются неотъемлемой частью клинического ведения пациентов с опухолями ЦНС на различных этапах лечения, обеспечивая контроль симптомов и сохранение функции. Побочные эффекты, связанные с длительным применением кортикостероидов, хорошо изучены и имеют далеко идущие последствия. Также было высказано предположение, согласно которому пациенты, нуждающиеся в стероидах в течение более длительных периодов времени или в более высоких дозах, имеют более короткую общую выживаемость. Кроме того, использование стероидов наряду с возрастом и состоянием работоспособности связано с более плохим прогнозом [30]. Известно, что такие лекарственные средства, как бевацизумаб, помогают снизить потребность в стероидах и избежать связанных с ними побочных эффектов; исторически в клинических исследованиях использовали дозу стероидов (или время до начала приема стероидов) в качестве вторичных конечных точек [30]. Предыдущие попытки исследовать альтернативные агенты для стероидсберегающих свойств были многообещающими, в частности агент кортикорелин, изученный в фазе I на педиатрических пациентах при лечении перитуморального отека. Ранние результаты включали улучшение показателей снижения дозы стероидов и качества жизни, однако дальнейшие исследования спонсорами исследования не проводились [30].
Была создана рабочая группа по разработке консенсусных критериев оценки терапевтического ответа при назначении кортикостероидов, что обусловлено необходимостью выработки последовательных инструкций принципов при определении соответствующих клинических и рентгенологических конечных точек, особенно с учетом влияния стероидов на заболевание. С этой целью были предложены критерии ответа на кортикостероиды как для взрослых, так и для педиатрических пациентов [30].
RANO-ПЭТ/КТ
МРТ является стандартным методом визуализации для оценки анатомии опухоли и ответа на лечение при опухолевом поражении головного и/или спинного мозга. Хотя дальнейшее использование контрастной визуализации для оценки ответа на лечение имеет свои преимущества, остается множество подводных камней, особенно в связи с появлением антиангио-генной терапии и иммунной блокады контрольных точек, что затрудняет интерпретацию изображений. Хотя это является обоснованием для создания рабочих групп RANO, включая iRANO, существует также стимул для изучения альтернативных, продвинутых методов визуализации, а именно – позитронно-эмиссионной томографии (ПЭТ), обычно совмещенной со спиральной компьютерной томографией – ПЭТ/КТ [31].
ПЭТ/КТ с различными радиофармпрепаратами-трэйсерами служит важным дополнением к анатомическим данным других методов исследования как при оценке распространенности диссеминированных форм солидных опухолей, так и в нейроонкологии для оценки метаболической активности интракраниальных опухолевых процессов [32]. Наиболее распространенная ПЭТ/КТ – с 18F ФДГ (фтордезоксиглюкоза) – применяется (в случае доступности) в отношении пациентов с солидными опухолями (например, НМКРЛ, МКРЛ, РМЖ, меланома и пр.) для поиска удаленных опухолевых очагов во всем теле. При сканировании головного мозга также могут быть выявлены метастатические очаги. В целом же в силу метаболических особенностей самого головного мозга, который очень активно метаболизирует глюкозу, для адекватного исследования при ПЭТ/КТ необходимо использовать другие трэйсер-аминокислоты (С11-метионин, 18-фторэтил тирозин, 18-фторфениланин или 18F ДОФА). Проводятся клинические исследования по дополнению данных МРТ в стандартных режимах данными ПЭТ/КТ с метионином или тирозином [33]. Для выработки рекомендаций по применению и интерпретации данных ПЭТ/КТ в нейроонкологии (оценка эффективности и т.п.) была создана рабочая группа RANO-PET.
C момента первой редакции рекомендаций по применению ПЭТ/КТ в нейроонкологии в 2010 г. от EANM (European Association of Nuclear Medicine, Европейская Ассоциация Ядерной Медицины) доступность применения ПЭТ/КТ в отношении больных с опухолями ЦНС значительно возросла как в Европе, так и в США, и в России. Позже была создана объединенная рабочая группа EANM/EANO (European Association of Neuro-Oncology)/RANO/ПЭТ, целью работы которой стало обеспечение четких инструкций по техническим параметрам, показаниям к применению и интерпретации полученных результатов ПЖТ/КТ в нейроонкологии с ясным пониманием возможностей и ограничений и в конечном итоге – четких алгоритмов для данного метода обследования [33]. Последняя редакция этих рекомендаций RANO/ПЭТ группы опубликована в 2019 г. В 2017 г. также были опубликованы рекомендации по использованию ПЭТ/КТ с трейсерами-аминокислотами в отношении пациентов с менингиомой.
Итак, ПЭТ/КТ в последние годы стали важным обследованием в нейроонкологии, целью которого является как первичная диагностика и дифференциальная диагностика опухолей головного и спинного мозга, применение для планирования хирургии (включая сетереотаксическую биопсию), лучевой терапии, так и оценка эффективности проводимой лекарственной противоопухолевой терапии, дифференциальный диагноз между прогрессированием болезни и лучевым реакциями после радиотерапии/радиохирургии. Стандратизация этого технически сложного метода обследования позволяет включать его в качестве одного из основных методов оценки динамики опухоли в клинические исследования. Не менее важно применение этих инструкций для ПЭТ/КТ в рутинной нейроонкологической практике [32, 33].
RANO в педиатрической нейроонкологии
В соответствии с целями RANO группа по оценке ответа на противоопухолевое лечение в педиатрической нейроонкологии (RAPNO) была создана для изучения способов оценки эффективности лечения с учетом специфики детской нейроонкологии. Хотя есть много общего в критериях эффективности лечения в нейроонкологии у взрослых и детей, существуют отдельные проблемы, уникальные для детской нейроонкологии, которые требуют различного рассмотрения в связи с оценкой реакции на заболевание [34]. В настоящее время не существует стандартных рекомендаций по оценке ответа на лечение опухолей головного мозга у детей, и на сегодняшний день основой для оценки являются рекомендации для взрослых [35]. RAPNO было поручено определить соответствующие консенсусные критерии для оценки ответа на лечение нескольких гетерогенных типов опухолей, каждая из которых представляет собой отдельное заболевание с различными особенностями визуализации [36].
В рамках RAPNO разрабатываются специфические рекомендации по установлению критериев оценки лечения при высокодифференцированной глиоме, глиоме зрительного пути, диффузной глиоме средней линии и лептоменингеальной болезни, а также недавние рекомендации по медуллобластоме и аналогичным опухолям со склонностью к диссеминации CSF.
В настоящее время не существует единых критериев определения ответа в клинических испытаниях как у взрослых, так и у детей с этим заболеванием. RAPNO выдвинул первоначальные рекомендации по критериям ответа, основанных на методах, включивших МРТ ЦНС, цитологию ликвора и неврологическое обследование. Рассматривались и другие дополнительные критерии, такие как наличие экстра-ЦНС метастатических очагов и факторы качества жизни, однако конкретных рекомендаций по включению в критерии RAPNO до сих пор не было [39]. Это предложение RANO и RAPNO потребует перспективных подтверждений в клинических исследованиях.
Резюме:
- Общие принципы оценки эффективности противоопухолевого лечения в онкологии. Критерии RECIST: на основании различных инструментальных методов оценки опухолевых очагов в общей онкологии для оценки динамики опухоли используют стандартные критерии оценки солидных опухолей RECIST в редакции 2009 г. (RECIST 1.1). Данные критерии используются при компьютерной и магнитно-резонансной томографии, в некоторых случаях – при традиционной рентгенографии.
- В нейроонкологии в клинических исследованиях и в повседневной клинической практике следует использовать «критерии ответа опухоли на лечение» RANO, а не RECIST и не критерии Macdonald в силу специфики анатомии и биологического поведения опухолей ЦНС, а также особенностей нейровизуалиазции на фоне противоопухолевой лекарственной терапии и современных методов лучевой терапии.
- Построенная на опыте применения критериев оценки ответа на лечение для солидные опухоли (RECIST) и критериев Макдональда, RANO-HGG включает в число параметров для оценки МРТ в режимах Т1 с контрастным усилением и T2FLAIR, использование кортикостероидов, а также динамику клинического статуса; определяет понятие «псевдопрогрессирование» и «псевдоответ на лечение», которые стали актуальными в эпоху современных методов лучевой терапии и антиангиогенных и других препаратов, нарушающих проницаемость сосудов.
- Критерии RANO для глиом низкой степени злокачественности: МР-семиотика cходна с другими процессами, такими как демиелинизация или ишемия; кроме того, медленный характер роста, характерный для этих опухолей, часто затрудняет оценку реакции заболевания, поэтому было введено понятие «малый ответ на лечение» (уменьшение размеров измеряемых очагов на 25–50%).
- Критерии RANO для метастатического поражения ЦНС (метастазов в головной мозг, МГМ) и критерии RANO для лептоменингеального метастазирования: целью RANO-BM является определение активности потенциальных агентов в отношении МГМ и определение соответствующих конечных точек для клинических испытаний; важно, что эти критерии нужны для более точной оценки событий с интракраниальными очагами, чем в системе RECIST, согласно которой диаметры внутримозговых опухолевых очагов должны суммироваться с диаметрами как основной опухоли, так и отдаленных метастатических очагов.
- Критерии RANO для иммунотерапии – iRANO: их разработка была обусловлена специфиескими реакциями на иммунотерапию – нара-стание зоны отека в головном мозге на фоне начавшейся иммунотерапии; данная система оценок позволяет последовательно и логично отдифференцировать ответ опухоли на лечение от прогрессирования опухоли; лептоменингеальное распространение – опасное и позднее осложнение диссеминированного онкологического процесса с поражением ЦНС, наиболее часто встречающееся при раке молочной железы и раке легких, а также при гематологических злокачественных новообразованиях.
- Оценка неврологического статуса в нейроонкологии: хотя критерии Macdonald и RANO включают клинический статус в определение прогрессирования, нет никакой количественной меры, чтобы определить это. Для устранения этого ограничения и количественной оценки клинических исходов была создана неврологическая оценка в нейроонкологии (NANO).
- RANO-кортикостероиды: кортикостероиды в различных дозах являются неотъемлемой частью клинического ведения пациентов с опухолями ЦНС на различных этапах лечения; однако было высказано предположение, согласно которому пациенты, нуждающиеся в стероидах в течение более длительных периодов времени или в более высоких дозах, имеют более короткую общую выживаемость. Кроме того, использование стероидов наряду с возрастом и состоянием работоспособности было связано с более плохим прогнозом.
- RANO-ПЭТ/КТ: последняя редакция этих рекомендаций RANO/ПЭТ-группы опубликована в 2019 г.
В 2017 г. также были опубликованы рекомендации по использованию ПЭТ/КТ с трейсерами-аминокислотами у пациентов с менингиомой, целью работы которой стало обес-печение четких инструкций по техническим параметрам, показаниям к применению и интерпретации полученных результатов ПЖТ/КТ в нейроонкологии с ясным пониманием возможностей и ограничений и в конечном итоге – четких алгоритмов для данного метода обследования.



