Введение
Системная терапия сарком мягких тканей в настоящее время представляет нерешенную проблему. Высокое разнообразие гистологических подтипов, различные генетические особенности опухолей и редкость данной группы заболеваний затрудняют внедрение новых методов терапии в реальную клиническую практику. Для решения этой задачи необходима оценка опыта системной лекарственной терапии в реальной клинической практике и определение важных факторов, оказывающих влияние на результаты лечения.
Цель исследования: оценка десятилетнего опыта терапии больных саркомами мягких тканей в НМИЦ онкологии им. Н.Н. Петрова (исследование РЕПРИЗА).
Методы
В исследование были включены больные саркомами мягких тканей, получавшие терапию в НМИЦ онкологии им. Н.Н. Петрова с 2008 по 2018 г. с использованием химиотерапии (доксорубицин, эпирубицин, ифосфамид, дакарбазин, доцетаксел, гемцитабин, циклофосфамид, метотрексат в монотерапии или комбинациях) или с применением разработанных аутологичных дендритно-клеточных вакцин (ДКВ) собственного производства. Данные больные принимали участие в одной из научно-исследовательских работ, проводимых в нашем центре. В исследовании РЕПРИЗА была проанализирована эффективность лекарственной терапии данных пациентов, проводимой на любом ее этапе в качестве основного метода лечения заболевания.
Критерии включения в исследование: получение информированного согласия на лечение, возраст более 18 лет, наличие полной информации об этапе лечения и методах терапии, использованных на каждом изучаемом этапе лечения.
В данном исследовании допускалось повторное включение пациентов, получавших разные виды лечения (одно включение на каждый из этапов лечения). В анализ вошли все этапы лечения пациентов, проведенных до, во время и после участия в НИР. Бóльшая часть этих этапов проводилась в условиях реальной клинической практики в региональных онкологических учреждениях. Характеристика больных, включенных в исследование, представлена в табл. 1.
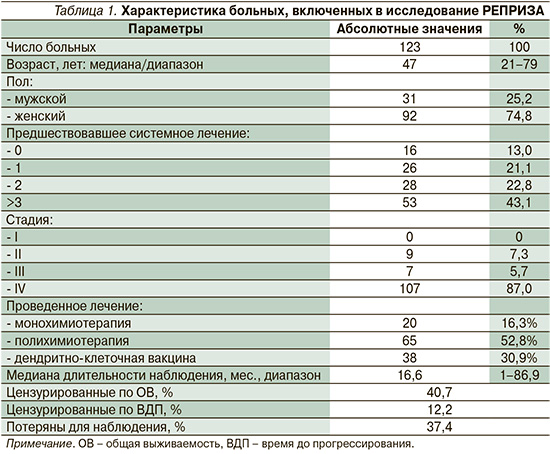
В ходе исследования проведен анализ объективного ответа (ОО) по системе RECIST 1.1, ВДП и ОВ от начала соответствующего лечения. Эффективность терапии переоценивалась на основе имеющихся медицинских данных в НМИЦ онкологии им. Н.Н. Петрова. Использовались методы Каплана–Майера для получения медиан ВДП и ОВ и их доверительных интервалов. Для сравнения методов лечения и определения важных прогностических параметров использовался метод пропорциональных рисков Кокса. Для всех переменных применен метод условного включения. Для проведения анализа все переменные были разделены на три блока. В первый включались переменные с известным прогностическим значением, такие как стадия TNM, характер опухоли (лейомиосаркома и липосаркома против прочих видов сарком мягких тканей). Во второй блок включены переменные, которые могут иметь предиктивное и прогностическое значения: пол, возраст, наличие первично-множественной опухоли и характеристики предшествовавшего лечения. К последним относили число этапов лечения, число линий системного лекарственного лечения, число этапов по видам лечения (химиотерапия, иммунотерапия, гормонотерапия, хирургическое лечение) и по характеру их иммунологического действия (методы без выраженного иммунологического действия – хирургические вмешательства, методы с выраженной иммуносупрессией – высокотоксичная полихимиотерапия [ПХТ], методы с потенциальным иммуномодулирующим действием – монохимиотерапия и методы усиления презентации антигена – дендритноклеточные вакцины). В третий блок включался только метод проведенного лечения. Поскольку многие из анализируемых переменных были взаимосвязаны (например, общая стадия и характеристики подстадий T, N и M), для выбора оптимального кодирования оценивалась дополнительная польза от включения более детальных характеристик по отношению к более общим. Для параметров, отражающих предшествовавшее лечение, учитывалась только качественная (было или нет) характеристика.
Расчеты осуществлялись с использованием программы SPSS методами Каплана–Мейера и Кокса. В прогностические модели Кокса переменные добавлялись при р<0,05, исключались из модели р>0,1.
Результаты
Была проведена оценка эффективности лекарственной терапии больных саркомами мягких тканей, получавших лечение с 2008 по 2018 г. Показатели ОВ и ВДП больных саркомами мягких тканей представлены в табл. 2, кривые выживаемости – на рис. 1–2.
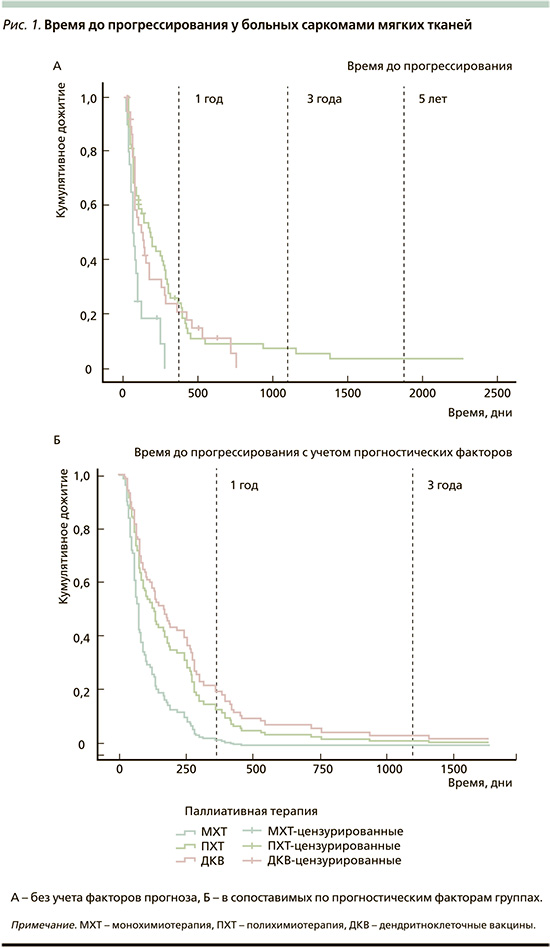
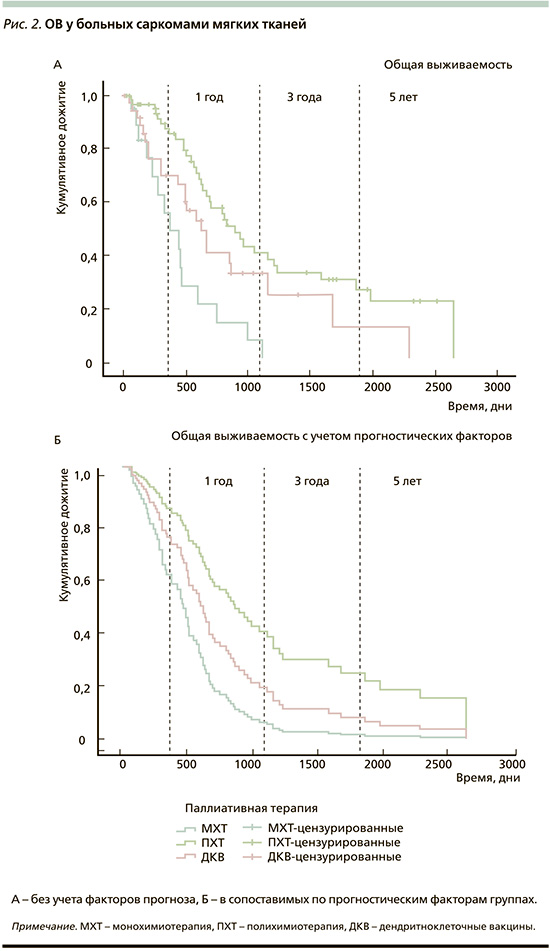
Как видно из представленных данных, при оценке эффективности методов лечения в целом ПХТ оказалась наиболее эффективной опцией как по частоте объективного ответа, так и по показателям ОВ и ВДП. Терапия ДКВ при этом, несмотря на низкую частоту ОО, обладала сопоставимыми показателями выживаемости.
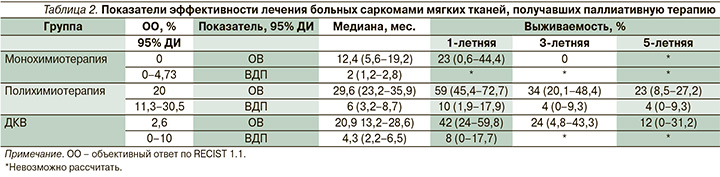
При построении модели пропорциональных рисков Кокса стадия являлась независимым фактором прогноза ОВ (р=0,035), но не ВДП, где она не позволяла улучшить прогнозирование прогрессирования процесса. Для ВДП важным фактором оказались проведение монохимиотерапии или малотоксичных комбинированных режимов химиотерапии в анамнезе (например, метрономной терапии циклофосфамидом и метотрексатом), либо вакцинотерапии – т.е. методов с возможными иммуномодулирующими свойствами, и проведение комплексного лечения. Относительный риск (ОР) прогрессирования увеличился на 82,9% (95% доверительный интервал [ДИ]: 26–265%) на каждый дополнительный этап малотоксичного лечения. ОР смерти при этом возрос на 93,8% (95% ДИ: 29,1–191%; р=0,01). Комплексное лечение снижало вероятность прогрессирования процесса (ОР=0,519 для каждого дополнительного метода лечения; 95% ДИ: 0,388–0,694). При анализе ОВ проведенное ранее малотоксичное лечение увеличивало риск смерти пациентов (ОР=1,938; р=0,01).
Противоопухолевая лекарственная терапия cтала важным фактором, определяющим ОВ и ВДП (р=0,02 и р=0,13 соответственно). При этом ПХТ в многофакторном анализе обладала наибольшим эффектом по сравнению с монохимиотерапией: ОР для ВДП составил 0,33 (95% ДИ: 0,173–0,631; р=0,001), для ОВ ОР=0,51 (95% ДИ: 0,29–0,896; р=0,01). Применение ДКВ также приводило к снижению риска прогрессирования (ОР=0,406, 95% ДИ: 0,22–0,742), что, однако, не трансформировалось в статистически значимые преимущества в ОВ (ОР=0,592, 95% ДИ: 0,3–1,169).
При анализе в модели учитывались также количество линий системной терапии, пол, возраст, первично-множественный характер опухоли. Лишь последняя переменная влияла на ОР прогрессирования процесса (р=0,046), однако не позволяла увеличивать прогностическую значимость модели при учете других факторов.
Обсуждение
При сопоставлении полученных в нашем исследовании результатов с литературными данными следует в первую очередь обратить внимание на характер включенных в исследование пациентов: 13% из них ранее не получали системного лечения.
В этой группе пациентов комбинированная химиотерапия оказалась наиболее эффективным подходом к лечению. В мета-анализе рандомизированных исследований A. Comandone et al. [1] изучали эффективность второй и последующих линий терапии сарком мягких тканей. Данный мета-анализ показал, что применение комбинированного лечения имеет преимущества по ОВ и ВДП, при этом ОР смерти составлял 0,81, ОР прогрессирования – 0,51. Похожие результаты, но с меньшим размером эффекта были получены в более позднем исследовании [2]. Эти результаты не отличаются от полученных в нашем исследовании показателей. Абсолютное увеличение ВДП в нашем исследовании было аналогично результатам указанных мета-анализов, однако в отношении ОВ наше исследование показало бóльшую амплитуду эффекта комбинированной терапии. Интересно отметить, что подобный феномен больших преимуществ по ОВ, чем по ВДП, отмечен в ряде исследований, обобщенных в недавнем мета-анализе [3]. При изучении исследований в первой линии лекарственного лечения заметно улучшение ОВ, но не ВДП при проведении сравнительных исследований, в которых роль контрольной группы играла монотерапия доксорубицином [4]. На основании двух вышеуказанных обзоров можно предполагать зависимость эффекта от линии системной терапии, однако в нашем исследовании этот показатель оказался статистически незначимым.
Построенные многофакторные модели свидетельствовали об отсутствии влияния ПХТ на эффективность последующего лечения, тогда как проведение менее интенсивных режимов оказывало негативный эффект. Причиной такого явления может быть как низкая эффективность монотерапии или метрономных режимов лечения, как правило, используемых в последующих линиях лекарственного лечения, так и определенная селекция опухолевых и иммунных клеточных клонов, более выраженная при использовании менее интенсивных воздействий. Важно подчеркнуть, что схемы с высокой гематологической токсичностью не обладали негативным влиянием на показатели ОВ и ВДП.
Нами также не выявлено значительного вклада гистологического типа опухоли (лей- или липосарком против других типов) в прогнозирование ОВ или ВДП. В мета-анализе R.J. Young et al. [5] показана тенденция к улучшению ответа на лечение больных этой категории. Однако незначительный размер эффекта мог затруднить его обнаружение в представленном исследовании, принимая во внимание малое число больных.
Вместе с тем наше исследование показало значительный вклад и положительное прогностическое значение применения ДКВ в лечении больных саркомами мягких тканей. В литературе нам встретились лишь отдельные упоминания о ранних исследованиях вакцин [6, 7], не позволяющие сравнивать их с результатами нашего исследования. Тем не менее в указанных работах также отмечены незначительная частота ОО и отдельные случаи длительно сохраняющихся эффектов, что служит характерной чертой иммунотерапии. В нашем исследовании РЕПРИЗА мы также наблюдали длительный достигнутый эффект и отсроченный эффект от проведения лечения ДКВ, что позволяет говорить о воспроизводимости указанных наблюдений.
Заключение
Лекарственная терапия сарком, так же как и стадия заболевания, является важным фактором, определяющим ОВ больных. Иммунологические подходы обладают сопоставимой с химиотерапией эффективностью, но меньшей токсичностью и требуют дальнейшего изучения в качестве компонента комплексного лечения больных этой категории.



