По данным эпидемиологических исследований, ХОБЛ страдают 4–15% взрослого населения развитых стран [1–4], а ежегодное число умерших превышает 3 млн [5]. Кроме всего прочего, ХОБЛ – лидер по величине расходов на ведение больных среди всех заболеваний органов дыхания. Например, в США ежегодные расходы здравоохранения на лечение больных ХОБЛ и бронхиальной астмой (БА), согласно отчету 2012 г., превысили 75 млрд долл. [6] и данные заболевания находятся на 5-м месте по величине затрат, уступая лишь сердечно-сосудистым заболеваниям, травмам, неопластическим процессам и психическим расстройствам.
Обострение служит важнейшим критерием, отражающим темпы прогрессирования заболевания, риск летального исхода, качество жизни больных и, что немаловажно, забирает значительную долю общих расходов. Известно, что практически в половине случаев требуется стационарное лечение и, согласно уже цитируемому отчету за 2012 г., в США именно на госпитализированных пациентов с обострением ХОБЛ было потрачено более 40 млрд долл. [6]. При этом следует признать, что назначение антибиотиков при обострении ХОБЛ является непростой задачей и, по данным ряда исследований, нередки случаи нерациональной терапии [7].
Под обострением ХОБЛ понимают ухудшение состояния пациента, возникающее остро, сопровождающееся усилением кашля, увеличением объема отделяемой мокроты и/или изменением ее цвета, появлением/нарастанием одышки, которое выходит за рамки ежедневных колебаний и служит основанием для модификации терапии [1–2].
Ключевые вопросы при ведении больного с обострением ХОБЛ:
- необходимость назначения антимикробной терапии;
- выбор наиболее эффективного препарата с учетом клинической ситуации;
- оптимальная длительность применения антибиотика.
Отвечая на первый вопрос, стоит упомянуть о ряде клинических исследований, доказавших преимущество назначения антибиотиков при обострении хронического бронхита (ХБ)/ХОБЛ по сравнению с плацебо [8–12]. Наиболее цитируемо исследование N. Anthonisen и соавт. [8], определившее классические признаки, которыми можно охарактеризовать обострение заболевания: появление или усиление одышки; увеличение объема отделяемой мокроты и усиление гнойности мокроты. Наличие всех трех вышеуказанных критериев описывается как I тип, двух из них – как II, одного – как III тип обострения заболевания. Оказалось, что антибиотики продемонстрировали свое преимущество перед плацебо для больных с обострением ХБ I и II типов, тогда как у пациентов с III типом обострения пользы от их применения не наблюдалось.
В последующих работах польза от антимикробной терапии была подтверждена и отмечено снижение летальности [11–12] при ее применении по сравнению с плацебо.
Таким образом, назначение антибактериальных препаратов оправданно для пациентов с I типом обострения ХОБЛ, т.к. в данном случае наиболее вероятна инфекционная природа обострения. Кроме того, показаниями к назначению антимикробной терапии служат II тип обострения ХОБЛ (при наличии гнойной мокроты), а также тяжелое обострение (т.е. сопровождаемое признаками острой дыхательной недостаточности).
Помимо клинических критериев инфекционного обострения ХОБЛ существуют возможности внедрения в практику ряда лабораторных исследований для уточнения необходимости назначения антибактериальной терапии. Так, в настоящее время усилия исследователей направлены на изучение возможностей определения биологических маркеров воспалительного ответа в крови больного ХОБЛ при обострении. Стоит заметить, что большинство работ было направлено на дифференциальную диагностику пневмонии и обострения ХОБЛ. Так, в одной из публикаций пороговое значение С-реактивного белка (СРБ), разделившее больных внебольничной пневмонией (ВП) и пациентов с обострением ХОБЛ, составило 33 мг/л (чувствительность – 83%, специфичность – 44%) [13]. У больных с обострением ХОБЛ, бронхиальной астмой значение СРБ>8 мг/л обладало чувствительностью 91% (95% доверительный интервал [ДИ] – 80–97%) и специфичностью 93% (95% ДИ – 86–98%) для выявления больных пневмонией [14]. В отечественном исследовании показано, что при диагностике ВП у больных ХОБЛ пороговое значение СРБ составляет ≥51,5 мг/л [15]. В настоящее время возможности СРБ в определении необходимости антимикробной терапии при обострении ХОБЛ требуют дальнейших исследований, но стоит упомянуть, что в госпитальной клинической практике антибиотики назначаются, как правило, при уровне СРБ=15–20 мг/л [16].
Значительно больше работ посвящено перспективам использования прокальцитонина (ПКТ) для оптимизации назначения антибактериальной терапии [17]. В ряде исследований показано, что назначение антибактериальных препаратов при инфекциях дыхательных путей в случае уровня ПКТ<0,1 нг/мл нецелесообразно, тогда как при значении ПКТ>0,25 нг/мл вероятность принятия правильного решения о начале антибактериальной терапии составляет 83% [18]. W. Long и соавт. (2011) доказали, что в группе ПКТ-контролируемой терапии антибиотики назначались на 13,1% реже и длительность антибактериальной терапии снижалась с 7 до 5 суток [19]. В исследовании ProHOSP [20], посвященном ведению пациентов с инфекциями нижних дыхательных путей (ИНДП), показано отсутствие различий в частоте неблагоприятных исходов в группах ПКТ-контролируемой (15,8%) и стандартной терапии (18,3%). Средняя длительность антибактериальной терапии в группе ПКТ оказалась ниже как у всех пациентов (5,7 против 8,7 суток), так и в группах ВП, обострения ХОБЛ и острого бронхита. Кроме того, в группе ПКТ-контролируемой терапии антибиотико-ассоциированные побочные эффекты отмечены реже, чем в группе с использованием стандартного лечения (19,8 против 28,1%). Результаты многоцентрового европейского исследования ProREAL также демонстрируют, что использование ПКТ при лечении ИНДП эффективно снижает использование антибиотиков без увеличения риска развития осложнений [21]. В мета-анализе исследований ПКТ с 1996 по 2010 г. показано значительное сокращение частоты назначений антибактериальных препаратов и продолжительности применения антибиотиков в группах ПКТ-контролируемой терапии по сравнению со стандартной терапией. Кроме того, использование ПКТ-контролируемой антибактериальной терапии не влияло на летальность, госпитализацию в отделение реанимации и интенсивной терапии, а также на длительность госпитализации [22].
Таким образом, внедрение определения СРБ и ПКТ при обострении ХОБЛ в клиническую практику является перспективным направлением [17], но необходимы дальнейшие исследования по определению их пороговых значений, достоверно ассоциированных с инфекционным процессом, требующим назначения антимикробной терапии.
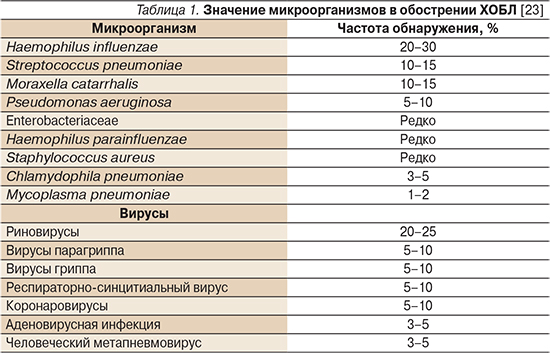
Следующим вопросом является рациональный выбор антибактериального препарата. Для правильного выбора антибиотика необходимо, во-первых, обладать знаниями о наиболее актуальных инфекционных агентах, вызывающих обострение заболевания. Среди них доминирующее значение имеют бактериальные возбудители – Haemophilus influenzae, Streptococcus pneumoniae, Moraxella catarrhalis [1–2, 23]. Реже в образцах мокроты пациентов с обострением ХБ/ХОБЛ выделяют Haemophilus parainfluenzae, Staphylococcus aureus, Pseudomonas aeruginosa и представителей семейства Enterobacteriaceae. Частота обнаружения Mycoplasma и Chlamydophila pneumoniae у больных, перенесших обострение ХБ/ХОБЛ, составляет, по данным исследований, порядка 5% [24]. В 30% случаев обострение ХОБЛ ассоциировано с вирусной инфекцией (вирусы гриппа, коронаровирусы, риновирусы и пр.; табл. 1) [25].

Во-вторых, необходимо оценить вероятность этиологической роли того или иного микроорганизма в развитии обострения ХОБЛ в определенной клинической ситуации. Так, согласно результатам исследований, известно, что степень тяжести заболевания может корреспондировать с типом возбудителя [26]. У пациентов с ХОБЛ легкого, среднетяжелого течений обострение чаще всего обусловлено S. pneumoniae, по мере прогрессирования болезни (снижение объема форсированного выдоха за 1-ю секунду – ОФВ1, частые обострения) значительно чаще выявляют H. influenzae, M. catarrhalis и Enterobacteriaceae. В более тяжелых случаях нередко обнаруживают P. aeruginosa. К факторам риска синегнойной инфекции относятся выраженная бронхиальная обструкция (ОФВ1<30%); бронхоэктатическая болезнь; хроническое гнойное отделяемое; предшествующее выделение P. aeruginosa из мокроты; частое применение антибиотиков (≥4 курсов в течение года) [2]. Также принципиально важно выделять факторы, ассоциированные с риском встречи с резистентными штаммами микроорганизмов.
К таковым относятся возраст ≥65 лет, сопутствующие сердечно-сосудистые заболевания, частые обострения (≥2 в год) – табл. 2.
Как мы видим, частота обострений – чрезвычайно важный фактор, оказывающий влияние на выбор антимикробного препарата. И, как оказалось, антибиотики помимо действия на клинические симптомы обострения ХОБЛ и летальность оказывают влияние на длительность периода между обострениями. В клинических исследованиях показано, что применение антибиотиков, характеризующихся максимальным потенциалом эрадикации, способно не только оптимизировать клинический исход заболевания, но и увеличить длительность безинфекционного периода [27]. Понимание данного тезиса базируется на результатах известного мета-анализа, выполненного I. Siempos и соавт. (2007), в ходе которого проводилась сравнительная оценка эффективности и безопасности использования макролидов, «респираторных» фторхинолонов и амоксициллина/клавуланата в терапии обострения ХОБЛ [28]. В результате мета-анализа все перечисленные антибиотики продемонстрировали сравнимую клиническую эффективность. При этом отмечено, что использование «респираторных» фторхинолонов характеризовалось более высокой микробиологической эффективностью и меньшей частотой рецидивов заболевания по сравнению с макролидами, тогда как прием амоксициллина/клавуланата сопровождался наиболее высокой частотой развития побочных эффектов по сравнению с другими препаратами. В последующих исследованиях было продемонстрировано, что использование респираторных фторхинолонов характеризуется наибольшим влиянием на длительность безрецидивного периода, в связи с чем их применение наиболее целесообразно для пациентов с факторами риска (возраст ≥65 лет, сопутствующие сердечно-сосудистые заболевания, частые обострения ≥2 в год), а также для больных ХОБЛ тяжелого течения.
Таким образом, в настоящее время предлагается следующий подход [1–2, 29] к назначению антибиотиков больным, перенесшим инфекционное обострение ХОБЛ. Антибиотиками выбора для пациентов с легким и среднетяжелым обострением ХОБЛ без факторов риска (<2 обострений заболевания в течение года, возраст до 65 лет, отсутствие сердечно-сосудистых заболеваний, умеренные нарушения бронхиальной проходимости – ОФВ1≥50% от должных значений) служат амоксициллин, «современные» макролиды (азитромицин, кларитромицин), цефуроксим аксетил, цефиксим.
В отношении цефиксима стоит отметить, что его место в режимах антимикробной терапии ХОБЛ неоднократно обсуждалось экспертным сообществом и изучалось в рамках клинических исследований. Так, в открытом рандомизированном исследовании, включившем 218 амбулаторных пациентов с обострением ХБ, цефиксим продемонстрировал сравнимую клиническую эффективность с амоксициллином/клавуланатом и ципрофлоксацином [30]. Исследование, проведенное российскими авторами, продемонстрировало высокую эффективность (84%) цефиксима при обострении ХОБЛ [31]. В исследовании J. Lorenz и соавт., включившем 222 пациента с обострением ХОБЛ, 5-дневный курс цефиксима по эффективности не уступал 10-дневному курсу терапии [32]. Сходные результаты продемонстрированы также в мета-анализе, целью которого было изучение сравнительной эффективности и безопасности коротких курсов терапии (5 дней) по сравнению со стандартными режимами (7–10 дней) для пациентов с обострением ХБ [23].
В настоящее время применение цефиксима (Панцеф®) в лечении неосложненного обострения ХОБЛ регламентировано на страницах Федеральных клинических рекомендаций [2].
Панцеф® (цефиксим) производства Алкалоид АО (Республика Македония) представляет собой полусинтетический антибиотик группы цефалоспоринов III поколения для приема внутрь с выраженной антибактериальной активностью в отношении большинства грамположительных и грамотрицательных микроорганизмов. Механизм его действия обусловлен угнетением синтеза клеточной мембраны возбудителя. Является устойчивым к β-лактамазам как грамположительных, так и грамотрицательных микроорганизмов. Действующий компонент препарата Панцеф® (цефиксим) высокоактивен в отношении грамположительных бактерий: Streptococcus pyogenes; Streptococcus pneumoniae, грамотрицательных бактерий: Haemophilus parainfluenzae, Proteus vulgaris, Klebsiella pneumoniae, Klebsiella oxytoca, Pasteurella multocida, Providencia spp. Период полувыведения препарата составляет 3–4 часа, биодоступность – 40–50%. Выпускается в форме таблеток, покрытых пленочной оболочкой, назначается перорально в дозе 400 мг 1 раз в сутки независимо от приема пищи.
Напротив, пациентам с факторами риска (возраст ≥65 лет, сопутствующие сердечно-сосудистые заболевания, частые обострения [≥2 в год]), больным тяжелой ХОБЛ рекомендуется применение «респираторных» фторхинолонов (левофлоксацин, моксифлоксацин, гемифлоксацин) или ингибиторозащищенных пенициллинов (амоксициллин/клавуланат) [2, 29]. Присутствие же факторов риска синегнойной инфекции (ОФВ1<30% от должных значений, хроническое отделение гнойной мокроты, наличие бронхоэктазов, предшествующее выделение P. aeruginosa из мокроты) определяет выбор в пользу левофлоксацина в дозе 750 мг/сут или ципрофлоксацина.
Продолжительность антибактериальной терапии различных ИНДП до настоящего времени остается предметом дискуссий. Так, рекомендуемая длительность антибактериальной терапии обострений ХОБЛ, согласно руководству COLD (Chronic Obstructive Lung Disease), составляет 5–10 дней [1].
В данном контексте стоит сказать, что длительность лечения – один из ключевых факторов, определяющих приверженность лекарственной терапии [33], что делает короткие курсы антибиотикотерапии при обострении ХОБЛ наиболее привлекательными в амбулаторной практике, т.к. данный подход позволяет улучшать приверженность больных и, соответственно, повышать эффективность лечения. Уменьшение длительности приема антибиотика закономерно сопровождается снижением частоты побочных эффектов, соответственно, уменьшаются затраты на их купирование (дополнительные консультации врача, назначение лекарственных препаратов и пр.), а также улучшается качество жизни пациента [33].
В настоящее время мы обладаем результатами ряда исследований, показавших эффективность 5-дневных курсов антибиотикотерапии при обострении ХОБЛ [32, 34–35]. А в мета-анализе, включившем 3083 пациента (средний возраст – 58 лет) с обострением ХБ, которым проводилась антибактериальная терапия с использованием хинолонов, кларитромицина и цефиксима, показано, что различий в клинической и микробиологической эффективности коротких и стандартных режимов лечения не отмечено [35]. Однако короткие курсы антимикробной терапии характеризовались меньшим числом побочных эффектов. Таким образом, полученные в анализе данные свидетельствуют, что в отношении пациентов с нетяжелым обострением ХБ/ХОБЛ эффективно могут использоваться 5-дневные курсы антимикробной терапии.


