Обоснование
Сахарный диабет 2 типа (СД2) занимает одно из ведущих мест в структуре сопутствующей патологии у госпитализированных пациентов с коронавирусной инфекцией [1]. Неоднократно показано, что больные СД2 за счет ряда патофизиологических особенностей имеют более тяжелое течение инфекционного процесса с повышением вероятности развития смертельного исхода в 1,9 раза по сравнению с пациентами без диабета [2, 3]. Кроме того, наличие гипергликемии при поступлении в стационар даже у пациентов без СД в анамнезе является прогностически неблагоприятным фактором риска [4]. Поэтому отводится немаловажная роль в своевременной и патогенетически обоснованной интенсификации лечения основного заболевания пациентов с СД2 и COVID-19 с целью предотвращения неблагоприятных исходов, в т.ч. коррекции гипергликемии за счет проводимой сахароснижающей терапии (ССТ).
По данным ряда авторов, терапия метформином способствует снижению частоты развития тяжелого течения и смертельного исхода пациентов с СД2 и коронавирусной инфекцией [5, 6].
В то же время лечение инсулином приводит к увеличению летальности [7, 8]. Большинство исследователей объясняют это тем, что исходно больные СД2, в лечении которых используются препараты инсулина, имеют худший гликемический контроль и более тяжелую коморбидную патологию [9]. В отношении других групп сахароснижающих препаратов (ССП), согласно мета-анализу с включением 61 исследования (3 061 584 человека), показано, что применение агонистов рецептора глюкагоноподобного пептида-1 (арГПП-1), ингибиторов натрий-глюкозного котранспортера 2-го типа (иНГЛТ-2) до поступления в стационар связано со снижением госпитальной смертности среди пациентов с COVID-19, страдающих СД2. В то же время ингибиторы дипептидилпептидазы-4 (иДПП-4) увеличивали вероятность смерти, а производные сульфонилмочевины (ПСМ) не влияли на исход [6].
В зависимости от тяжести течения инфекционного процесса в условиях стационара решается вопрос о смене исходно применяемой до госпитализации ССТ на разрешенные группы препаратов с учетом их возможных рисков применения и потенциальных эффектов в условиях острой инфекции. В Российской Федерации, согласно консенсусному решению Совета экспертов Российской ассоциации эндокринологов, определены показания и противопоказания к использованию тех или иных антигипергликемических препаратов пациентами с СД2 и COVID-19. Так, например, при легком и среднетяжелом течении COVID-19 в амбулаторных условиях возможно продолжить проводимую ССТ, если обеспечивается адекватная компенсация гипергликемии. Однако в случаях среднетяжелого и тяжелого течения инфекции, требующей госпитализации в стационар, неконтролируемой гипергликемии, в большинстве случаев приоритетным ССП является инсулин [10]. Данная тактика выбора антигипергликемической терапии схожа и с клиническими руководствами зарубежных авторов [11, 12].
Потребность в ИТ пациентов с СД2 в условиях стационара зависит от основной причины госпитализации. Например, в случае проведения оперативных вмешательств показания к применению инсулина определяются объемом процедуры, предшествующей ССТ, состоянием больного и уровнем гликемии [13]. Показано, что интенсивная ИТ для поддержания уровня глюкозы крови менее 6,1 ммоль/л снижает заболеваемость и смертность среди критически больных пациентов в отделении хирургической интенсивной терапии [14]. По данным национального аудита в Англии, посвященного лечению пациентов с диабетом, за время госпитализации независимо от причин отмечалось уменьшение перевода на внутривенную инфузию инсулина с 11,0% в 2011 г. до 8,2% в 2017 г. [15]. В то же время в исследовании NICE-SUGAR (2009) продемонстрировано, что достижение эугликемии (4,5–6,0 ммоль/л) у госпитализированных пациентов с критическими состояниями и СД2 сопровождалось значительным повышением риска гипогликемии (6,8 против 0,5%; р<0,001) и ухудшением прогноза по сравнению с группой с более высоким целевым уровнем гликемии <10,0 ммоль/л [16].
Применение инсулина при коронавирусной инфекции имеет ряд особенностей. Так, например, госпитализированные пациенты с пневмонией, вызванной вирусом SARS-CoV2, имели бóльшую потребность в инсулине, вводимом как внутривенно, так и подкожно, чем пациенты с пневмонией без COVID-19 [17]. Особое место занимает назначение ИТ в случае применения глюкокортикостероидов (ГКС) при лечении коронавирусной инфекции. Данная терапия помимо доказанного благоприятного влияния на течение инфекционного процесса оказывает воздействие на углеводный обмен с развитием гипергликемии, что требует еще более тщательного контроля и коррекции уровня глюкозы в крови как больным СД2 и COVID-19, так и пациентам без диабета [18, 19]. В когортном исследовании госпитализированных пациентов с диабетом и COVID-19 в Великобритании 9,8% пациентам потребовалась инфузия инсулина, однако только небольшая (12,5%) часть выборки получала лечение ГКС [20]. В исследовании B.M. Tomazini et al. о влиянии дексаметазона на продолжительность жизни и отсутствии искусственной вентиляции легких (ИВЛ) пациентов с острым респираторным дистресс-синдромом средней или тяжелой степени и COVID-19 31,1% пациентов в группе ГКС нуждались в инсулине для контроля гликемии [21].
Таким образом, приведенные данные показывают актуальность изучения проблемы применения ИТ в стационарных условиях у госпитализированных больных СД2 и COVID-19. Остается нерешенным вопрос сроков и целесообразности перевода пациентов с ИТ на другую ССТ на момент выписки пациентов из стационара.
Цель исследования: изучить особенности компенсации углеводного обмена у госпитализированных больных коронавирусной инфекцией и СД2, исходно не получавших ИТ.
Методы
Проведено одноцентровое обсервационное динамическое ретроспективное двухвыборочное сравнительное исследование госпитализированных в стационары ГБУЗ «Городская клиническая больница № 52» ДЗМ пациентов с коронавирусной инфекцией и СД2 (рис. 1). Критерии включения: возраст старше 18 лет, наличие СД2 в анамнезе, положительный результат мазка из носо- и ротоглотки на вирус SARS-CoV2 методом ПЦР, госпитализация в стационар, вирусное поражение легких, по данным КТ ОГК.
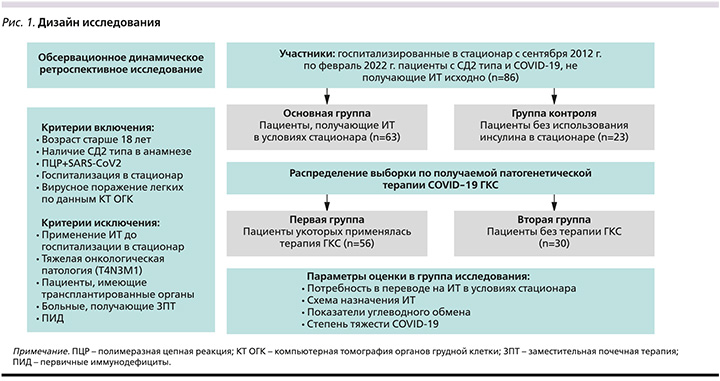
Критерии невключения: применение ИТ до госпитализации в стационар, тяжелая онкологическая патология с продвинутыми стадиями метастазирования (T4N3M1), пациенты, имеющие трансплантированные органы, больные, получавшие ЗПТ, ПИД.
Исследование проводилось среди госпитализированных пациентов в стационары ГБУЗ «Городская клиническая больница № 52» ДЗМ, Москва.
Исследование продолжалось с сентября 2021 по февраль 2022 г.
В исследуемой выборке больных оценивались следующие параметры: артериальное давление (АД) при поступлении, распространенность сопутствовавших заболеваний, клинико-лабораторные и инструментальные показатели в динамике – при поступлении и на 7-е сутки госпитализации: сатурация кислорода, число лейкоцитов, лимфоцитов, нейтрофилов, уровни С-реактивного белка (СРБ), лактатдегидрогеназы (ЛДГ), фибриногена, Д-димера, интерлейкина-6 (ИЛ-6), а также степень поражения легких по данным КТ ОГК, длительность госпитализации, степень тяжести COVID-19, частота перевода в отделение реанимации и интенсивной терапии (ОРИТ) и потребность в ИВЛ, смертельный исход.
В группах исследования анализировался стаж диабета, уровень глюкозы плазмы натощак (ГПН) и четырехточечный гликемический профиль (перед завтраком, обедом, ужином и перед сном) на первые, третьи и седьмые сутки госпитализации, получаемая ССТ в трех точках: до госпитализации в стационар, в стационарных условиях с указанием суточных доз инсулина короткого действия (ИКД) и инсулина средней продолжительности действия (ИСД) на первые, третьи и седьмые сутки госпитализации. Проводилась оценка получаемой терапии коронавирусной инфекции.
Основным исходом исследования являлось определение доли пациентов, которым потребовался перевод на ИТ в условиях стационара и на момент выписки, а также определение степени тяжести COVID-19, компенсации углеводного обмена и наиболее часто назначаемой комбинации ССП в данной когорте больных.
Проводилась оценка частоты назначения инсулина, схемы назначения ИТ, показателей углеводного обмена у пациентов на ГКС и без ГКС-терапии в стационаре и при выписке.
В первую (основную) группу исследования включались пациенты, получавшие ИТ в условиях стационара (n=63), во вторую (контрольную) группу – участники без использования инсулина (n=23).
Дополнительно проводился анализ среди больных, в отношении которых применялась патогенетическая терапия COVID-19 ГКС (n=56), и участников без терапии ГКС (n=30).
Этиологическая диагностика COVID-19 проводилась с применением метода ПЦР (мазок из носоглотки и ротоглотки на РНК SARS-CoV-2). Указание в анамнезе СД2, получаемая до госпитализации сахароснижающая терапия (ССТ), а также информация о трансплантированных органах и применении ЗПТ, наличие ПИД определялись по данным медицинских карт стационарного больного и единой медицинской информационно-аналитической системы. Тяжелая онкологическая патология с продвинутыми стадиями метастазирования устанавливалась согласно Международной клинической классификации стадий злокачественных новообразований TNM [22].
Определение ГПН проводили глюкозооксидазным методом. Уровень лейкоцитов, лимфоцитов, нейтрофилов, СРБ, ЛДГ, фибриногена, Д-димера в крови определяли по стандартной методике, ИЛ-6 – иммунохемилюминесцентным методом; производили расчет скорости клубочковой фильтрации (СКФ) по формуле CKD-EPI и индекса массы тела (ИМТ), ожирение верифицировалось при ИМТ≥30,0 кг/м2 [23].
Степень поражения легких, по данным КТ ОГК, определяли согласно следующим критериям: минимальный объем поражения легочной ткани <25% – КТ 1-й степени, средний объем поражения (25–50%) – КТ 2-й степени, значительный объем поражения (50–75%) – КТ 3-й степени и субтотальный >75% – КТ 4-й степени. Критерии степени тяжести, показания к переводу в ОРИТ, критерии выписки из стационара, назначаемая этиотропная и патогенетическая терапия COVID-19 определялись, согласно актуальным на момент исследования временным методическим рекомендациям по профилактике, диагностике и лечению новой коронавирусной инфекции [24].
Этическая экспертиза не проводилась. Исследование являлось ретроспективным с оценкой результатов рутинных методов исследования. Отсутствовало дополнительное медикаментозное вмешательство вне протокола ведения пациентов.
Статистический анализ базы данных осуществлялся в программе IBM SPSS Statistics, 26-я версия, и Microsoft Office Excel, 2017 (Microsoft Corp., США).
С учетом распределения, отличного от нормального, количественные показатели представлялись в виде медианы и 25-го и 75-го квартилей [Me (Q25; Q75)], а при нормальном распределении – как средние арифметические величины и стандартные отклонения [M±SD]. Категориальные показатели – как процент (абс.). Оценка различий качественных показателей выполнена при использовании χ2-критерия Пирсона или точного критерия Фишера при числе наблюдений в одной из ячеек четырехпольной таблицы <5. Различия количественных показателей при нормальном распределении представлены с помощью вычисления t-критерия Стьюдента, в отсутствие признаков нормального распределения – с помощью U-критерия Манна–Уитни. Различия считались статистически значимыми при р<0,05.
Результаты
Всего в исследование были включены 86 пациентов с СД2, не получавших исходно ИТ. Из них 34 (39,5%) мужчины и 52 (60,5%) женщины. Средний возраст составил 65,6±9,6 года, медиана длительности СД2 – 8,5 [4,0; 11,0] лет, уровень ГПН на первые сутки госпитализации – 8,3 [6,8; 14,0] ммоль/л. Гликемию при поступлении <7,0 ммоль/л имели 26 (30,2%), от 7,0 до 10,0 ммоль/л – 30 (34,9%), ≥10,0 ммоль/л – 30 (34,9%), ≥13,0 ммоль/л – 25 (29,1%) пациентов. Среднетяжелое течение COVID-19 диагностировано у 67 (77,9%) человек, тяжелое – у 19 (22,1%). Число переведенных в ОРИТ пациентов составило 12 (14,0%) человек, нуждавшихся в ИВЛ – 6 (7,0%); частота смертельного исхода – 6 (7,0%) человек.
По ССТ до госпитализации выборка пациентов распределилась следующим образом. Однокомпонентную терапию ССП получали 35 (40,7%) пациентов, двухкомпонентную – 39 (45,4%), трехкомпонентную – 9 (10,5%) человек. Число пациентов, исходно не получавших ССТ, составило 3 (3,5%) человека. Данные по комбинации ССП представлены на рис. 2.
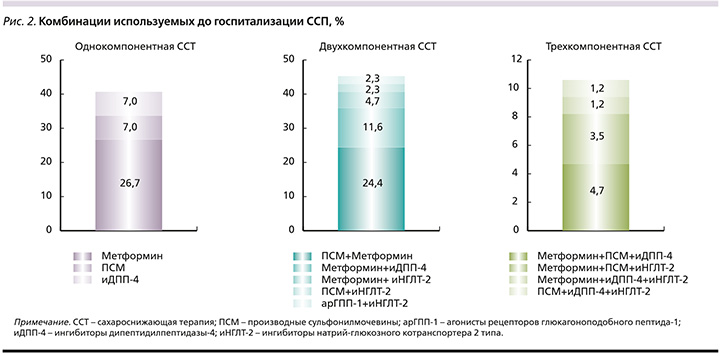
Таким образом, большинство пациентов получали метформин или комбинацию метформина и ПСМ.
В стационарных условиях из 86 госпитализированных пациентов 63 (73,3%) больным была назначена ИТ. Показанием к назначению инсулина являлись уровни ГПН≥10,0 ммоль/л и/или гликемия ≥13,0 ммоль/л в любой точке. При этом в 33 (38,4%) случаях по тяжести состояния и из-за противопоказаний к другой ССТ больные получали только ИТ, а в 30 (34,9%) случаях – ИТ в комбинации с другими ССП. ИТ назначали в первые сутки госпитализации. Из пациентов, получавших ИТ (n=63), только ИКД совместно или без ССП получали 27 (42,9%) человек, только ИСД с/без ССП – 5 (7,9%), базис-болюсную ИТ с/без ССП – 31 (49,2%) человек. Медиана суточных доз ИКД в 1-е сутки госпитализации составила 16,0 [8,0; 24,0] ЕД, на 3-и – 22,0 [10,5; 29,5] ЕД, на 7-е сутки – 20,0 [10,0; 25,0] ЕД. Для ИСД данный показатель составил 22,0 [18,5; 28,0] ЕД в 1-е сутки, 29,0 [22,0; 34,5] ЕД – на 3-и, 28,0 [22,0; 37,0] ЕД – на 7-е сутки. Общая суточная потребность в инсулине в 1-е сутки составила 0,25 [0,10; 0,42] ЕД/кг/сут., на 3-и сутки – 0,40 [0,19; 0,62] ЕД/кг/сут., на 7-е сутки – 0,28 [0,15; 0,51] ЕД/кг/сут.
Из выписанных (80 человек) пациентов ИТ рекомендована 15 (18,8%) пациентам, ИКД – 15 (18,8%), БИ – 3 (3,8%), базис-болюсная ИТ – 3 (3,8%) пациентам. Все пациенты получали ИТ при выписке в комбинации с другими пероральными ССП.
Дальнейшее разделение выборки пациентов на больных, получавших ИТ в стационаре (n=63), и участников без инсулина (n=23) показало следующие результаты. Группы исследования были сопоставимыми по полу, возрасту, наличию сопутствовавшей патологии: гипертонической болезни (ГБ), ишемической болезни сердца (ИБС), хронической сердечной недостаточности (ХСН), патологии органов дыхания, онкологическим заболеваниям, хронической болезни почек (ХБП) С3а и более (СКФ<60 мл/мин/1,73 м2), ожирения, а также по стажу СД2, получаемой ССТ до госпитализации (табл. 1).
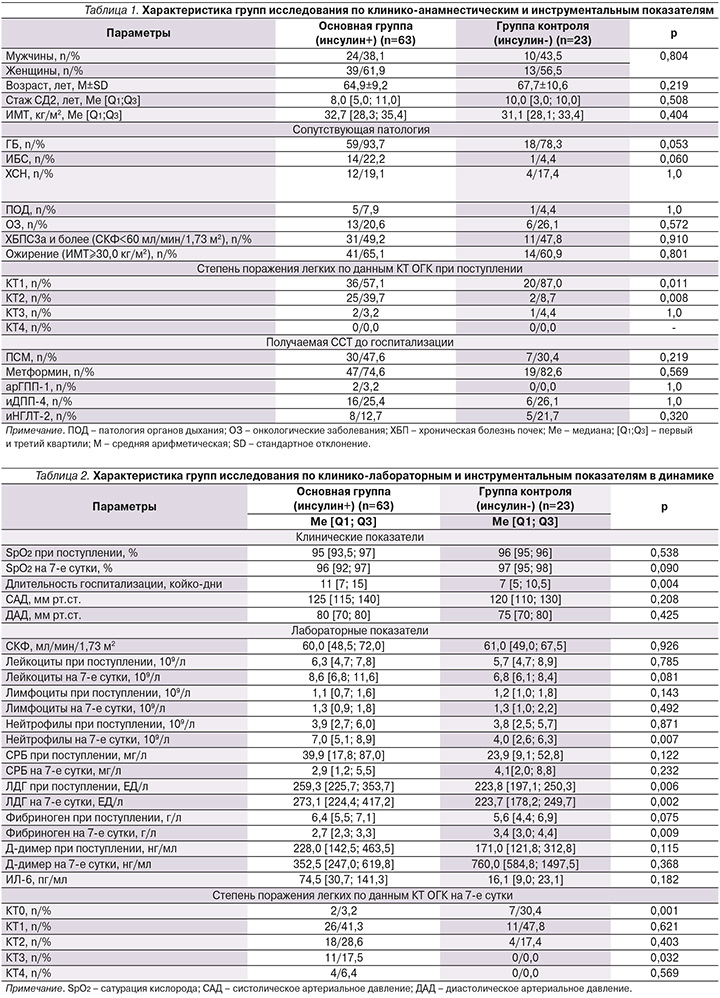
Выявлено, что группы различались по степени поражения легочной ткани. Так, по данным КТ ОГК, при поступлении в группе пациентов, которым подключена ИТ, поражение легких более 25% имели 27 (42,9%) человек, тогда как в группе сравнения – 3 (13,0%) человека (p=0,011).
По клинико-лабораторным показателям при поступлении участники исследования значимо различались по уровню ЛДГ, одному из показателей, отражающих тяжесть инфекционного процесса, и имели тенденцию к более высоким уровням фибриногена, Д-димера, СРБ, ИЛ-6, с положительной динамикой показателей (СРБ, фибриногена) через 7 дней в обеих группах, однако с сохраняющимся более высоким уровнем ЛДГ в группе на ИТ (табл. 2).
Длительность госпитализации прео-бладала в основной группе. По данным КТ ОГК, в динамике (на 7-е сутки госпитализации) отмечалось большее число участников, имевших КТ 0-й степени в группе без инсулина, тогда как КТ 3-й степени чаще имели пациенты на ИТ. Среднетяжелое течение COVID-19 наблюдалось у 71,4% пациентов первой группы и у 95,7% второй, тяжелое течение – у 28,6 и 4,4% соответственно (p=0,018). Число больных, переведенных в ОРИТ, было больше в группе ИТ (19,1 против 0,0%; p=0,031). По числу пациентов, нуждавшихся в ИВЛ (9,5 против 0,0%; p=0,186), и с смертельным исходом (9,5 против 0,0%; p=0,186) группы были сопоставимыми.
Анализ углеводного обмена за время госпитализации в группах наблюдения показал, что уровень ГПН на 1-е (9,6 против 6,9 ммоль/л; p<0,001), 3-и (9,8 против 7,9 ммоль/л; p=0,030) и 7-е сутки (10,4 против 7,4 ммоль/л; p=0,021) выше в группе применения ИТ.
Также отмечалась более высокая гликемия перед обедом, ужином и перед сном в первой группе, по данным гликемического профиля, на 1-е, 3-и и 7-е сутки (табл. 3).

По получаемой генно-инженерной биологической терапии (90,5 против 78,3%; p=0,154) группы исследования не различались. Частота применения ГКС была выше у больных на ИТ – 49 (77,8%) и 7 (30,4%) человек соответственно (p<0,001). При этом при выписке ГКС были рекомендованы 29,8% в основной группе и 8,7% в группе контроля (p=0,079). По назначаемой ССТ с ИТ или без таковой в условиях стационара и при выписке группы исследования были сопоставимыми; обращает на себя внимание увеличение частоты назначения метформина в обеих группах на момент выписки (рис. 3).
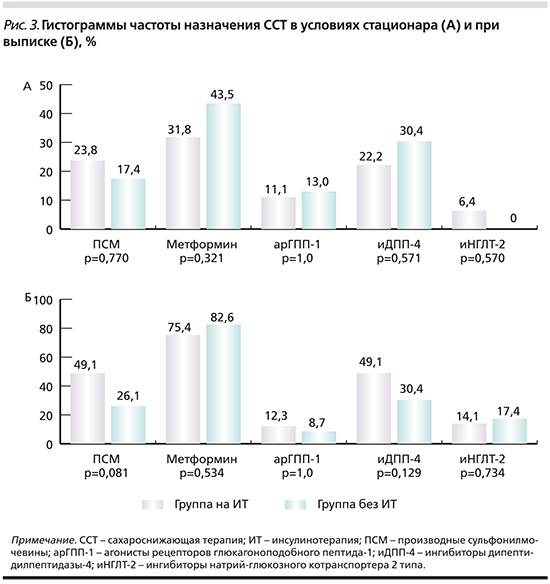
Таким образом, больным СД2, госпитализированным с COVID-19, требовался переход на ИТ в 73,3%. При этом пациенты, которым был назначен инсулин, имели более тяжелое течение инфекционного процесса, чаще нуждались в переводе в ОРИТ и имели выше показатели гликемии, чем пациенты без ИТ. На момент выписки 18,8% пациентов рекомендована ИТ, преимущественно ИКД на прием пищи с возможной дальнейшей отменой. Всем пациентам, получавшим ИТ при выписке, назначалась комбинация инсулина с пероральными ССП.
Сравнение участников исследования в зависимости от получаемой патогенетической терапии COVID-19 с разделением на первую группу пациентов, у которых использовались ГКС (n=56), и вторую (группу контроля) – без ГКС (n=30), показало следующие результаты. Группы исследования были сопоставимыми по полу, возрасту, стажу СД2, получаемой ССТ до госпитализации. В первой группе ГКС назначали в 1-й день госпитализации (табл. 4).
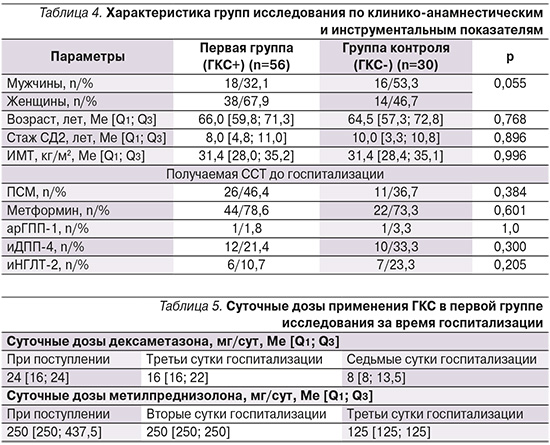
Суточные дозы применения ГКС в первой группе представлены в табл. 5.
Больные COVID-19, которые не использовали ГКС в качестве патогенетической терапии, имели среднетяжелое течение (100%), тогда как в группе применения ГКС среднетяжелое течение отмечено у 66,1%, тяжелое – у 33,9% пациентов (p<0,001). Также участникам первой группы чаще требовался перевод в ОРИТ (21,4 против 0,0%; p=0,007). По потребности в ИВЛ (10,7 против 0,0%; p=0,087) и смертельным исходам (10,7 против 0,0%; p=0,087) группы не имели статистически значимых различий.
По уровню ГПН на 1-е (9,1 против 7,7 ммоль/л; p=0,154) и 7-е сутки (9,6 против 7,3 ммоль/л; p=0,337) исследуемые группы не имели различий. Однако содержание ГПН на 3-и сутки госпитализации закономерно выше в группе применения ГКС – 10,5 и 7,0 ммоль/л соответственно (p<0,001).
ИТ в стационаре у пациентов, получавших ГКС, применяли в отношении 49 (87,5%) человек, в группе без ГКС – 14 (46,7%) (p<0,001). У пациентов на ГКС-терапии только ИКД с/без ССП применялся у 15 (30,6%) человек, а в группе без ГКС – у 12 (85,7%) (p<0,001), только ИСД с/без ССП – у 5 (10,2%) человек против 0,0% (p=0,578), базис-болюсная ИТ с/без ССП – у 29 (59,2%) против 2 (14,3%) пациентов (p=0,005) соответственно. Отмечалась более высокая потребность в суточных дозах ИКД на 1-е (18 против 7 ЕД; p=0,001), 3-и (23 против 8 ЕД; p<0,001) и 7-е сутки (24 против 4 ЕД; p<0,001) в группе ГКС по сравнению с контрольной группой, тогда как по суточным дозам ИСД на 1-е (22 против 12 ЕД; p=0,333), 3-и (28 против 38 ЕД; p=0,159) и 7-е сутки (30 против 20 ЕД; p=0,462) группы не различались. Пациентам, не получавшим лечение ГКС, чаще назначали метформин – 25,0 и 53,3% соответственно (p=0,009).
По применению других ССП различий не отмечалось – ПСМ (p=1,0), арГПП-1 (p=0,308), иДПП-4 (p=0,602), иНГЛТ-2 (p=0,608).
Среди выписанных пациентов ИТ рекомендована 26,0% в первой группе и 6,7% во второй (p=0,070), ИКД – 26,0 и 6,7% (p=0,070), БИ – 4,0 и 3,3% (p=1,0), базис-болюсная ИТ – 4,0 и 3,3% (p=1,0) соответственно (рис. 4).

Таким образом, больные СД2, госпитализированные с коронавирусной инфекцией, которым проводилась терапия ГКС, имели более тяжелое течение инфекционного процесса, что требовало интенсификации патогенетической терапии COVID-19 и антигипергликемической терапии.
Нежелательные явления
За время госпитализации уровень ГПН <3,9 ммоль/л зарегистрирован у 2 пациентов группы на ИТ; гипогликемия <3,0 ммоль/л не выявлена.
Обсуждение
Выявлена высокая частота назначения ИТ (73,3%) больным СД2, госпитализированным с коронавирусной инфекцией, исходно не получавшим инсулин, с более частым назначением в базис-болюсном режиме. Пациенты на ИТ имели более тяжелое течение COVID-19 и худший гликемический контроль. Сохранялась высокая потребность в инсулине при выписке. Гипергликемия в остром периоде коронавирусной инфекции независимо от назначения ГКС способствовала переводу на ИТ в стационаре в 46,7%.
В нашем исследовании показана высокая частота назначения ИТ (73,3%) госпитализированным пациентам с коронавирусной инфекцией и СД2, не получавшим ИТ в анамнезе, и продемонстрировано, что назначение ИТ обусловлено более тяжелым течением COVID-19. P.L. Wander et al. выявили, что вирус SARS-CoV2 связан с более высокими шансами лечения инсулином на 40% [25]. В ряде исследований показано, что пациенты, получавшие ИТ, имели более высокий риск летального исхода [3]. Предполагается, что это связано с исходно более тяжелым соматическим статусом пациентов с СД2, получавших ИТ, и COVID-19 [6, 8, 9, 26]. Однако есть исследования, в которых высказывается мнение, что непосредственно сама ИТ независимо от тяжести инфекционного процесса увеличивает вероятность неблагоприятного исхода [27]. Несмотря на то что ИТ является высокоэффективной ССТ, пациенты на ИТ в нашем исследовании имели худший гликемический контроль, что также вносит вклад в неблагоприятный исход COVID-19. Известно, что гипергликемия является независимым фактором риска тяжести коронавирусной инфекции для пациентов как с СД2, так и без диабета [4].
ИТ в стационаре в нашем исследовании чаще назначалась в базис-болюсном режиме. Но при выписке рекомендован ИКД совместно с другими ССП, что свидетельствует об уменьшении выраженности возникшей гипергликемии. Поэтому предполагается, что одной из причин развития декомпенсации углеводного обмена у пациентов с COVID-19 является остро возникшая инсулинорезистентность [28, 29]. Также об этом свидетельствует высокая потребность в инсулине даже у больных коронавирусной инфекцией, которым не назначены ГКС. J. Shin et al. показали, что у больных COVID-19 в критическом состоянии имеется более низкое содержание генов сигнального пути инсулина/инсулиноподобного фактора роста-1 в легких, печени, жировой ткани и клетках поджелудочной железы, что приводит к различным метаболическим нарушениям, в т.ч. к развитию инсулинорезистентности [30]. Отмечено повышение экспрессии Na+/H+ обменника (NHE-1) у пациентов с COVID-19, а также снижение соотношения глюкозного транспортера типа 1 к NHE-1 у больных в тяжелом состоянии [31]. В свою очередь инсулин усиливает действие NHE, тем самым может приводить к более тяжелому течению коронавирусной инфекции [32, 33]. Также у пациентов с СД2, получавших инсулин, отмечены более высокие уровни провоспалительных цитокинов по сравнению с больными, получавшими ПСМ, и пациентами без диабета, что свидетельствует о наличии хронического воспаления низкой степени выраженности [34]. В то же время высокая потребность в ИТ больных COVID-19 и СД2 может быть обусловлена прямым повреждением β-клеток SARS-CoV2, что приводит к необходимости назначения заместительной терапии инсулином в период клинической манифестации коронавирусной инфекции [35]. Однако повреждение β-клеток в большинстве случаев носит обратимый характер [36], что продемонстрировано и в нашем исследовании, поскольку только 18,8% больных остаются на ИТ на момент выписки.
Кроме того, потребность в ИТ во время госпитализации по поводу COVID-19 может быть маркером плохого прогноза и использоваться для выявления группы пациентов, которым требуется более агрессивное лечение для предотвращения смертности [9]. Совокупность этих данных требует более тщательного контроля гликемии у пациентов с коронавирусной инфекцией, особенно у тех больных, которым необходима ИТ, т.к. это может свидетельствовать о тяжести инфекционного процесса.
Отдельным блоком применения ИТ пациентами с COVID-19 является назначение патогенетической терапии ГКС. В нашем исследовании ГКС назначали в 1-е сутки госпитализации в связи с более тяжелым течением коронавирусной инфекции. В отношении больных данной категории ИТ применяли в 87,5% случаев и также назначали в 1-е сутки. В исследовании RECOVERY 21% пациентов требовалось использование инсулина для компенсации гипергликемии, развившейся при применении ГКС в высоких дозах, однако не указано, какая доля больных из них имели СД [37]. В нашем исследовании помимо ИКД для компенсации углеводного обмена в этой группе назначали ИСД. В исследовании C.R. Fornwald et al. продемонстрировано отсутствие различий в применении инсулина с нейтральным протамином Хагедорна и инсулина гларгина для компенсации гипергликемии при применении дексаметазона [38]. Закономерно, что больший процент пациентов на ГКС на момент выписки остается на ИТ, чем пациенты, не получавшие ГКС. Важным доказательством прямого влияния SARS-CoV2 на развитие гипергликемии независимо за счет усугубления инсулинорезистентности или за счет повреждения β-клеток является факт того, что даже без ГКС в 46,7% случаев требуется перевод на ИТ госпитализированных пациентов.
Таким образом, ИТ остается стандартом лечения пациентов с COVID-19 в критическом состоянии и при неконтролируемой гипергликемии у пациентов со среднетяжелым течением инфекции, а также при применении ГКС [39].
Ограничением данного исследования служат ретроспективный характер, малая выборка пациентов и небольшая длительность наблюдения за исследуемыми группами.
Заключение
Больным СД2, госпитализированным с коронавирусной инфекцией, требовался перевод на ИТ в условиях стационара в 73,3%. При этом в 38,4% случаев по тяжести состояния и из-за противопоказаний к другой ССТ больные получали только ИТ, в 34,9% – ИТ в комбинации с другими ССП. Наиболее частой схемой назначения ИТ в стационаре являлся базис-болюсный режим (49,2%). Пациенты, которым был назначен инсулин, характеризовались более тяжелым течением COVID-19 и худшим гликемическим контролем. При выписке сохранялась высокая потребность в инсулине 18,8% пациентов, которым чаще назначался ИКД совместно с другими ССП.
Больные СД2 и коронавирусной инфекцией, которым проводилась терапия ГКС (65,1%) и в 87,5% случаев назначалась ИТ, и закономерно, что больший процент пациентов на ГКС на момент выписки оставались на ИТ, чем пациенты, не получавшие ГКС.
Гипергликемия при коронавирусной инфекции у больных СД2, не получавших инсулин до госпитализации, способствовала переводу на ИТ в стационаре в 46,7% случаев даже пациентов, не получавших ГКС, что свидетельствует о прямом влиянии SARS-CoV2 на развитие гипергликемии в острый период коронавирусной инфекции независимо от применения ГКС.
Потребность перевода на ИТ госпитализированных пациентов с СД2 и COVID-19 независимо от применения ГКС является фактором более тяжелого течения инфекционного процесса и обусловливает необходимость усиленного гликемического контроля за данной когортой пациентов.
Вклад авторов. Т.Н. Маркова – концепция и дизайн исследования, научное руководство проводимого исследования, анализ и интерпретация полученных данных, написание текста статьи и редактирование текста рукописи.
А.А. Анчутина – сбор и обработка материала, статистическая обработка данных, написание текста статьи. М.С. Стас – сбор и обработка материала, статистическая обработка данных. М.М. Мед-жидова – сбор и обработка материала, написание текста статьи. Все авторы внесли существенный вклад в проведение исследования и подготовку статьи. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Финансирование. Работа выполнена по инициативе авторов без привлечения финансирования.
Благодарности. Авторы выражают огромную благодарность всем сотрудникам ГБУЗ «ГКБ №52 ДЗМ», которые принимали участие в борьбе с пандемией COVID-19.
Дополнительная информация
Публикация статьи осуществляется в рамках диссертационной работы на соискание ученой степени канд. мед. наук: «Прогностические факторы риска неблагоприятных исходов у госпитализированных больных сахарным диабетом 2 типа и новой коронавирусной инфекцией».



