Введение
Муковисцидоз (МВ) входит в число распространенных генетически детерминированных заболеваний, частота которого в среднем по России составляет 2,5 на 100 тыс. новорожденных. Патология отличается прогрессирующим, инвалидизирующим течением, что обусловлено как первичным поражением легких и поджелудочной железы, так и присоединением вторично ассоциированных осложнений, формированием полиорганной недостаточности [1–4]. Более 30 лет назад впервые было показано, что использование высококалорийной диеты без ограничения потребления жиров с обязательным приемом пищеварительных ферментных препаратов приводит к улучшению антропометрических показателей и увеличивает продолжительность жизни [5]. Это стало значимым этапом в лечении МВ. В настоящее время диетотерапия и заместительная ферментная терапия считаются неотъемлемой частью в комплексной терапии при МВ. Среди панкреатических ферментов наибольшую клиническую эффективность показали препараты панкреатина в виде мини-микросфер, покрытых кислотоустойчивой оболочкой [1, 2]. В то же время ряд задач остается нерешенным. Дискутабельны вопросы выбора наиболее эффективного метода расчета дозы панкреатина: эмпирический расчет числа единиц липазы на массу тела (ЕД/кг) и/или на содержание жира в пище (ЕД/г) [4, 6]; вопросы наиболее оптимальных доз панкреатина в сутки и на каждый прием пищи, а также вопросы безопасности приема высоких доз панкреатических ферментов детьми. Все больше исследований свидетельствуют о необходимости индивидуального подхода к назначению ферментной терапии [7–10]. Указанные вопросы стали целью настоящего исследования.
Цель работы: оценить дозы панкреатина для детей с МВ с использованием двух методов расчета с целью разработки алгоритма индивидуальной коррекции заместительной ферментной терапии.
Методы
Обследованы 140 детей (80 мальчиков и 60 девочек) в возрасте от 1 года до 18 лет (средний возраст – 6,4±5,2 года) с подтвержденным диагнозом «муковисцидоз» и панкреатической недостаточностью (эластаза-1 кала ≤200 мкг/г). В зависимости от возраста дети были разделены на 4 группы: 1-ю составили дети от года до 2 лет (n=40; средний возраст – 1,9±0,7 года); 2-ю – от 3 до 5 лет (n=41; 4,4 ±1,0 год); 3-ю – от 6 до 9 лет (n=43; 7,7±1,1 года); 4-ю группу – от 10 до 18 лет включительно (n=26; 13,1±2,5 года). Дозы панкреатина оценивали анкетноопросным методом с помощью пищевых дневников, включивших данные о потреблении пищи и дозе панкреатина за 3 дня. За норму при сравнении фактической дозы панкреатина с рекомендуемой при МВ принимали в сутки до 10 тыс. ЕД/кг массы тела; на основные приемы пищи детей 1–4 лет от 1000 ЕД/кг, старше 4 лет – от 500 до 2500 ЕД/кг и 2000–4000 ЕД/г на потребляемый жир, согласно руководству по питанию детей и взрослых с МВ ESPEN-ESPGHAN-ECFS (2016) [4].
Критерии включения: дети, страдающие МВ, от года до 18 лет, панкреатическая эластаза-1 кала ≤200 мкг/г, подписание информированного согласия.
Критерии исключения: отказ от участия в исследовании.
Исследование одобрено этическим комитетом ФГБОУ ДПО РМАНПО Минздрава России (протокол № 13 от 14.11.2017).
Дизайн исследования – одномоментное (поперечное).
Статистические методы проводилась с помощью пакета прикладных программ Statistica 10. В описательной статистике рассчитывали среднее значение (М) ± стандартное отклонение (SD) и медиана (Ме) (интерквартильный размах). В зависимости от вида распределения при сравнении двух независимых выборок применялись t-критерий Стьюдента или критерий Манна-Уитни.
Результаты
Анализ показал, что суточное количество жира в пище статистически значимо увеличивается с 64,1 до 104,0 г в возрасте от года до 18 лет (р1–4=0,000).
В то же время число единиц липазы статистически значимо снижается с 10 620,0 ЕД/кг в 1-й группе до 7000,0 – в 4-й возрастной группе (р1–4=0,000; рис. 1).
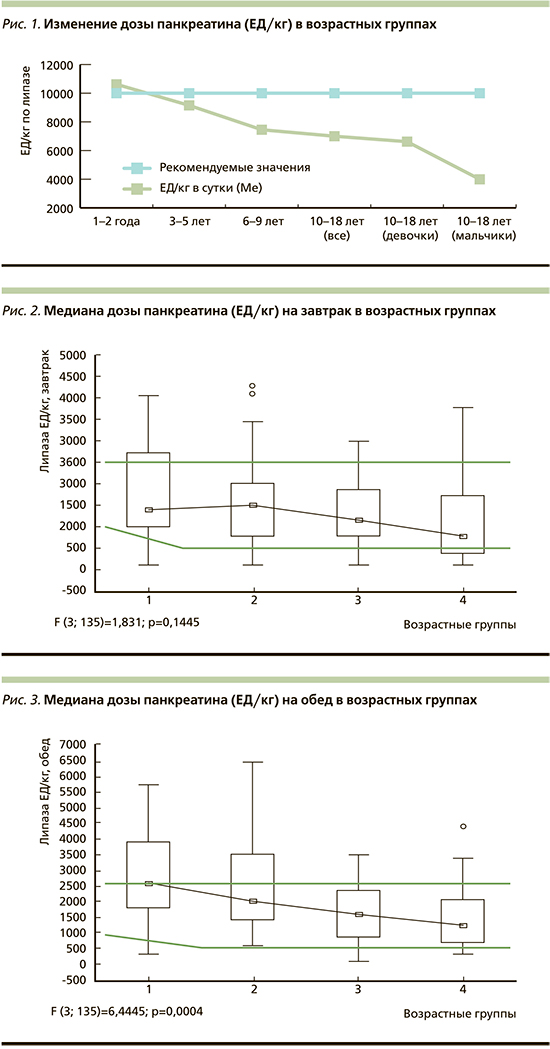
Аналогичные изменения получены для каждого из приемов пищи (рис. 2–4). Доза панкреатина на основные приемы пищи (завтрак, обед, ужин) прогрессивно снижалась с возрастом и приближалась к нижней границе рекомендуемых значений, особенно у детей 4-й (10–18 лет) возрастной группы. Так, медиана дозы панкреатина на завтрак в 1-й возрастной группе составляла 1431,0 ЕД/кг массы тела, во 2-й – 1479,0, в 3-й – 1154,4, в 4-й – 817,0 ЕД/кг (р1–4 =0,01) (рис. 2).
Медиана дозы панкреатина на обед в 1-й возрастной группе составила 2572,7 ЕД/кг массы тела, в 2-й – 2034,0, в 3-й – 1563,0, в 4-й – 192,5 ЕД/кг (р1–4 ≤0,01; рис. 3).
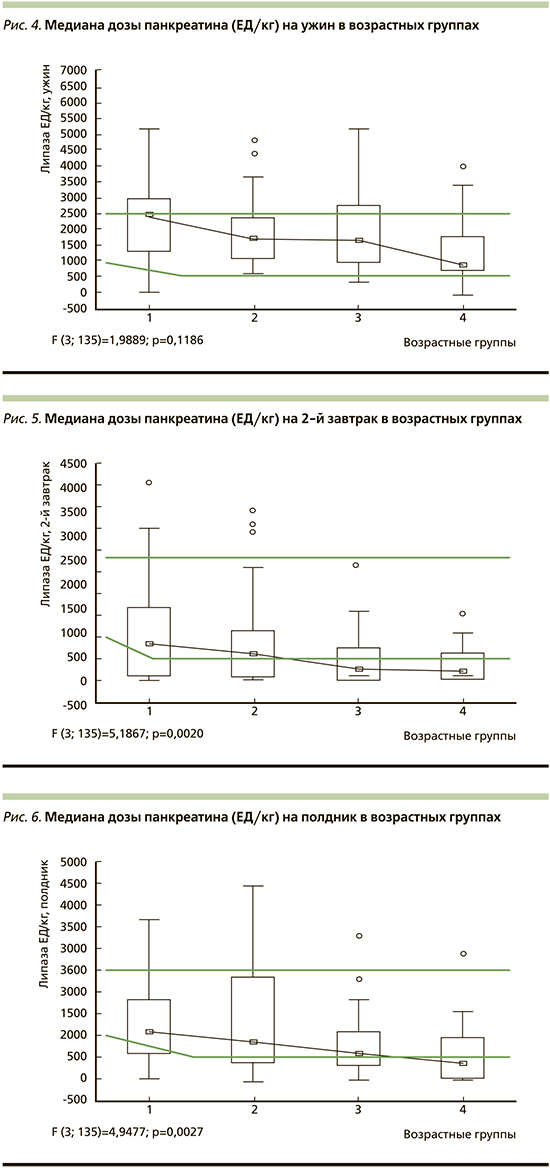
Медиана дозы панкреатина на ужин в 1-й возрастной группе составила 2434,5 ЕД/кг массы тела, во 2-й – 1752, в 3-й – 1672,9, в 4-й – 960,7 ЕД/кг (р1–4≤0,01; рис. 4).
На дополнительные приемы пищи (2-й завтрак, полдник, на ночь) потребление панкреатина было меньше рекомендованной нормы во всех возрастных группах (рис. 5–7). Ожидаемые результаты отражают типичные ошибки пациентов при расчете панкреатина только эмпирическим методом, при котором на дополнительный прием пищи используют половину дозы от основного приема (существующий на практике подход). При этом не учитывается, что «перекусы» (сдоба, кулинарные изделия, орехи, шоколад и др) по количеству жиров не уступают, а в некоторых случаях и превосходят основное блюдо. Эти данные свидетельствуют о том, что эмпирический метод расчета ферментов (ЕД/кг) не позволяет рассчитывать адекватную дозу, особенно низкими оказались дозы панкреатина на дополнительные приемы пищи. Так, медиана дозы фермента на 2-й завтрак в 1-й возрастной группе составила 740,5 ЕД/кг массы тела, во 2-й – 544,0, в 3-й – 209,6, в 4-й – 142,0 ЕД/кг (р1–4≤0,01; рис. 5).
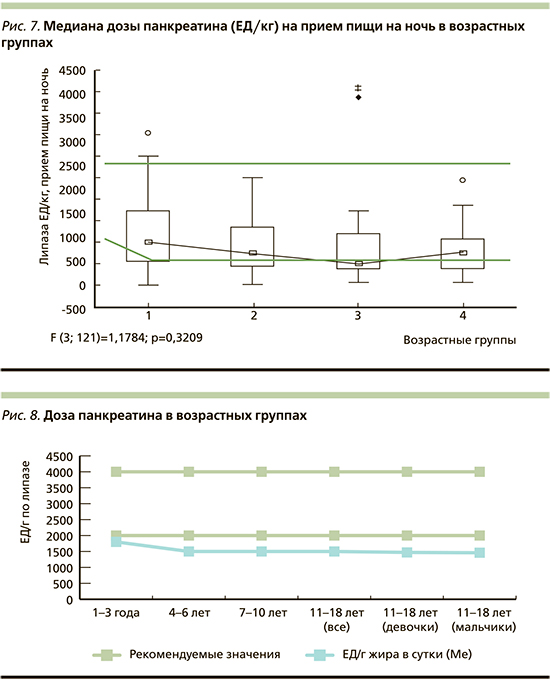
Медиана дозы панкреатина на полдник в возрасте 1–2 года (1-я группа) составила 1031,0 ЕД/кг массы тела, в 3–5 лет (2-я группа) – 441,5, в 6–9 лет (3-я группа) – 591,3, в 10–18 лет (4-я группа) – 569,5 ЕД/кг (р1–4≤0,01; рис. 6).
Медиана дозы панкреатина на прием пищи на ночь в 1-й возрастной группе составила 881,0 ЕД/кг массы тела, во 2-й – 640,0, в 3-й – 398,4, в 4-й – 654,0 ЕД/кг (р1–4≤0,01; рис. 7).
Как видно из представленных рисунков (рис. 2–7), имеет место большая вариабельность доз панкреатина как внутри группы, так и между ними.
Недостаточные дозы заместительной ферментной терапии могут быть причиной неполного купирования кишечного синдрома, выпадения прямой кишки, снижения нутритивного статуса. В таких клинических ситуациях в первую очередь необходим более точный метод – с применением расчета панкреатина на потребляемый жир. Кроме того, указанный метод показан при сохранении кишечного синдрома на фоне приема панкреатина выше 10 тыс. ЕД/кг массы тела (верхний рекомендованный предел).
Расчет дозы панкреатина вторым методом с использованием оценки содержания жира в пище показал, что в общей группе детей медиана панкреатина составила 1500 ЕД/г жира в пище, что ниже рекомендованных 2000–4000 ЕД/г [4]. Анализ дозы панкреатина (ЕД/г жира в пище) между возрастными группами не показал статистической разницы. Так, дети в возрасте 1–2 лет получали 1800,0 ЕД/г, 10–18 лет – 1500,0 (р1–4≤0,05; рис. 8). Дозы панкреатина при расчете на 1 г жира в пище находились ниже рекомендованных значений [4] во всех возрастных группах (рис. 8).
Было выявлено, что у 26,4% детей суточная доза панкреатина составляла более 10 тыс. ЕД/кг (верхний референсный предел при назначении ЕД/кг), из них 16% – до 5 лет. И только в 1% случаев доза превышала 4000 ЕД липазы на 1 г жира (верхний референсный предел при назначении ЕД/г). При этом побочных эффектов в виде синдрома дистальной интестинальной обструкции не отмечено. Полученные результаты свидетельствуют, что доза панкреатина выше 10 тыс. ЕД/кг массы тела может использоваться при МВ в детском возрасте.
Обсуждение
Доказательств оптимального дозирования ферментов в настоящее время недостаточно. В нашем исследовании выявлена вариабельность доз ферментов, отражающая индивидуальные особенности приема препарата. Наши данные согласуются с Европейским могоцентровым исследованием (McCyFAPP-проект), где дозы заместительной ферментной терапии варьировались от 3947 (Испания) до 13 615 ЕД липазы/кг/сут (Бельгия). При расчетах на потребляемый жир также были отмечены расхождения: в Лиссабоне и Валенсии более 70% пациентов получали менее 2000 ЕД/г жира в пище в сутки, в Милане и Левене более 50% пациентов – выше 4000 ЕД/г жира в пище [7–10].
В исследовании McCyFAPP-проекта было проведено изучение липолиза in vitro в специальных условиях. На основании этой теоритической модели проведено практическое исследование: дети с МВ (n=45) употребляли одинаковую диету и определенное количество ферментов (проверенная на модели in vitro). Эффективность проверяли с помощью коэффициента абсорбции жира (КФА) и по шкале Бристоль. В результате КФА находился на высоком уровне – 84–95% во всех центрах. Не было связи КФА с возрастом, типом мутации и индексом массы тела. Полученные данные позволяют предположить, что характеристики пищи (содержание белков, жиров, углеводов, структура и консистенция) оказывают большее влияние, чем индивидуальные характеристики пациента (тип мутации, возраст, масса тела) [10].
Заключение
Таким образом, данные исследования отражают возрастную динамику и количественную характеристику дозирования панкреатина у детей в возрасте от 1 до 18 лет с использованием двух методов расчета препарата. Вывлено, что с возрастом доза ферментов снижается и не всегда соответствует консенсусным рекомендациям, особенно низкми оказались дозы панкреатина на дополнительные приемы пищи. Вариабельность в дозировании панкреатина, демонстрируемая в нашем исследовании, подтверждает необходимость индивидуального алгоритма коррекции заместительной ферментной терапии. При этом целессобразно использовать более корректный метод расчета препарата на потребляемый жир, особенно детям с некупируемым энтеральным синдромом, выпадением прямой кишки, белково-энергетической недостаточностью и дозой панкреатина выше 10 тыс. ЕД/кг/сут.


