Эпидемиология
В современных условиях острые кишечные инфекции (ОКИ) у детей остаются достаточно актуальной медицинской проблемой. По данным ВОЗ, у детей ежегодно в мире регистрируется около 1,7 млрд случаев острой диареи, и от нее умирают 525 тыс. в возрасте до пяти лет. Каждый ребенок до 5-летнего возраста переносит хотя бы один эпизод ОКИ [1]. В России в структуре инфекционной заболеваемости ОКИ по-прежнему занимают существенное место, второе после острых респираторных вирусных инфекций [2]. В частности, зафиксировано 25 млн амбулаторных визитов к врачу в год по поводу ротавирусной инфекции. Это значит, что каждый пятый ребенок хотя бы раз в год посещает врача по поводу гастроэнтерита, причем один из 60–65 детей ежегодно попадает в стационар с этим заболеванием. Дети первых 5 лет жизни наиболее часто болеют ротавирусными гастроэнтеритами, причем около 5% всех смертей детей до 5 лет вызвано ротавирусом [3]. Среди причин детской инфекционной летальности ротавирусная инфекция находится на 3-м месте после пневмококковой инфекции и кори.
В США на долю острого гастроэнтерита (ОГЭ) приходится около 10% (220 тыс.) детских госпитализаций, более 1,5 млн посещений поликлиник и около 300 случаев смерти детей в возрасте до 5 лет в год [4].
Этиология
Этиологическим фактором инфекционного гастроэнтерита могут выступать различные агенты: бактериальные, вирусные или протозойные. Бактериальными агентами могут быть представители родов Salmonella, Shigella, патогенные штаммы Escherichia coli, Campylobacter, Staphylococcus, Klebsiella и др. Возбудителями вирусных ОКИ являются ротавирусы групп А и С, норо-, астро-, аденовирусы F, сапо-, бокавирусы, вирусы аичи, парэхо-, коронавирусы и др. По данным исследований, от 50 до 80% случаев ОКИ у детей обусловлено ротавирусами группы А и норовирусами 2-го генотипа [5–7]. В России частота ротавирусного гастроэнтерита в структуре заболеваемости ОКИ составляет 7–35%, среди детей до 3 лет превышает 60% [8].
Наиболее частые кишечные патогены в зависимости от возраста в Европейском регионе [9]:
- младше 1 года: рота-, норо-, аденовирусы, сальмонелла;
- 1–4 года: рота-, норо-, аденовирусы, сальмонелла, кампилобактор, иерсиния;
- старше 5 лет: ротавирусы, сальмонелла, кампилобактор.
Для выработки оптимальной тактики диагностики и лечения важно понимать патогенез развития ОКИ у детей (табл. 1).
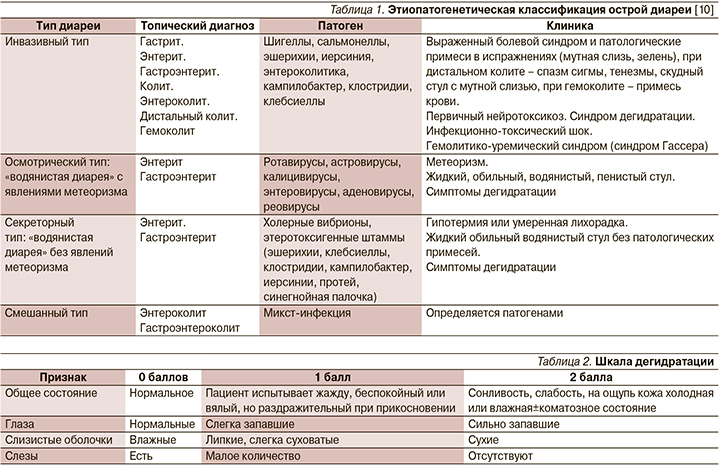
Как уже сказано выше, самой частой причиной гастроэнтерита является ротавирус. Наиболее тяжело протекает первый в жизни эпизод ротавирусного гастроэнтерита у детей с 6 месяцев до 2–3 лет. Опасность вирусного гастроэнтерита связана с быстрым обезвоживанием и электролитными нарушениями из-за потери воды и солей с жидким стулом и рвотой.
Клиническая оценка обезвоживания у детей
Существуют следующие анатомо-физиологические особенности у детей, предрасполагающие к дегидратации [11]:
- высокая потребность в воде;
- большие физиологические потери воды (дыхание, потоотделение, мочеиспускание);
- низкий резерв белков, углеводов (внутриклеточный гомеостаз) из-за роста организма;
- слабость адаптивных механизмов (приспособительные реакции – патологические).
- физиологическая незрелость печени, почек, легких, кишечника, ретикулоэндотелиальной системы (недостаточность детоксикации);
- повышенная чувствительность сосудистых стенок клеточных мембран к кислородному голоданию.
Для оценки степени дегидратации традиционно ориентируются на дефицит жидкости в процентах по отношению к массе тела в соответствии с критериями ВОЗ [12]:
- <5% – нет признаков обезвоживания;
- 5–10% – умеренная степень обезвоживания;
- >10% – обезвоживание в тяжелой форме.
Также существует клиническая шкала дегидратации (общее число баллов от 0 до 8; табл. 2) [13]
Клиническая оценка обезвоживания по данным параметрам осуществляется по балльной системе: 0 баллов — отсутствие обезвоживания, 1–4 балла – легкое обезвоживание, 5–8 баллов – умеренное/тяжелое обезвоживание.
Заподозрить потерю жидкости около 5% можно при наличии двух из четырех признаков [14]:
- удлинение времени наполнения капилляров более 2 секунд (капиллярный тест);
- отсутствие слез;
- сухость слизистых оболочек;
- синдром интоксикации.
Одновременное наличие трех из перечисленных признаков – свидетельство потери жидкости более 10% и риска развития гиповолемического шока.
Синдром дегидратации возникает при потере воды и электролитов. Различают три вида дегидратации: гипертоническую, гипотоническую и изотоническую [11].
Гипертоническая (вододефицитная, внутриклеточная) дегидратация возникает на фоне потери преимущественно воды, которая вследствие повышения концентрации натрия в плазме перемещается в кровеносное русло. Потери происходят в основном с диареей.
В результате возникает внутриклеточное обезвоживание, которое клинически проявляется неутолимой жаждой, афонией, «плачем без слез». Кожа сухая, теплая, большой родничок не западает, характерен высокий уровень натрия плазмы ≥150 ммоль/л, уменьшенный объем эритроцитов и высокое содержание гемоглобина в них. Осмолярность плазмы и мочи повышены.
Гипотоническая (соледефицитная, внеклеточная) дегидратация возникает в случае преимущественной потери электролитов (натрия, калия), встречается при преобладании рвоты над диареей. Потеря солей приводит к снижению осмолярности плазмы и перемещению жидкости из сосудистого русла в клетки (внутриклеточный отек). При этом виде дегидратации жажда умеренная. Внешние признаки дегидратации выражены слабо: кожа холодная, бледная, влажная, слизистые оболочки не столь сухие, большой родничок западает. Характерно снижение уровня натрия плазмы менее 135 ммоль/л, увеличение объема эритроцитов и уменьшение концентрации гемоглобина в них. Осмолярность плазмы и мочи понижены.
Изотоническая (нормотоническая) дегидратация считается наиболее распространенной и сопровождается одновременной потерей жидкости и солей. Как правило, содержание натрия плазмы нормальное. Средний объем эритроцитов и концентрация гемоглобина, осмолярность плазмы и мочи в пределах нормы.
Диагностика
Диагностика ОГЭ основывается на характерных клинических симптомах. По данным Европейского общества детских гастроэнтерологов, гепатологов и нутрициологов (ESPGHAN) [15], ОГЭ обычно не требует специфического подтверждения. Однако в некоторых ситуациях могут быть полезными культуральное исследование кала, ПЦР-диагностика и иммунодиагностика.
Бактериологический метод является «золотым» стандартом при бактериальных ОКИ при соблюдении ключевого правила: взятие клинического материала должно производиться до назначения антимикробной терапии. С учетом высокой стоимости, трудоемкости и получения результатов исследований через 3 и более дней в последнее время предлагают существенно ограничить его применение. ESPGHAN рекомендует использование бактериологического метода для дифференциальной диагностики инфекционной патологии и воспалительных заболеваний кишечника, в случае персистирующей диареи, требующей антибактериальной терапии (иммунокомпрометированные пациенты или при подозрении на шигеллез) [15].
Идентификация специфического антигена может проводиться с помощью латекс-агглютинации, коагглютинации, иммунохроматографии, иммуноферментного анализа и других способов, которые являются экспресс-методами, позволяющими подтверждать диагноз бактериальных и вирусных ОКИ уже в ранние сроки болезни, в т.ч. на фоне лечения антибиотиками. В последнее десятилетие для верификации возбудителей все чаще используют метод полимеразной цепной реакции (ПЦР), в т.ч. ПЦР в режиме реального времени (ПЦР-РВ). К достоинствам метода ПЦР-РВ относятся высокие специфичность и чувствительность, простота и удобство проведения анализа, возможность исследования различных биологических материалов и выявления сразу нескольких патогенов в одной пробирке (мультиплексная ПЦР-РВ), быстрота получения результата, что позволяет отнести ПЦР к методам ранней этиологической диагностики [16, 17].
Молекулярно-генетические исследования следует рассматривать не как альтернативу, а как обязательное дополнение к регламентированным схемам диагностики ОКИ, позволяющее эффективно верифицировать комплекс вирусных возбудителей ОКИ и проводить оценку идентичности бактериальных и вирусных изолятов. Серологические методы (реакция агглютинации, реакция прямой геммагглютинации с эритроцитарным диагностикумом и др.), позволяющие обнаруживать специфические антитела, считаются вспомогательными в диагностике большинства инвазивных ОКИ и основными при диагностике иерсиниоза [18].
Лечение
Алгоритм лечения острых гастроэнтеритов у детей представлен на рисунке.
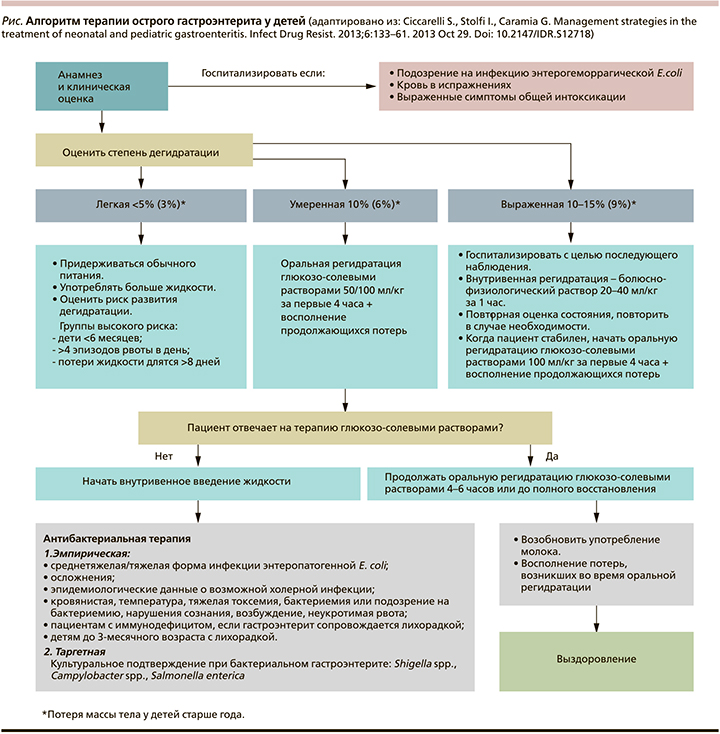
Основой терапии пациентов с ОГЭ вне зависимости от этиологии заболевания является как можно более раннее проведение оральной регидратации растворами с осмолярностью 225–250 мосм/л. Состав раствора для оральной регидратации на 1 л (ESPGHAN): Na+ – 60 ммоль/л, К+ – 20 ммоль/л, Cl- > 25 ммоль/л, цитрат – 10 ммоль/л, глюкоза – 74–111 ммоль/л.
К преимуществам оральной регидратации относятся [19]:
- при легкой и умеренной степенях дегидратации восстановление концентрации калия, натрия и кислотно-основного баланса происходит быстрее, чем при инфузии;
- простота и доступность метода;
- высокая эффективность и отсутствие осложнений.
В соответствии с рекомендациями ESPGHAN-2014, если проведение пероральной регидратации не представляется возможным, ее нужно осуществлять через назогастральный столь же эффективный зонд. Возможно использование для пероральной регидратации охлажденного или замороженного раствора, гелеобразного раствора, добавление ароматизирующих веществ или меда в раствор для регидратации.
Показания к переходу на парентеральную регидратацию:
- тяжелые формы эксикоза с признаками гиповолемического шока;
- обезвоживание+тяжелая интоксикация;
- неукротимая рвота;
- олигурия/анурия, не исчезающие в ходе первого этапа регидратации;
- неэффективность оральной регидратации в течение суток.
В случае развития признаков гиповолемического шока основной целью терапии становится обеспечение нормального сердечного выброса и преднагрузки с нормальной сократительной способностью, поэтому назначение вазодилататоров при сниженной сократительной способности может быть опасным.
Цели терапии первого часа [20]:
- восстановление сознания;
- восстановление перфузии периферических тканей: симптом бледного пятна менее 2 с, диурез более 0,5 мл/кг/ч, периферический и центральный пульс равны;
- восстановление артериального давления.
С этой целью вводится 1 болюс 20 мл/кг 0,9%-ного NaCl или раствора Рингера (менее 20 минут). При улучшении дальнейшее наблюдение, в отсутствие эффекта повторное введение. Важно добиться нормализации витальных функций [20].
При невозможности катетеризации периферических сосудов необходимо обеспечить внутрикостный доступ.
К целям дальнейшей терапии относятся:
- поддержание сатурации более 70%;
- сердечный индекс более 3,3, но менее 6,0;
- восстановление перфузионного давления: центральное венозное давление – 8–12 мм рт.ст. и среднее артериальное давление ≥65 мм рт.ст.
Диетотерапия в остром периоде заболевания играет одну из ключевых ролей. По данным современных исследований [21, 22 ], не следует прекращать кормление более чем на 4–6 часов после начала регидратации, продолжать грудное вскармливание во время течения ОГЭ и регидратации; безлактозные смеси рекомендуются только детям до 5 лет, находящимся в стационаре; применение сухарей, риса в питании детей с ОГЭ не рекомендуется, т.к. эффективность данной диеты не была изучена, напитки с высоким содержанием сахара не рекомендуются.
Что касается медикаметнозной терапии, то при ОГЭ не рекомендуется использовать противорвотные препараты и лоперамид [23]. В качестве сорбционной терапии рекомендовано применение смектита диоктаэдрического [24]; другие сорбенты в терапии ОГЭ применять не следует. Антисекереторный препарат рацекадотрил может быть использован в терапии ОГЭ, поскольку он уменьшает секрецию слизистой оболочки кишечника и увеличивает абсорбцию [25].
В руководстве ESPGHAN (2014) рутинная эмпирическая антибактериальная терапия не рекомендуется.
Показания к назначению антибактериальной терапии:
- бактериальный гастроэнтерит: Shigella spp., Campylobacter spp., Salmonella enterica;
- эпидемиологические данные о возможной холерной инфекции;
- кровянистая диарея с/без лихорадки, которая может указать на шигеллез или сальмонеллез.
При этом предпочтительно применение оральных антибиотиков. Парентеральное назначение антибиотиков рекомендуется:
- при невозможности орального приема (неукротимая рвота, ступор);
- при тяжелой токсемии, бактериемии или подозрении на бактериемию;
- пациентам с иммунодефицитом, если гастроэнтерит сопровождается лихорадкой;
- детям до 3-месячного возраста с лихорадкой.
В развивающихся странах также рекомендуется включить в схемы лечения ОГЭ микроэлемент цинк [26].
Активная терапия пробиотиками совместно с оральной регидратацией уменьшает продолжительность и выраженность симптомов гастроэнтерита, в частности, в отношении детей с ОГЭ используются пробиотики Lactobacillus GG и Saccharomyces boulardii [27–30]. Пероральное применение пробиотиков уменьшает длительность диареи. Полученные в исследованиях данные свидетельствуют о том, что включение пробиотиков в терапию вирусного гастроэнтерита дает лучший эффект, чем их применение больными бактериальной или паразитарной инфекцией. Механизм действия пробиотиков штамм-специфичен: существуют доказательства эффективности некоторых штаммов лактобацилл (например, Lactobacillus casei и Lactobacillus reuteri ATCC 55730) и Saccharomyces boulardii.
Заключение
Таким образом, своевременная и адекватная диагностика и терапия ОГЭ у детей служат важной задачей в работе врача-педиатра. Особое внимание следует уделять терапии больных гастроэнтеритом с отягощенным анамнезом и преморбидным фоном, в частности с уже имеющейся патологией желудочно-кишечного тракта, т.к. течение ОГЭ может способствовать ухудшению основной хронической патологии.


