Актуальность
Метаболический синдром (МС) – одна из самых актуальных и в то же время спорных проблем клинической медицины. МС является фактором высокого риска многих заболеваний, особенно сердечно-сосудистых и сахарного диабета 2 типа (СД2). Многие ученые и практические врачи анализируют много разнообразных противоречивых экспериментальных и клинических данных о МС. Патогенез МС до сих пор изучается, при этом большинство ученых признают, что ключевая роль принадлежит абдоминальному ожирению, инсулинорезистентности (ИР) и хроническому системному воспалению [1–4]. Снижение степени ожирения и поддержание нормальной массы тела, повышение чувствительности тканей к инсулину служат эффективной патогенетической терапией МС. Доказано, что даже умеренное снижение массы тела на 5–10% от исходного может способствовать снижению уровней артериального давления (АД) и дислипидемии. Эффективность диетотерапии в сочетании с регулярными физическими нагрузками и повышением чувствительности тканей к инсулину показана во многих исследованиях [3–6]. Однако, несмотря на достигнутые успехи в диагностике и лечении МС, сохраняется его значительная распространенность. Многие российские и зарубежные исследовательские группы занимаются изучением и поиском оптимальных методов лечения МС. Одним из перспективных направлений ее решения является поиск дополнительных факторов, влияющих на причину развития МС как теоретической базы для основы новых патогенетически обоснованных способов терапии. Гетерогенность МС указывает на необходимость применения комплексной терапии, основанной на персонализированном подходе. Поэтому важен поиск дополнительных факторов, влияющих на основные патогенетические звенья МС.
В настоящее время выявлены плейотропные эффекты витамина D в отношении снижения риска развития МС [7–10]. Однако, несмотря на то что показана протективная роль витамина D, вопрос об относительной его значимости при МС пока остается открытым. И в рутинной терапевтической практике применение витамина D в комплексной терапии МС не нашло широкого распространения. Поэтому для понимания дополнительных механизмов, влияющих на патогенез МС и, соответственно, эффективность лечебных мероприятий, было проведено данное исследование.
Цель исследования: повысить эффективность лечебных мероприятий при МС и недостаточности витамина D.
Методы
Данное исследование проведено в 2014–2015 гг. с включением 60 пациентов с МС (50% – женщины, 50% – мужчины) и недостаточностью витамина D в возрасте от 20 до 45 лет, длительно (>10–15 лет) проживавших в Новокузнецке. Диагностику МС проводили в соответствии с рекомендациями экспертов Всероссийского научного общества кардиологов (ВНОК, 2009) [11]. Основным критерием МС был центральный (абдоминальный) тип ожирения: окружность талии (ОТ)>80 см у женщин и >94 см у мужчин; дополнительными: артериальная гипертензия (АГ) – АД 130/85 мм рт.ст., уровень триглицеридов (ТГ) >1,7 ммоль/л, снижение концентрации холестерина (ХС) липопротеидов высокой плотности (ЛПВП) <1,0 ммоль/л у мужчин и <1,2 ммоль/л у женщин, повышение уровня ХС липопротеидов низкой плотности (ЛПНП) >3,0 ммоль/л, гипергликемия натощак (содержание глюкозы в плазме крови натощак 6,1 ммоль/л) и нарушенная толерантность к глюкозе (НТГ) – уровень глюкозы в плазме крови через 2 часа после нагрузки – 7,8 и <11,1 ммоль/л. Наличие у больного абдоминального ожирения и 2 дополнительных критериев стали основанием для диагностики МС. Для оценки избыточной массы тела и ожирения использовали индекс массы тела (ИМТ, 1997). Критерии исключения из исследования: постменопаузальный МС, СД2, заболевания щитовидной железы и репродуктивной системы, требующие гормональной коррекции, терапия статинами, препаратами кальция и витамином D, длительная и частая инсоляция, воспалительные заболевания кишечника, синдром жировой мальабсорбции, сопутствующие заболевания в стадии обострения, прием гормональных контрацептивов. Уровень витамина D оценивали по содержанию 25(ОН) витамина D в соответствии с рекомендациями Международного общества эндокринологов (2011) [12]. Недостаточность витамина D диагностировали при уровне 25(ОН) витамина D 20–30 нг/мл, оптимальный уровень – 30 и более нг/мл.
Для диагностики ИР использовали малую модель гомеостаза (HOMA – Homeostasis Model Assesment). Индекс ИР HOMA-IR рассчитывали по формуле: HOMA-IR=глюкоза натощак (ммоль/л)×инсулин натощак (мкЕД/мл)/22,5. Для оценки концентрации лептина использовали диагностический набор Leptin ELISA, DBC (норма – 3,7–11,1 нг/мл), инсулина – Monobind Insulin ELISA (норма 0,7–12,5 мкМЕ/мл), а также рассматривали маркеры системного воспаления: высокочувствительный С-реактивный белок (hs СРБ) и цитокины – высокочувствительный фактор некроза опухоли α (hsФНО-α), Bender MedSystems (норма – 0–3,22 пг/мл) и интерлейкин-6 – ИЛ-6 (норма – 0–5 пг/мл). Все пациенты с МС получали антигипертензивную терапию в индивидуально подобранных дозах в зависимости от продолжительности АГ: монотерапию ингибиторами ангиотензинпревращающего фермента (ИАПФ) – 34 (56,7%), комбинацию ИАПФ и диуретика – 22 (36,7%), комбинацию блокаторов медленных кальциевых каналов и диуретика – 4 (6,6%). Целевой уровень АД (<130/85 мм рт.ст.) регистрировали на всем протяжении исследования у всех пациентов без дополнительной коррекции.
В соответствии с требованиями биомедицинской этики на участие в исследовании было получено информированное согласие всех обследованных лиц. Протокол исследования был одобрен Этическим комитетом ГБОУ ДПО НГИУВ Минздрава России (регистрационный № 43 от 18.04.2013). Описательная статистика использовалась для систематизации, наглядного представления материала в виде графиков и таблиц и их количественного описания. Количественные данные были представлены в виде медианы (Me), 25 и 75 нижнего и верхнего квартилей (Q25; Q75), качественные признаки представлены в виде абсолютных значений (n) и процентной доли (%).
Непараметрические методы применяли для оценки статистической значимости межгрупповых различий с использованием критерия U-теста Манна–Уитни для двух несвязанных групп, для сравнения качественных показателей – χ2-критерий Пирсона, Критический уровень значимости при проверке статистических гипотез в данном исследовании принимали р<0,05.
Результаты
Согласно протоколу исследования, все пациенты с МС при недостаточности витамина D были рандомизированы в две группы: контрольную (n=30) и группу сравнения (n=30). Терапевтические группы были сопоставимыми по полу (р=1,000) и возрасту (р=0,485). С учетом рекомендаций ВНОК (2009) лечебные мероприятия для пациентов с МС должны быть направлены на основные звенья патогенеза данного синдрома [4, 11], а именно на абдоминальное ожирение, ИР и системное воспаление. При этом главной целью лечения пациентов с МС следует считать снижение массы тела и достижение хорошего метаболического контроля. В настоящее время показана эффективность диетотерапии в снижении массы тела, улучшении чувствительности тканей и метаболического профиля пациента с МС [3, 4, 6]. Но длительное соблюдение здорового образа жизни может быть затруднительным для пациентов с МС. Поэтому в качестве превентивной фармакотерапии был предложен препарат метформин. Эффективность и безопасность метформина доказаны во многих клинических исследованиях [1, 5, 13], его плейотропные эффекты связаны с активацией циклического аденозинмонофосфата. Метформин снижает как ИР, так и концентрацию лептина и позитивно влияет на ряд факторов риска сердечно-сосудистых заболеваний, включая уменьшение ОТ и массы тела, снижение уровней ТГ, ХС ЛПНП и повышение уровня ХС ЛПВП в сыворотке крови. Данный препарат может назначаться с целью профилактики СД2 пациентам с ожирением даже без МС. У лиц с абдоминальным ожирением метформин снижает частоту развития СД2 [1, 5, 13]. Помимо плейотропных кардиопротективных действий метформин обладает анорексигенным. При этом снижение массы тела у пациентов с ИР было более значительным, а эффективная суточная доза метформина соответствовала 1700–2000 мг [1, 13, 14].
Пациентам с МС в контрольной группе рекомендовали модификацию образа жизни и препарат метформин с постепенной титрацией дозы до 1700 мг/сут (850 мг в два приема) в течение 6 месяцев. В питании пациентов с МС ограничивали простые углеводы, углеводсодержащие продукты с высоким гликемическим индексом более 70. Все пациенты не менее 2–3 раз в неделю должны были употреблять различные виды морской рыбы по 100–150 г готового продукта как основного источника полиненасыщенных жирных кислот и витамина D. Пациенты группы сравнения получали аналогичные контрольной группе рекомендации по модификации образа жизни препарат метформин и дополнительно колекальциферол в дозе 2000 МЕ в течение всего периода исследования (6 месяцев). Препаратом выбора для лечения дефицита и недостаточности витамина D являлся колекальциферол (уровень доказательности АI) [10, 12]. Мицеллированные («водорастворимые») растворы витамина D обеспечивают хорошую степень всасывания практически во всех возрастных группах пациентов (дети, взрослые, пожилые) с минимальной зависимостью от состава диеты, приема препаратов, состояния печени и биосинтеза желчных кислот [15]. Начало данного исследования было до публикации отечественных клинических рекомендаций по дефициту витамина D у взрослых [10]. Поэтому при назначении в группе сравнения препарата колекальциферол мы руководствовались зарубежными исследования и рекомендациями [12].
После 6 месяцев терапии у пациентов с МС при недостаточности витамина D регистрировали статистически значимое изменение медианы всех показателей по сравнению с периодом до лечения независимо от терапевтической группы. Однако у пациентов с МС в группе сравнения в отличие от контрольной наблюдалась более значимая эффективность по изучаемым показателям (см. таблицу).
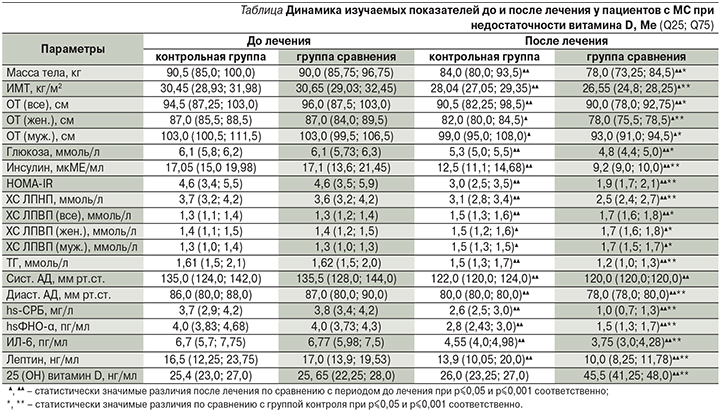
Стоит отметить, что клинически значимое снижение массы тела на 5% от исходного зарегистрировали во всех терапевтических группах. Однако динамика снижения массы тела у пациентов с МС при недостаточности витамина D в контрольной группе была 7,2%, в группе сравнения – 13,3%. Подобная тенденция в изучаемых терапевтических группах пациентов с МС наблюдалась в отношении ИМТ. Так, в контрольной группе пациентов с МС при недостаточности витамина D после проведенной терапии ИМТ снизился на 7,9%, в группе сравнения – на 13,4%. При анализе проведенной терапии зафиксировали положительную динамику ОТ с МС при недостаточности витамина D. Но клинически значимого гендерного снижения в контрольной группе ОТ до 94 см у мужчин и до 80 см у женщин мы не отметили. Выявили положительные изменения показателей углеводного обмена у пациентов с МС при недостаточности витамина D по уровню как гликемии, так и инсулина и индекса ИР HOMA-IR. Но в контрольной группе клинически значимого снижения индекса ИР ниже 2,77 не выявили. В отношении показателей липидного обмена отметили положительную динамику во всех терапевтических группах пациентов с МС при недостаточности витамина D. Однако клинически значимого снижения ХС ЛПНП (ниже 3,0 ммоль/л) в контрольной группе мы не зарегистрировали. Рассматривая у пациентов с МС динамику показателей системного воспаления (hsСРБ, hsФНО-α и ИЛ-6), мы выявили достоверное их снижение как в группе контроля, так и в группе сравнения. Более значимый эффект снижения показателей системного воспаления после проведенного лечения отметили у пациентов с МС в группе сравнения. Так, снижение концентрации маркеров системного воспаления (hsФНО-α и ИЛ-6) в контрольной группе соответственно составило 30 и 32,1%, в группе сравнения – 62,5 и 44,6%. Аналогичная ситуация наблюдалась в отношении уровня лептина. Так, в контрольной группе у пациентов с МС при недостаточности витамина D уровень лептина снизился на 15,8%, в группе сравнения – на 41,2%. При этом уровень 25(ОН) витамина D в группе сравнения соответствовал оптимальному значению.
Обсуждение
При анализе терапии пациентов с МС при недостаточности витамина D мы наблюдали значимое изменение медианы всех показателей независимо от группы. Полученные нами данные согласуются с результатами положительного влияния на динамику массы и метаболический профиль в целом диетотерапии и препарата метформин [1, 3, 4].
В настоящее время нет жестких клинических рекомендаций по рациональному питанию, чаще рассматривают преимущества и недостатки отдельных видов диет. Однако показано негативное влияние легкоусвояемых углеводов в модуляции постпрандиальной гликемии. Пациенты с избыточной массой тела должны быть информированы и обучены самоконтролю в домашних условиях. Рекомендуется динамическое наблюдение 2 раза в год, снижение массы тела на 10% и более за 6 месяцев считается отличным результатом, 5–10% – хорошим, от стабилизации массы тела до 5% снижения – удовлетворительным [6].
Однако более значимый эффект от лечения достигла только группа сравнения, что указывает на плейотропное действие витамина D. Можно полагать, что полученные нами и другими исследователями [7, 9] данные изменения величин исследуемых показателей обусловлены противовоспалительным действием витамина D, т.к. отмечено более значительное снижение уровней маркеров системного воспаления (hsСРБ, hsФНО-α и ИЛ-6), а также кардиопротективным, антигипергликемическим, липолитическим, снижающим ИР. В частности, установлено, что восстановление уровня витамина D благоприятно влияет на эффекты эндогенного инсулина, стимулируя экспрессию гена инсулинового рецептора и тем самым улучшая опосредованный инсулином внутриклеточный транспорт глюкозы [8, 10, 12].
В Российской Федерации физиологическая потребность в витамине D для здоровых взрослых составляет 10 мкг/сут (400 МЕ/сут) [8]. Однако клинические международные и отечественные рекомендации, имеющиеся к настоящему времени, а также результаты ряда исследований свидетельствуют, что для поддержания оптимальных уровней витамина D крови более 30 нг/мл необходим ежедневный прием более 1500–2000 МЕ/сут (уровень доказательности АII). По данным ряда авторов, дополнительный ежедневный прием препарата колекальциферол от 2000 до 4000 МЕ пациентами с гиповитаминозом D оказывает положительное влияние на АГ, гипергликемию натощак и избыточную массу тела [7, 9].
Заключение
Достижение оптимального уровня витамина D у пациентов с МС путем ежедневного приема колекальциферола в дозе 2000 МЕ в сочетании с диетотерапией и препаратом метформин повышает эффективность лечебных мероприятий за счет дополнительного положительного воздействия на основные патогенетические звенья МС, а именно: абдоминальное ожирение, ИР и системное воспаление.
Вклад авторов
Концепция и дизайн – Н.С. Алексеева, Е.В. Белобородова. Сбор и обработка материала, написание текста – Н.С. Алексеева. Редактирование статьи – Н.С. Алексеева, Е.В. Белобородова.



