Актуальность
По данным проведенных эпидемиологических исследований, распространенность хронического болевого синдрома в России варьируется от 13,8 до 56,7%, в среднем 34,3 случая на 100 человек. Более чем у 40% людей хронический болевой синдром серьезно снижает качество жизни, что влияет на их трудоспособность и оказывает значимое влияние на экономику здравоохранения за счет прямых и непрямых экономических потерь [1]. Обеспечение оптимального лечения пациентов с хронической болью становится наиболее приоритетной задачей в современной медицине. В основе лечения острых и хронических болевых синдромов лежит фармакотерапия различными анальгетическими средствами. Данная терапия зачастую недостаточно эффективна и может сопровождаться побочными эффектами. С целью повышения качества и эффективности противоболевой терапии необходимо учитывать индивидуальные особенности пациента, в т.ч. особенности восприятия боли в зависимости от возраста и пола пациента.
Обзор литературных источников показал, что за последнее десятилетие в нашей стране, как и во всем мире, получила бурное развитие гендерная медицина [2]. Это новое направление в медицине – оценка заболевания с учетом различий в проявлении заболеваний у мужчин и женщин вследствие их биологических особенностей и с учетом гендера, а именно психологических различий, различий в поведении, обусловленных социокультуральными нормами [3]. Изучение особенностей восприятия боли в зависимости от возраста и пола пациента служит новым направлением противоболевой терапии.
Многочисленные клинические и экспериментальные исследования позволяют считать доказанным факт гендерных различий в процессах ноцицепции и антиноцицепции [4–6]. Однако причины этих различий остаются недостаточно изученными. Вместе с тем решение данной проблемы имеет большое практическое значение для повышения эффективности противоболевой терапии и реализации тактики индивидуального подхода медицины боли. Разработка дифференцированной терапии боли с учетом половых различий, в т.ч. различий в уровне половых гормонов, является актуальной проблемой практической медицины. Известно, что тестостерон подавляет выработку и высвобождение в кровь цитокинов, медиаторов воспаления, играющих важную роль в формировании боли и развитии гипералгезии [7]. На данный момент сформулирована гипотеза о связи андрогенной недостаточности как с хронической болью, так и с центральной сенситизацией [8]. Последние клинические данные подтверждают, что коррекция андрогенного дефицита может быть эффективной в комплексном лечении хронических болевых синдромов при мигрени, фибромиалгии, синдроме хронической тазовой боли [9–11]. Тестостерон способен в большей мере (в отличие от эстрогена) проникать через гематоэнцефалический барьер без глобулина, связывающего половые гормоны, т.е. в биологически активной форме, и является стероидным гормоном, который имеет большое значение для модуляции ощущения боли в заднем роге спинного мозга и других ключевых участках центральной нервной системы (ЦНС), ослабляя повышенную активность нейронов ноцицептивной нервной системы. У здоровых людей болезненный/стрессовый стимул повышает выработку субстанции P, которая, как было обнаружено, стимулирует выработку ароматазы, что способствует превращению тестостерона в эстрадиол в ЦНС [8]. Ароматаза-позитивные нейроны связываются с эстрогеновыми рецепторами ноцицептивных нейронов, способствуя активации центральной препроэнкефалиновой опиоидной системы, что ведет к повышенной выработке эндогенных опиоидных пептидов, последующему подавлению выработки субстанции P и уменьшению боли (рис. 1). Напротив, у пациентов с дефицитом уровня тестостерона возникает нарушение механизма подавления боли. Ферментативного превращения тестостерона в эстрадиол ароматазой в ЦНС оказывается недостаточно для выработки эндогенных опиоидных пептидов и подавления ноцицептивных сигналов, что ведет к развитию хронической диффузной широко распространенной боли, для которой характерен феномен «взвинчивания». Другие механизмы, с помощью которых тестостерон, вероятно, ослабляет ноцицепцию, включают воздействие на некоторые анатомические области в ЦНС, например на андрогенные рецепторы группы нейронов среднего мозга, окружающих водопровод мозга (PAG-нейронов), которые воздействуют на активацию или выключение клеток нейронов ростральной части вентромедиальной области продолговатого мозга (RVM) [12]. В данном случае тестостерон действует на PAG-нейроны для осуществления регуляции клеток RVM и последующего нисходящего торможения боли. Наконец, андрогены должны быть способны координировать ноцицептивные механизы боли, так же как координируют взаимодействие иммунной, нейроэндокринной и репродуктивной систем, для того чтобы организм имел возможность переключаться между разными функциями: преодолением стрессовой ситуации, борьбы с заболеванием, воспроизводством и основной жизнедеятельностью.
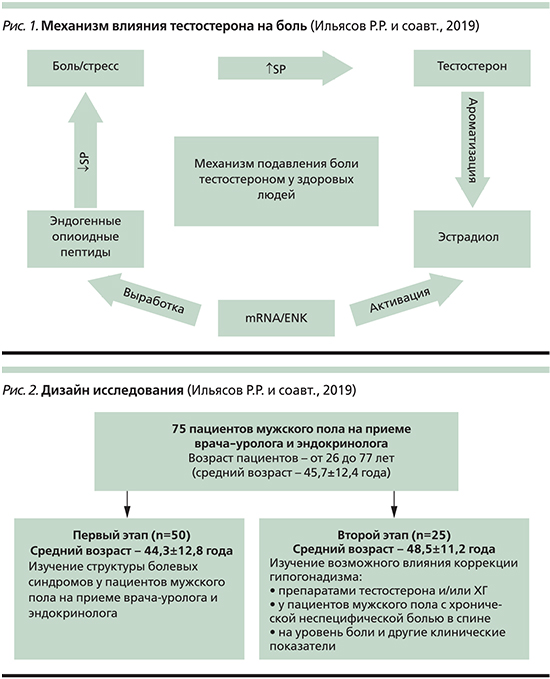
С учетом в совокупности описанных механизмов аномально низкий уровень тестостерона способен приводить к усилению восходящей/нисходящей ноцицепции и уменьшению нисходящего тормозного контроля боли, что способствует расширению полей боли и может обернуться устойчивым хроническим болевым синдромом. Предшествовавшее состояние дефицита тестостерона из-за длительного стрессового состояния и/или генетической предрасположенности может также способствовать большей подверженности некоторых людей хронической боли [8].
В структуре хронических болевых синдромов особое место занимает хроническая неспецифическая боль в спине, распространенность которой в общей популяции достаточно высока – до 84% [13]. В отдельных случаях эпизоды боли в спине длятся всего несколько дней и проходят сами, однако от 44 до 78% пациентов отмечают хронизацию боли [13]. При этом каждый 5-й пациент на приеме врача-невролога имеет клинические признаки андрогенодефицита, что говорит о необходимости междисциплинарного участия в лечении такого пациента [14].
Цель исследования: оценка роли препаратов половых гормонов (тестостерона и хорионического гонадотропина – ХГ) в лечении болевого синдрома у пациентов мужского пола с андрогенодефицитом и сопутствующей хронической неспецифической болью в спине.
Методы
Дизайн исследования
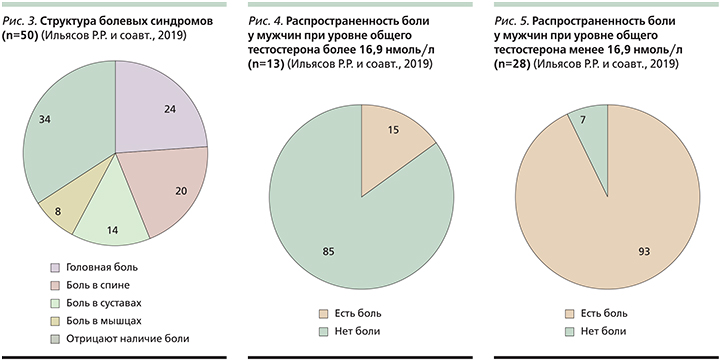
В исследование были включены 75 пациентов мужского пола на приеме врача-уролога и эндокринолога. Возраст пациентов составил от 26 до 77 лет (средний возраст – 45,7±12,4 года) (рис. 2).
Исследование включило 2 этапа:
- изучение структуры болевых синдромов у пациентов мужского пола;
- изучение возможного влияния повышения уровня общего тестостерона в крови пациента на уровень боли и другие клинические показатели на фоне применения препаратов тестостерона и/или ХГ.
Согласно поставленным целям и задачам, была сформирована исследуемая выборка больных соответственно критериям включения, невключения и исключения из исследования.
На первом этапе в исследование были включены 50 пациентов мужского пола, было проведено исследование распространенности болевого синдрома среди данной группы пациентов. Средний возраст пациентов составил 44,3±12,8 года.
На втором этапе в исследование были включены 25 пациентов мужского пола с лабораторно подтвержденным андрогенодефицитом (уровнем общего тестостерона в крови ниже 13,0 нмоль/л) и сопутствующей хронической неспецифической болью в спине, которым планировалась терапия с применением препаратов тестостерона и/или ХГ врачом-эндокринологом и/или врачом-урологом. Проведено изучение возможного влияния повышения уровня общего тестостерона в крови пациента на уровень боли и другие клинические показатели с применением препаратов тестостерона и/или ХГ. Средний возраст пациентов составил 48,5±11,2 года.
Критерии соответствия
Критерии включения на первом этапе исследования: мужчины в возрасте 25–80 лет, подписанное информированное согласие на участие в исследовании. Критерии невключения: алкоголизм, психические расстройства, длительный прием наркотических анальгетиков, длительный предшествовавший прием гормональных средств, наличие онкологических заболеваний (в т.ч. рака предстательной железы), транссексуализм. Критерии исключения: отказ пациента от участия в исследовании.
Критерии включения на втором этапе исследования: мужчины в возрасте 25–80 лет, наличие лабораторных данных, подтверждающих наличие андрогенодефицита (уровень общего тестостерона в крови <13,0 нмоль/л), наличие сопутствующей хронической неспецифической боли в спине, наличие активных жалоб на боли в течение нескольких последних месяцев, наличие показаний к коррекции андрогенодефицита с применением препаратов тестостерона и/или ХГ на приеме врача-эндокринолога и/или врача-уролога, подписанное информированное согласие на участие в исследовании. Критерии невключения: алкоголизм, психические расстройства, длительный прием наркотических анальгетиков, длительный предшествовавший прием гормональных средств, наличие онкологических заболеваний (в т.ч. рака предстательной железы), наличие абсолютных противопоказаний к заместительной гормональной терапии тестостероном, транссексуализм. Критерии исключения: отказ пациента от участия в исследовании.
Условия проведения и продолжительность исследования
Анализируемые статистические данные получены в негосударственном амбулаторном лечебно-профилактическом учреждении – Клинике профессора Калинченко (Москва).
Анализ проводился на основании статистических данных, полученных с 2015 по 2017 г. включительно (проспективно).
Описание медицинского вмешательства
На первом этапе проведено анкетирование пациентов мужского пола на приеме врача-уролога и врача-эндокринолога. Данные пациенты заполняли модифицированный краткий опросник боли (BPI – Brief Pain Inventory) (добавлена возможная локализация болевого синдрома – головная боль, боль в спине, боль в мышцах, боль в суставах). На основании анализа данных заполненных опросников формулировалась структура болевых синдромов.
На втором этапе пациентам мужского пола проведено: 1) клиническое обследование (неврологический осмотр, сбор анамнеза), 2) информационно-образовательная работа (в рамках Школы боли в спине однократно перед началом исследования, личной беседы на приеме продолжительностью по 30 минут, где пациент получал информацию о причинах возникновения и хронизации боли, возможных современных методах лечения и прогнозе заболевания), 3) коррекция андрогенодефицита с применением препаратов тестостерона и/или ХГ.
Специфического лечения (нестероидные противовоспалительные средства, антидепрессанты и др.) пациентам данной группы не проводили.
Данным пациентам дважды, в начале и в конце исследования (через 3 месяца), проводили лабораторное измерение уровня общего тестостерона в крови и комплексное анкетное тестирование, которое включало заполнение: 1) опросника BPI, 2) Освестровского опросника нарушения жизнедеятельности при боли в нижней части спины (ODI – Oswestry Disability Index), 3) опросника депрессивности Бека (BDI – Beck Depression Inventory), 4) шкалы ситуативной и личностной тревожности Спилбергера–Ханина (STAI – State-Trait Anxiety Inventory); 5) индекса тяжести инсомнии (ISI – Insomnia Severity Index).
Основной ход исследования
На первом этапе исследования провели расчет распространенности болевых синдромов среди пациентов мужского пола, изучение структуры болевых синдромов, оценку наличия корреляционной зависимости между уровнем общего тестостерона в крови и выраженностью боли у пациентов мужского пола.
На втором этапе нами был проведен сравнительный анализ уровня боли, лабораторного уровня общего тестостерона в крови и других клинических показателей перед началом терапии препаратами тестостерона и/или ХГ и в динамике по результатам проведенной терапии пациентов мужского пола. Проведена оценка статистической значимости динамики изменения выраженности боли на фоне коррекции андрогенодефицита. Наличие динамики считалось статистически значимым при p<0,01. Проведена оценка статистической значимости динамики изменения уровня депрессии, тревожности, степени нарушения жизнедеятельности, тяжести инсомнии на фоне коррекции андрогенодефицита. Наличие динамики считалось статистически значимым при p<0,05. Проведена оценка целевых значений уровня общего тестостерона в крови пациентов мужского пола, соответствовавших отсутствию или минимальным жалобам на наличие боли.
Этическая экспертиза
Протокол исследования был рассмотрен локальным Комитетом по этике ФГБОУ ВО ПМГМУ им. И.М. Сеченова Минздрава РФ (выписка из протокола № 01-17 от 15.02.2017). Результат рассмотрения протокола исследования: одобрить исследование в рамках диссертационной работы «Роль половых гормонов в лечении болевых синдромов у мужчин» (исполнитель – Р.Р. Ильясов).
Статистический анализ
Размер выборки предварительно не рассчитывался. Статистическая обработка полученных данных проводилась с использованием непараметрического U-критерия Манна–Уитни с помощью программ Microsoft Excel 2011, SPSS (корреляционный анализ, факторный анализ).
Результаты исследования
Полностью завершили исследование 68 пациентов мужского пола. Возраст пациентов составил от 26 до 77 лет (в среднем 45,2±12,6 года).
На первом этапе полностью завершили исследование 50 пациентов.
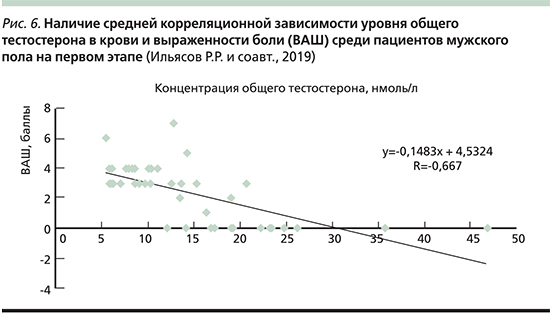
В результате анализа данных опросников была сформулирована структура болевых синдромов (рис. 3).
Из 50 пациентов 41 был проведен лабораторный анализ уровня общего тестостерона в крови. Проведен сравнительный анализ наличия или отсутствия болевого синдрома в зависимости от лабораторного уровня общего тестостерона в крови пациентов: 30 (73%) пациентов предъявили жалобы на наличие боли, 11 (27%) пациентов отрицали наличие боли.
Методом ранжирования выделено три наиболее значимых диапазона уровня общего тестостерона в крови данных пациентов. Выявлено, что в случае уровня общего тестостерона в крови выше 16,9 нмоль/л (рис. 4) жалобы на наличие боли присутствуют только у 15% мужчин, у 85% мужчин данные жалобы отсутствуют. В случае уровня общего тестостерона в крови ниже 16,9 нмоль/л (рис. 5) жалобы на наличие боли присутствовали у 93% мужчин и только у 7% мужчин данные жалобы отсутствовали. В случае уровня общего тестостерона в крови выше 22,3 нмоль/л жалобы на наличие боли отсутствовали у 100 % мужчин.
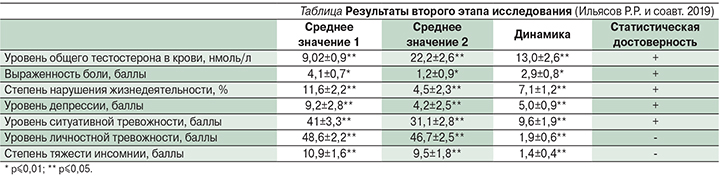
Был проведен анализ уровня боли по визуальной аналоговой шкале (ВАШ) в зависимости от уровня общего тестостерона в крови. В случае уровня общего тестостерона в крови ниже 16,5 нмоль/л среднее значение баллов по ВАШ за последние 4 недели составило 3,3 ±0,5 при p≤0,05. В случае уровня общего тестостерона в крови выше 16,5 нмоль/л среднее значение баллов по ВАШ за последние 4 недели составило 0,39±0,5 при p≤0,05. Была выявлена обратно пропорциональная средняя корреляционная зависимость (r=-0,67) уровня общего тестостерона в крови и выраженности боли за последние 4 недели в баллах по ВАШ среди пациентов мужского пола на первом этапе исследования (рис. 6).
На втором этапе полностью завершили исследование 18 пациентов, выбыли из исследования на данном этапе 7 пациентов (отказ от продолжения исследования). Средний возраст пациентов, полностью завершивших исследование, был 47,8±11,8 года. Средняя продолжительность заболевания (хронической неспецифической боли в спине) среди данных пациентов на момент начала исследования составила 4,6 ±1,5 месяца.
Получены следующие результаты второго этапа исследования (см. таблицу):
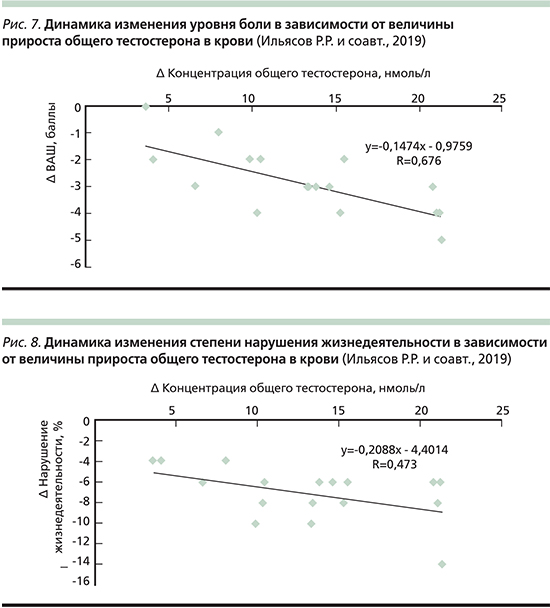
- Среднее значение выраженности боли по ВАШ в баллах среди пациентов в начале исследования составило 4,1±0,7 при p≤0,01, через 3 месяца после начала терапии – 1,2±0,9 при p≤0,01. На фоне терапии значение выраженности боли по ВАШ в баллах снижалось в среднем на 2,9±0,8 балла при p≤0,01, что демонстрирует статистически достоверное снижение уровня выраженности боли по ВАШ в баллах среди пациентов мужского пола с хронической неспецифической болью в спине в данном объеме выборки. Установлено, что чем больше был прирост уровня общего тестостерона в крови, тем более выражена была динамика изменения уровня боли (рис. 7).
- Среднее значение степени нарушения жизнедеятельности в % среди пациентов в начале исследования было 11,6±2,2 при p≤0,05, через 3 месяца после начала терапии – 4,5±2,3 при p≤0,05. На фоне терапии степень нарушения жизнедеятельности снижалась в среднем на 7,1±1,2 % при p≤0,05, что демонстрирует статистически достоверное снижение степени нарушения жизнедеятельности в % в данном объеме выборки. Установлено, что чем больше был прирост уровня общего тестостерона в крови, тем более выражена была динамика изменения степени нарушения жизнедеятельности. При этом динамика изменения степени нарушения жизнедеятельности была значима, начиная с прироста уровня общего тестостерона в крови более 21,36 нмоль/л (рис. 8).
- Среднее значение уровня депрессивности в баллах среди пациентов мужского пола в начале исследования было 9,2±2,8 при p≤0,05, через 3 месяца после начала терапии – 4,2±2,5 при p≤0,05. На фоне терапии уровень депрессивности снижался в среднем на 5,0±0,9 балла при p≤0,05, что демонстрирует статистически достоверное снижение уровня депрессивности в баллах в данном объеме выборки. Выявлено, что динамика прироста общего тестостерона в крови значительно не влияла на динамику изменения выраженности депрессии (рис. 9).
- Среднее значение уровня ситуативной тревожности в баллах среди пациентов мужского пола в начале исследования составило 41±3,3 при p≤0,05, через 3 месяца после начала терапии – 31,1±2,8 при p≤0,05. На фоне терапии уровень ситуативной тревожности в баллах снижался в среднем на 9,6±1,9 балла при p≤0,05, что демонстрирует статистически достоверное снижение уровня ситуативной тревожности в баллах в данном объеме выборки. Установлено, что чем больше был прирост уровня общего тестостерона в крови, тем более выражена была динамика изменения выраженности ситуативной тревожности. При этом динамика изменения выраженности ситуативной тревожности была значима, начиная с прироста уровня общего тестостерона в крови более 21,18 нмоль/л (рис. 10).
- Среднее значение уровня личностной тревожности в баллах среди пациентов мужского пола в начале исследования составило 48,6±2,2 при p≤0,05, через 3 месяца после начала терапии – 46,7±2,5 при p≤0,05. На фоне терапии уровень личностной тревожности в баллах снижался в среднем на 1,9±0,6 балла при p≤0,05, что демонстрирует отсутствие статистически достоверного снижения уровня личностной тревожности в баллах в данном объеме выборки.
- Среднее значение степени тяжести инсомнии в баллах среди пациентов мужского пола в начале исследования составило 10,9±1,6 при p≤0,05, через 3 месяца после начала терапии – 9,5±1,8 при p≤0,05. На фоне терапии степень тяжести инсомнии в баллах снижалась в среднем на 1,4±0,4 балла при p≤0,05, что демонстрирует отсутствие статистически достоверного снижения степени тяжести инсомнии в баллах в данном объеме выборки.
Методом ранжирования выделено 2 наиболее значимых диапазона уровня общего тестостерона в крови на фоне проведенной терапии. При достижении значений уровня общего тестостерона в крови от 13,0 до 22,0 нмоль/л среднее значение баллов по ВАШ за последние 4 недели составило 2,1±0,9 при p≤0,05. При достижении значений уровня общего тестостерона в крови выше 22,0 нмоль/л среднее значение баллов по ВАШ за последние 4 недели составило 0,33±0,7 при p≤0,05 т.е. обеспечило ремиссию болевого синдрома у 88,9 % пациентов.
В ходе проведенного исследования побочные эффекты отмечены не были.

Обсуждение
Распространенность болевых синдромов среди пациентов мужского пола, по данным нашего исследования, составила 66%, что подтверждает необходимость расширения практики междисциплинарного взаимодействия между врачами разных специальностей с целью повышения эффективности терапии боли. Распространенность выявляемой боли в спине в нашем исследовании составила 20%, что примерно соответствует данным других исследований по выявлению боли в спине на амбулаторном приеме [15, 16].
Продемонстрировано, что коррекция андрогенодефицита приводит к к статистически достоверному снижению выраженности боли, степени нарушения жизнедеятельности, уровня депрессии и ситуативной тревожности среди пациентов мужского пола с хронической неспецифической болью в спине, что коррелирует с выводами других авторов о влиянии коррекции андрогенодефицита на снижение выраженности болевого синдрома и других клинических показателей при таких паталогиях, как мигрень, фибромиалгия, синдром хронической тазовой боли [9–11].
По нашим данным, наиболее благоприятные целевые значения уровня общего тестостерона в крови пациентов мужского пола, соответствовавшие отсутствию или минимальным жалобам на наличие боли, составили ≥22,0 нмоль/л. Необходимы дальнейшие исследования для оценки возможности экстраполяции данного лабораторного критерия на другие болевые синдромы.
По результатам проведенного исследования можно с уверенностью утверждать, что коррекция андрогенодефицита препаратами тестостерона и/или ХГ показана пациентам мужского пола с хронической неспецифической болью в спине.
Ограничения исследования
Необходимо отметить сложность в наборе пациентов для проведенного исследования ввиду пока еще малого числа медицинских учреждений, специализирующихся на профессиональном лечении пациентов мужского пола с андрогенодефицитом и готовых к активному междисциплинарному взаимодействию, что обусловливает малый размер выборки.
Заключение
Результат нашего исследования – первый российский опыт изучения влияния коррекции андрогенодефицита (препаратами тестостерона и/или ХГ) на уровень боли, уровень тревоги, депрессию, качество сна у пациентов мужского пола с хронической неспецифической болью в спине.
Полученные результаты дают основание считать перспективным продолжение научно-исследовательской работы с целью практического использования препаратов, способствующих повышению уровня тестостерона в крови (препараты тестостерона и/или ХГ) для оптимизации противоболевой терапии пациентов мужского пола.
Полученные данные согласуются с таковыми других авторов о том, что коррекция андрогенодефицита повышает эффективность противоболевой терапии.
Нами были разработаны следующие практические рекомендации по оптимизации противоболевой терапии пациентов мужского пола с андрогенодефицитом и сопутствующей хронической неспецифической болью в спине:
- при разработке терапевтических программ у пациентов мужского пола с хронической неспецифической болью в спине необходимо учитывать влияние уровня общего тестостерона в крови на степень выраженности болевого синдрома, степень нарушения жизнедеятельности, уровень депрессии и ситуативной тревожности;
- при разработке терапевтических программ для пациентов мужского пола с андрогенодефицитом и хронической неспецифической болью в спине необходимо создание междисциплинарных лечебных групп с привлечением помимо врача-невролога врача-эндокринолога и/или врача-уролога;
- в процессе коррекции андрогенодефицита у пациентов мужского пола с хронической неспецифической болью в спине рекомендовано достижение целевых значений уровня общего тестостерона в крови не менее 22,0 нмоль/л;
- для контроля течения и эффективности лечения пациентов мужского пола с хронической неспецифической болью в спине целесообразно применять разработанный нами модифицированный краткий опросник боли.


