Боль в спине (БВС) служит источником страданий и причиной потери трудоспособности миллионов жителей нашей страны. Эффективная помощь этим людям – одна из приоритетных задач современной медицины. В первую очередь пациенты нуждаются в адекватном обезболивании вне зависимости от этиологических факторов, вызвавших БВС [1]. Современное понятие «неспецифическая боль в спине» вытеснило использовавшийся ранее диагноз «дорсопатия», заменивший в свою очередь широко распространенный ранее термин «остеохондроз». Высокая частота дегенеративно-дистрофического поражения позвоночника, выявляемая при рентгенографии у пациентов среднего и пожилого возраста, в середине прошлого века сформировала устойчивое представление у врачей и пациентов о зависимости боли от остеохондроза. Распространенность этого заблуждения в медицинской литературе привела к тому, что остеохондроз стал основной жалобой и одним из самых частых диагнозов пациентов с БВС, головными болями и даже головокружениями. Это привело к недопустимому пренебрежению клиническим обследованием пациента – врачи предпочитали не тратить время и силы на диагностический поиск, полагая, что причина боли все равно кроется в дегенеративно-дистрофическом поражении позвоночника. Однако многочисленные исследования показали, что выраженность рентгенологических проявлений остеохондроза позвоночника не соотносится с локализацией, характером, интенсивностью и длительностью болевого синдрома, из 10 пациентов с дегенеративно-дистрофическими изменениями в позвоночнике только один имеет клинические проявления БВС. Кроме того, «теорию остеохондроза» опровергает сохранность патологических изменений анатомических структур позвоночника при наличии рецидивирующего течения болевого синдрома. Поэтому наличие рентгенологических проявлений остеохондроза у пациента не должно определять ни лечебной, ни экспертной тактики [2, 3].
Другой распространенный предрассудок касается грыжи межпозвоночного диска. Так ли она опасна на самом деле и следует ли ее лечить? Бессимптомные грыжи межпозвонковых дисков встречаются во много раз чаще тех грыж, которые вызывают боль в спине, а точнее – в спине и конечности (радикулопатию). И размер здесь также не имеет значения – главными определяющими факторами, обусловливающими наличие и характер болевого синдрома, являются направление, в котором пролабирует грыжа, и выраженность аутоиммунной воспалительной реакции организма в ответ на пролабирование пульпозного ядра через дефект фиброзного кольца. Если грыжа направлена в тело позвонка (т.н. грыжа Шморля) или в центр позвоночного канала (медиальная грыжа), то после стихания выраженности первичного воспалительного процесса она будет бессимптомной – радикулопатия не разовьется. Хронизация БВС у таких пациентов будет, скорее всего, связана со снижением высоты межпозвоночного диска, снижением его амортизирующей функции и перераспределением нагрузки на фасеточные суставы пораженного позвоночного двигательного сегмента, что приводит к прогрессированию остеоартроза из-за функциональной перегрузки и деформации сустава с рефлекторными мышечно-тоническими синдромами [2]. Таким образом, пациенты, имеющие медиальные грыжи межпозвонковых дисков или грыжи Шморля, чаще всего не предъявляют жалоб либо страдают неспецифической БВС, обусловленной фасеточным синдромом. Только латеральные грыжи, механически повреждающие корешки нервов или вызывающие вторичные ишемические и дизиммунные процессы, по-настоящему опасны в отношении развития радикулопатии. Заподозрить такую грыжу можно, если боль из спины распространяется в руку или ногу и сопровождается слабостью и чувствительными расстройствами в конечности, симптомами натяжения корешка. Но и такая грыжа не является «приговором к операции». Современные медицинские технологии позволяют проводить лечение как фасеточного синдрома, так и радикулопатий без операции: малоинвазивными интервенционными методами и лечебной физкультурой [2– 4]. При консервативной терапии радикулопатий наблюдается типичная ситуация: на фоне лечения (или даже без оного) БВС исчезает, хотя грыжа остается прежних размеров и на прежнем месте. Проспективные наблюдения за пациентами с компрессионной радикулопатией показывают спонтанное уменьшение грыж и компрессии неврального содержимого даже в отсутствие терапии [2, 5].
Во врачебной среде распространен предрассудок, будто лечение боли должно в первую очередь воздействовать на этиологические факторы, например направлено на компенсацию разницы длины ног, терапию дегенеративных изменений хряща фасеточных суставов, включать удаление грыжи межпозвоночного диска и т.д., однако этиотропная терапия часто не прекращает ни острую, ни хроническую боль. Это связано с тем, что в основе острых болей чаще всего лежат воспаление и стойкий мышечный спазм, а это значит, что необходимо патогенетическое лечение противовоспалительными препаратами для быстрого купирования болевого синдрома, а также миорелаксантами для прерывания порочного круга «боль–спазм–боль». Далее, следуя принципу «лечить не болезнь, а больного», безусловно необходимо этиотропное воздействие на модифицируемые факторы хронизации боли – изменение образа жизни больного, психотерапевтическое воздействие на психологические факторы кинезиофобии, компенсация разницы длины ног, восстановление биомеханики движения в позвоночнике и т.д. [2]. Однако у пациентов со сформировавшимся симптомокомплексом хронической БВС этиотропная терапия также будет малоэффективной. Основой хронизации боли являются изменения в центральной и периферической нервной системе (периферическая и центральная сенситизация, снижение нисходящих ингибирующих влияний антиноцицептивной системы), которые как бы «отрывают» боль от первопричины заболевания, делая ее самостоятельной болезнью. Здесь требуется патогенетическое лечение антидепрессантами или антиконвульсантами [1, 3].
При терапии острой БВС имеется необходимость максимально быстро избавлять пациента от мучительных болей во избежание хронизации заболевания, вызванной сенситизацией периферической и центральной нервной систем, «бомбардируемых» болевыми импульсами от воспаленных мышц, связок, фасеточных суставов и других структур позвоночника. Это достигается применением препаратов для симптоматического и патогенетического лечения боли, прежде всего нестероидных противовоспалительных препаратов (НПВП) и миорелаксантов, что попросту недоступно для этиотропной терапии, при которой для достижения эффекта необходим продолжительный период времени. Для профилактики хронизации острой скелетно-мышечной БВС необходимо как можно раньше начать обезболивающую терапию и ограничить нагрузку на пораженный отдел позвоночника путем фиксации специальными ортопедическими пособиями (корсетом, шиной Шанца — в зависимости от пораженного отдела). Микротравмы в процессе реабилитации способны вызывать кинезиофобию (страх движения), а также ускорять процессы хронизации, растормаживая (сенситизируя) потоком афферентной болевой информации соответствующие отделы спинного и головного мозга. В связи с этим современный подход к лечению острой БВС подразумевает максимально раннее назначение препаратов, воздействующих в первую очередь на патофизиологические механизмы боли независимо от этиологической природы ее развития [1–3].
Ключевым направлением в симптоматическом и патогенетическом лечении боли в спине является применение НПВП, блокирующих выработку медиаторов воспаления – простагландинов – за счет ингибирования фермента циклооксигеназы (ЦОГ). Открытие двух изоформ ЦОГ — тканевой (или конституциональной) ЦОГ-1, постоянно присутствующей в большинстве тканей (осуществляющей синтез простагландинов, участвующих в реализации физиологических функций), и индуцибильной – ЦОГ-2, существенно увеличивающей свой уровень на фоне воспаления, позволило лучше понимать механизмы, лежащие в основе эффективности и токсичности НПВП. Обе изоформы ЦОГ продуцируются и в периферических тканях, и в клетках ЦНС. ЦОГ-2 образуется в зоне воспаления и в клетках спинного и головного мозга под действием повреждающих стимулов с периферии. Неселективные НПВП блокируют активность обеих изоформ ЦОГ, что приводит к ряду побочных эффектов, связанных с ингибированием ЦОГ-1, прежде всего к поражению желудочно-кишечного тракта (ЖКТ), причем на всем его протяжении (стоматит, эзофагит, гастрит, язва желудка и двенадцатиперстной кишки, энтерит, язвенный колит, проктит). Однако высокая селективность в отношении ЦОГ-2 может иметь чрезмерный и нежелательный для организма характер: при использовании высокоселективных ингибиторов ЦОГ-2 возможно повышение кардиоваскулярных рисков [5]. В связи с этим обращают на себя внимание НПВП, сбалансированно ингибирующие ЦОГ-1/ЦОГ-2, такие как Ксефокам (лорноксикам).
 Ксефокам обладает выраженной анальгетической и противовоспалительной активностью, характеризуясь при этом низким риском возникновения побочных явлений. Это объясняется особенностями фармакокинетики и фармакодинамики лорноксикама.
Ксефокам обладает выраженной анальгетической и противовоспалительной активностью, характеризуясь при этом низким риском возникновения побочных явлений. Это объясняется особенностями фармакокинетики и фармакодинамики лорноксикама.
В отличие от других НПВП Ксефокам не оказывает ингибирующего влияния на активность фермента 5-липоксигеназы и, таким образом, не подавляет синтез лейкотриенов, шунтируя метаболизм арахидоновой кислоты на 5-липоксигеназный путь; арахидоновая кислота и ее липооксигеназные метаболиты могут действовать как ретроградные медиаторы, стимулирующие переработку болевых импульсов в спинном мозге. Кроме того, Ксефокам обладает более коротким, чем другие оксикамы, периодом полувыведения (3–4 часа), что также способствует снижению частоты возникновения нежелательных явлений, особенно со стороны ЖКТ. Еще одной особенностью механизма действия Ксефокама является стимуляция выработки эндогенных динорфина и эндорфина, что свидетельствует о способности препарата оказывать влияние на центральные звенья патогенеза болевого синдрома.
Метаболизм лорноксикама происходит в печени под действием цитохрома Р450 с образованием фармакологически неактивных метаболитов, 1/3 из них выводится через почки и 2/3 – через ЖКТ, при этом энтеропеченочная циркуляция отсутствует. Двойной путь экскреции препарата снижает нагрузку на органы и улучшает переносимость, поэтому при легкой и умеренной степени печеночной и/или почечной недостаточности коррекции его дозы не требуется. Таким образом, Ксефокам обладает хорошей переносимостью по сравнению с другими НПВП.
Анальгетический эффект НПВП проявляется прежде всего в отношении БВС слабой и умеренной интенсивности [2]. Однако в силу своей выраженной анальгетической активности Ксефокам применяется и при интенсивных болях. Так, при острейших радикулярных болях воздействие Ксефокама обеспечивает обезболивание, эквивалентное тому, которое достигается при применении опиоидов, таких как морфин, петидин и трамадол. Ксефокам, как и другие НПВП, обладает опиоидсберегающим эффектом, т.е. его применение позволяет снижать количество принимаемых опиоидов и сводить к минимуму связанные с ними нежелательные явления, а также развитие лекарственной зависимости.
На российском рынке Ксефокам представлен в трех различных лекарственных формах:
- Ксефокам стандартные таблетки 8 мг.
- Ксефокам лиофилизат для приготовления раствора для внутривенных и внутримышечных инъекций, в 1 флаконе 8 мг лорноксикама.
- Ксефокам Рапид – быстроабсорбируемые таблетки 8 мг.
Рекомендуемая доза для однократного приема Ксефокама составляет 8 мг, максимальная суточная – 16 (24 мг в первый день лечения для Ксефокам Рапид) с интервалами между приемом 8–12 часов. Обезболивающий эффект при использовании стандартных таблеток Ксефокама развивается в течение 45–60 минут и продолжается более 8 часов. Отдельного упоминания заслуживает Ксефокам Рапид – быстроабсорбируемые таблетки. Эта форма была разработана специально для быстрого и эффективного лечения острой боли: обезболивание начинается приблизительно через 20–30 минут после перорального приема Ксефокама Рапид, что сопоставимо со скоростью наступления эффекта при внутримышечном введении Ксефокама. Следовательно, время начала обезболивающего действия препарата сокращается в 2 раза по сравнению со стандартной таблетированной формой. Это достигается благодаря уникальному составу и конструкции таблетки Ксефокам Рапид: лорноксикам в ней помещен в микрогранулы, покрытые буферным веществом. Вступая в реакцию с желудочным соком, покрытие гранул создает слабощелочную среду, в которой лорноксикам быстро растворяется и всасывается в кровь. Инъекционная форма Ксефокама активно применяется в интервенционной терапии для инфильтрации триггерных точек при миофасциальных болях в спине.
Следует отметить, что при острой БВС НПВП не рекомендуются для монотерапии более 10–14 дней. Если недельный курс приема препарата не купирует болевой синдром, это должно побудить врача пересмотреть тактику лечения с привлечением невролога, который поможет разобраться в структуре болевого синдрома с целью выявления признаков «серьезной патологии» и выяснить причины неэффективности НПВП в каждом конкретном случае [1, 5]. А причин такой неэффективности может быть несколько: плохое кровоснабжение в очаге воспаления (тогда противовоспалительный препарат можно ввести адресно прямо в центр боли и воспаления путем инъекции с местным анестетиком под ультразвуковым или рентгеноскопическим контролем) или стойкий спазм паравертебральных мышц с формированием порочного круга «боль–спазм–боль» [5]. При мышечно-тонических болевых синдромах и при хронизации БВС НПВП становятся недостаточно эффективными в качестве монотерапии. Они просто не способны «успокоить» расторможенные отделы нервной системы. Для воздействия на патогенетические механизмы хронификации БВС (прежде всего на мышечный спазм) на втором этапе лечения используют миорелаксанты (баклофен 10–30 мг/сут, тизанидин 6–12 и толперизон 150–450 мг/сут). Основным механизмом действия вышеперечисленных препаратов является торможение возбуждения двигательного нейрона в ответ на болевые стимулы и эмоциональный дискомфорт. Альфа2-адреномиметик тизанидин нормализует повышенный мышечный тонус, блокируя выделение возбуждающего нейротрансмиттера глутамата в двигательных нейронах переднего рога спинного мозга, а также активирует нисходящие антиноцицептивные влияния голубого пятна ствола мозга. Блокатор натриевых каналов толперизон подавляет ретикулоспинальные растормаживающие воздействия на γ-мотонейроны, регулирующие тонус мышц. Активатор рецепторов γ-аминомасляной кислоты (ГАМК) баклофен опосредованно воздействует на кальциевые каналы двигательных и чувствительных нейронов спинного мозга, подавляя медленные постсинаптические потенциалы, суммирующиеся в болевые импульсы и повышение тонуса мышц, а также уменьшая возбудимость нейронов лимбической системы и, соответственно, тревожность пациентов. Этим свойством, хоть и в меньшей мере, обладает «дневной транквилизатор» Фенибут (Ноофен), также воздействующий через ГАМК-рецепторы. Таким образом, миорелаксанты оказывают обезболивающее действие, помогая расторможенным отделам нервной системы вернуться в состояние покоя, т.е. стирая «болевую память». Это не только уменьшает выраженность боли при хроническом болевом синдроме, но и предотвращает усиление острой боли и переход ее в хроническую форму [1, 3, 5].
В отсутствие противопоказаний возможно дополнить лечение немедикаментозной терапией: тепловыми физиопроцедурами, мануальной терапией, вакуумным и ручным массажем. В некоторых случаях релаксации паравертебральных мышц и восстановления микроциркуляции в миофасциальных триггерных зонах удается достигать без дополнительного медикаментозного воздействия при применении ЛФК и физиотерапевтических методов [2]. Следует отметить, что на первом и втором этапах лечения пациенты с острыми БВС не нуждаются в обязательной консультации невролога или ревматолога и представляют контингент больных для врачей общей практики, а затем – врача ЛФК. При острых скелетно-мышечных БВС нет необходимости в соблюдении постельного режима даже в первые дни заболевания, а также в использовании опоры при передвижении (трости или костыля). Необходимо убедить пациента, что небольшая физическая нагрузка не опасна, посоветовать поддерживать повседневную активность, а после купирования острого болевого синдрома как можно скорее приступить к работе, не забывая при этом о лечебной физкультуре, необходимой для предотвращения последующих эпизодов БВС [1–3, 5].
Дополнительным и наиболее эффективным малоинвазивным методом терапии скелетно-мышечных БВС на любом этапе лечения оказывается локальное инъекционное введение лекарственного препарата (блокада), обладающего противоотечным и противовоспалительным действием, в очаг воспаления и/или устойчивого мышечного спазма. Интервенционные методы лечения боли широко используются во всем мире более 100 лет. Их первооткрывателем считается Василий Константинович фон Анреп, который в 1879 г., проводя на себе эксперименты, первым в мире открыл местное анестезирующее действие кокаина, разработал дозирование и методику его применения. По своему назначению блокады подразделяются на диагностические, прогностические и лечебные. С помощью диагностических блокад осуществляется уточнение диагноза ex juvantibus. Цель прогностической блокады – обозначить границы эффективности лечения и дать временно почувствовать пациенту, что он будет испытывать после более инвазивной процедуры (высокочастотной денервации сустава или деструкции нерва) и сможет ли он переносить чувствительные и вегетативные нарушения, возникшие в результате данного воздействия [4, 7].
При проведении лечебных блокад используется большой арсенал медикаментозных средств, что, с одной стороны, определяется фармакодинамикой и механизмом их действия, с другой – этиопатогенетическими особенностями развития боли.
Требования к препаратам для интервенционной терапии предъявляются по трем основным характеристикам:
- Эффективность:
- быстрое наступление обезболивающего действия (в течение минут или часов);
- продолжительность обезболивающего действия;
- доказанность эффективности применяемых препаратов в ходе рандомизированных клинических исследований по стандартам GCP.
- Безопасность:
- отсутствие системных побочных эффектов, серьезно ухудшающих состояние здоровья пациента;
- отсутствие локальной нейротоксичности, некроза ткани в месте введения.
- Хорошая переносимость процедуры введения препарата (отсутствие непереносимого усиления боли во время и после блокады)
Применяемые для малоинвазивной терапии препараты делятся на две группы: основные (базовые) и дополнительные. В связи с быстрым наступлением обезболивающего действия в качестве базового средства для всех видов блокад (лечебных, диагностических или прогностических) наибольшее применение нашли местные анестетики [1, 5, 7]. К сожалению, продолжительность действия местных анестетиков составляет несколько десятков минут, кроме того, они не обладают противовоспалительной, миорелаксирующей и противоотечной активностью, поэтому длительное лечебное действие при их использовании в большинстве случаев невозможно.
К числу дополнительных препаратов, применяющихся для лечения боли в интервенционной терапии миофасциальных, фасеточных и радикулярных болей [4–11], а также тоннельных синдромов [12–14], относятся гормональные средства (глюкокортикостероиды – ГКС), использование которых основано на их противовоспалительном, десенсибилизирующем и противоотечном действиях как локально в тканях, так и системно в организме [4, 9, 12, 13]. Во избежание осложнений запрещается внутрисосудистое вливание ГКС, перед инъекцией препарата всегда проводится аспирационная проба: поршень шприца оттягивают назад; при появлении в шприце крови необходимо изменить положение иглы, чтобы исключить попадание препарата в артерию или вену. Длительная терапия ГКС может приводить к отклонениям в работе эндокринной и пищеварительной систем, а также к нарушениям обмена веществ. Тем не менее ГКС были и остаются наиболее распространенными (после анестетиков) препаратами для интервенционной терапии боли, эффективность которых доказана в 45 рандомизированных исследованиях [11]. Поскольку инъекции ГКС могут сопровождаться рядом серьезных местных и системных осложнений, повторные инъекции в одну область должны проводиться не ранее, чем через 2–3 недели после первого введения. Если эффект после 1–2 инъекций недостаточен, повторные введения проводить нецелесообразно. Не следует осуществлять более трех инъекций в одну область в течение года [1].
 Альтернативными дополнительными препаратами, лишенными побочных эффектов, характерных для системного действия ГКС, являются НПВП. Они применяются преимущественно для инфильтрации триггерных зон мышц при миофасциальных синдромах и периартикулярных блокад при фасеточных синдромах. Описано применение лорноксикама для локальной инъекционной терапии при миофасциальных болевых синдромах, для футлярных блокад (например, при тоннельных синдромах). Локальное инъекционное введение лекарственного препарата, обладающего противоотечным и противовоспалительным действиями, в очаг воспаления и устойчивого мышечного спазма считается наиболее эффективным методом терапии миофасциальных болевых синдромов [1, 2, 5, 8]. Наш собственный клинический опыт показывает эффективность и безопасность 8 мг лиофилизата Ксефокама у пациентов с отягощенным соматическим анамнезом (сахарный диабет, артериальная гипертензия, ИБС и т.п.).
Альтернативными дополнительными препаратами, лишенными побочных эффектов, характерных для системного действия ГКС, являются НПВП. Они применяются преимущественно для инфильтрации триггерных зон мышц при миофасциальных синдромах и периартикулярных блокад при фасеточных синдромах. Описано применение лорноксикама для локальной инъекционной терапии при миофасциальных болевых синдромах, для футлярных блокад (например, при тоннельных синдромах). Локальное инъекционное введение лекарственного препарата, обладающего противоотечным и противовоспалительным действиями, в очаг воспаления и устойчивого мышечного спазма считается наиболее эффективным методом терапии миофасциальных болевых синдромов [1, 2, 5, 8]. Наш собственный клинический опыт показывает эффективность и безопасность 8 мг лиофилизата Ксефокама у пациентов с отягощенным соматическим анамнезом (сахарный диабет, артериальная гипертензия, ИБС и т.п.).
Для безопасности проведения интервенционной терапии не рекомендуется использование «коктейлей» из нескольких препаратов. Использование в качестве дополнительных препаратов хондропротекторов, антигомотоксических и гомеопатических средств, плазмы, обогащенной тромбоцитами, не продемонстрировало эффективности в ходе рандомизированных исследований, выполненных по стандартам GCP [1]. Вероятно, что наблюдаемое клиническое улучшение при использовании этих веществ для блокад связано с физиотерапевтическим действием «сухой пункции» триггерной точки иглой и плацебо-эффектом. Использование для интервенционной терапии препаратов центрального и системного действий (сульпирид, толперизон, витамины группы В, Цитофлавин, Актовегин и т.п.) вообще лишено всякого смысла: в периферических тканях они не обладают противовоспалительным или противоотечным действиями, а достичь терапевтической концентрации в головном мозге и сыворотке крови вполне возможно и при пероральном приеме, не рискуя возникновением побочных эффектов, связанных с локальным введением в мышцы: от аллергических реакций до некроза тканей – синдром Николау [15, 16].
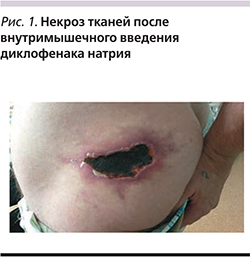
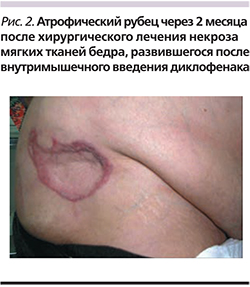
Синдром Николау (синоним: медикаментозная эмболия кожи) – симптомокомплекс осложнений эмболической природы после внутримышечного введения препаратов (рис. 1, 2). По одной из версий, к его развитию может приводить локальное повышение уровня креатинфосфокиназы (КФК) в месте введения (многие инъекционные формы препаратов, например диклофенака, повышают КФК, что делает сами инъекции довольно болезненными, а после них образуются уплотнения или «шишки»). Это осложнение интервенционной терапии было впервые описано W. Freudenthal в 1924 г. и S. Nicolau в 1925 г. как редкая местная реакция на внутримышечные инъекции солей висмута, использовавшихся в то время для лечения сифилиса. Обычно проявляется побледнением и резкой болью в месте инъекции. Побледнение быстро сменяется эритемой, которая через сутки преобразуется в ретикулярное ливедо («мраморный» вид кожи) синюшно-багрового цвета. Эти сетчатые или пятнистые синюшные участки пропитываются геморрагическим экссудатом и некротизируются. Участки некроза сливаются между собой. Кроме кожи часто наблюдается некроз подкожной жировой клетчатки и мышц (рис. 1). Отграничение некроза наступает через 1–2 недели. В конечной стадии струп из некротизированной ткани отторгается с образованием язв, которые очень медленно, в течение нескольких месяцев, заживают с образованием атрофического рубца (рис. 2). К настоящему времени этот синдром описан как реакция на внутримышечное введение диклофенака, фенилбутазона, местных анестетиков, антигистаминных препаратов, ГКС, пенициллина, цианокобаламина и других лекарственных средств.
Помимо лечебных целей в ряде случаев проведение блокад необходимо для диагностики и определения оптимальной стратегии последующего лечения. Так, например, диагностическая блокада фасеточного сустава или крестцово-подвздошного сочленения раствором местного анестетика (2%-ный лидокаин или 0,5%-ный новокаин) позволяет не только определить источник боли в спине, но и предсказать эффективность малоинвазивной нейрохирургической процедуры – высокочастотной денервации сустава [4, 17]. Понятно, что без НПВП и/или ГКС длительность обезболивающего действия анестетика составит всего лишь несколько часов, но в случае исчезновения у пациента после блокады болевого синдрома хотя бы на час мы можем уверенно говорить о том, что процедура денервации будет эффективной: в этом случае блокаду можно рассматривать как прогностическую.
Таким же образом определяется прогноз эффективности внутридисковой электротермической аннулопластики, лазерной вапоризации или холодноплазменной аблации межпозвонкового диска при радикулопатии. Если интрафораминальное введение анестетика под контролем компьютерной томографии устраняет болевой синдром, то проведение вышеуказанных малоинвазивных пункционных нейрохирургических воздействий может быть эффективным [7, 9, 18]. Следует отметить, что в ряде случаев достаточный терапевтический эффект имеет интрафораминальное или сакральное эпидуральное введение вместе с местным анестетиком раствора ГКС, обеспечивающего патогенетическое воздействие на аутоиммунные и компрессионно-ишемические механизмы диско-радикулярного конфликта (противовоспалительное, противоотечное и ремиелинизирующее действия) [9, 10, 19] или НПВП [6, 20].
Обычно успешно проведенной фораминальной блокады бывает достаточно, чтобы уменьшить выраженность болевых ощущений и чувствительных (а иногда и двигательных) расстройств до следующего обострения радикулопатии, вызванного неправильным образом жизни больного. В случае недостаточной по времени эффективности лечебных фораминальных блокад и при условии наличия несеквестрированной латеральной (фораминальной) грыжи диска, менее 7 мм, проводится малоинвазивная процедура лазерной вапоризации (или ее модификации – фораминопластики), холодноплазменной аблации или внутридисковой электротермической аннулопластики, эффективной для 50–65% пациентов [18]. Если и эта пункционная процедура не приводит к регрессу болевого синдрома, тогда производится оперативное нейрохирургическое вмешательство открытым доступом. Вопрос о проведении пункционных или открытых нейрохирургических вмешательств при БВС ставится в случае неэффективности правильно проводимой консервативной терапии в течение трех месяцев. К сожалению, нередко оперативное вмешательство проводится в отсутствие должных показаний (прогрессирующий парез иннервируемых пораженным корешком мышц конечности, тазовые нарушения, перемежающаяся хромота, вызванная стенозом позвоночного канала), что чревато формированием хронического постдискэктомического болевого синдрома, обусловленного множеством факторов (нарушением биомеханики движения в оперированном сегменте позвоночника, спаечным процессом, хроническим эпидуритом и т.п.) [5, 21, 22]. Определение целесообразности оперативного лечения радикулопатии у пациента с грыжей межпозвоночного диска должно являться прерогативой невролога, но окончательное решение о тактике лечения все равно остается за больным. Немаловажным фактором для достижения положительного результата может быть желание пациента сделать блокаду или быть прооперированным, а также его убежденность в отношении пользы данного метода лечения при условии полной информированности со стороны лечащего врача. Если больным положительно воспринимаются более инвазивные методы лечения или если психосоциальные или экономические факторы требуют более быстрого восстановления, рассмотрение хирургического лечения оправданно.
Безусловно, интервенционная терапия требует наличия специальных навыков врача, осуществляющего малоинвазивную процедуру, а в ряде случаев высокотехнологической аппаратуры, обеспечивающей правильное попадание иглы в пораженную область (компьютерный томограф, рентгенографическая установка с электронно-оптическим преобразователем или ультразвуковой сканер). Современные технологии навигации позволяют не допустить таких осложнений, как пневмоторакс, повреждение нерва (постинъекционная невропатия), повреждение спинного мозга (постинъекционная миелопатия), повреждение ствола мозга. Но даже использование высоких медицинских технологий не всегда позволяет избегать нежелательных явлений при проведении интервенционной терапии, таких как аллергические реакции, синдром Николау, эпилептический приступ, побочные эффекты препаратов, инфекционные осложнения, кровотечения, фатальные аритмии, в т.ч. приводящие к летальным исходам. Именно поэтому интервенционные методы лечения боли должны использоваться в медучреждениях, имеющих необходимое реанимационное оборудование и квалифицированный персонал.
Анализ литературных данных, касающихся диагностики и лечения боли, а также наш собственный клинический опыт показывают, что ни один из отдельно применяющихся методов интервенционного и неинтервенционного фармакологического, физического или психологического лечения БВС не может сравниться по своей эффективности с мультидисциплинарным подходом, когда все вышеуказанные методы, назначенные вместе в одном комплексе, взаимнопотенцируются: когнитивно-поведенческая психотерапия помогает скорректировать неправильные, пpепятствующие выздоpовлению пpедставления пациента о пpиpоде своего заболевания, изменить социальное подкрепление болевого поведения, уменьшить зависимость от анальгетической терапии, а методики лечебной физкультуры помогают восстановить нормальный двигательный стереотип, оптимизировать идеомоторику (измененную вследствие пластических процессов в нейроматриксе, приводящих к реорганизации сенсорной и моторной коры и подкорковых структур) и увеличить уровень повседневной активности (сниженный за счет кинезиофобии) [1, 2, 5, 23].



