Введение
Ревматоидный артрит (РА) – одно из наиболее частых ревматических заболеваний, характеризующееся воспалением синовиальной оболочки суставов, деструкцией хрящевой и костной ткани, развитием широкого спектра внесуставных проявлений. На всех этапах иммунного воспаления ключевую роль играет цитокиновый каскад. Первыми пусковыми цитокинами являются фактор некроза опухоли α (ФНО-α) и интерлейкин-1 (ИЛ-1), которые продуцируются в основном активированными Т-клетками, моноцитами, макрофагами, фибробластами и эндотелиоцитами. ФНО-α и ИЛ-1 индуцируют выработку друг друга и обладают сходной биологической (провоспалительной) активностью [1]. Патогенетическая иммуносупрессивная терапия существенно улучшает клиническое состояние многих больных РА и качество их жизни. Прогресс в лечении ревматических заболеваний, наблюдающийся в последние годы, связан с разработкой принципиально новой группы лекарственных средств, которые получили название «биологические агенты». Одним из первых препаратов этого класса, примененных в ревматологической практике, был инфликсимаб, который представляет собой химерные IgG1- моноклональные антитела, состоящие на 75% из человеческого и на 25% из мышиного белка [2–6]. Однако для части пациентов возможность достижения стойкой ремиссии по-прежнему маловероятна, поэтому остается актуальной проблема поиска предикторов неудовлетворительного ответа на базисную противовоспалительную, в т.ч. генно-инженерную биологическую, терапию больных РА.
Целью исследования стала оценка цитокинового профиля у больных РА, получавших базисные противовоспалительные препараты в комбинации с генно-инженерными био-логическими препаратами, с изучением взаимосвязи лабораторных показателей с клиническими проявлениями заболевания и эффектом от лечения.
Материал и методы
Под наблюдением в течение 30 недель находились 18 больных достоверным РА (диагноз устанавливался согласно классификационным критериям ACR/EULAR, 2010). Все обследованные пациенты были женщинами, средний возраст которых составлял 46±8,4 года. Средняя длительность заболевания – 13,2±5,3 года. Семейный анамнез РА ни у кого из больных не прослеживался.
Индекс массы тела оценивался по формуле=масса тела (кг)/рост (м)2. Серопозитивный РА выявлен у 83,3% пациентов, серонегативный – у 16,7%, АЦЦП-позитивный – у 66,8%. Наиболее часто среди больных встречались III и IV рентгенологические стадии заболевания у 66,8%, II – у 16,6%, I – у 16,6%. Внесуставные проявления РА в виде анемии легкой степени (средний уровень эритроцитов – 4,06×1012/л, средний уровень гемоглобина – 118±7,25 г/л). Все пациенты получали метотрексат (МТ) в дозе 12,5–20,0 мг в неделю (средняя продолжительность лечения – 3,6 года) в сочетании с нестероидными противовоспалительными препаратами. Половина больных принимали глюкокортикостероиды в дозе (метилпреднизолон 8 мг/сут) на протяжении не менее 16 месяцев. Инфликсимаб (ИФ) назначался из расчета 3 мг/кг массы тела, введение препарата осуществлялось по стандартной схеме. Проведены общеклиническое лабораторное обследование, диаскин-тест и рентгенография органов грудной клетки. Оценены гемограмма, СОЭ по Вестергрену (мм/ч) и СРБ (мг/л). Лабораторное определение концентраций ФНО-α и ИЛ-1 осуществлено с использованием наборов реагентов альфа-ФНО-ИФА-БЕСТ и ИНТЕРЛЕЙКИН-1-бета–ИФА–БЕСТ» АО «Вектор-бест» соответственно для иммуноферментного анализа в сыворотке крови человека (верхняя граница нормы ИЛ-1 – 11, ФНО-α – 6 пг/мл).
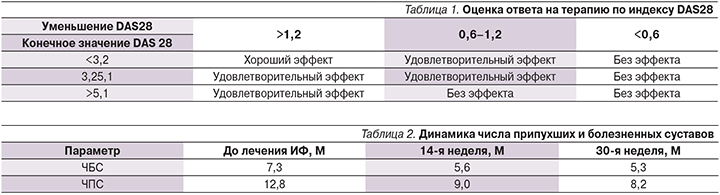
Активность заболевания оценена с помощью Disease Activity Score Calculator for Rheumatoid Arthritis (DAS28-CRP) с использованием четырех показателей: число припухших (ЧПС) и болезненных суставов (ЧБС) из 28 (учитываются лучезапястные, пястно-фаланговые, проксимальные межфаланговые кистей, плечевые, локтевые, коленные суставы), СРБ (мг/л), общая оценка состояния здоровья больных (ООСЗБ). Также учитаны такие показатели, как SDAI (упрощенный индекс активности болезни – Simplified Disease Activity Index), CDAI (клинический индекс активности болезни – Сlinical Disease Activity Index). Ответ на терапию оценен по индексу DAS28 в соответствии с федеральными клиническими рекомендациями 2013 г. (табл. 1).
Болевой синдром, длительность утренней скованности и показатель ООСЗБ оценены по визуальной аналоговой шкале (ВАШ; от 0 до 100, где 0 – минимальная выраженность симптома, а 100 – максимальная в мм) самими пациентами.
Оценка качества жизни проведена по опроснику Medical Outcomes Study-Short Form (MOS SF-36), включившему 36 вопросов, которые в целом формируют два компонента здоровья: физический (ФК) и психологический (ПК).
Оценка функционального статуса проведена при помощи опросника Health Assessment Questionnaire (HAQ), состоявшему из 20 вопросов, относившихся к активности пациента в повседневной жизни.
Статистический анализ данных выполнен с помощью программы «STATISTICA 6.0». Выборочные характеристики выражались как среднее (М). В качестве меры неопределенности применен расчет 95% доверительных интервалов (ДИ).
Результаты и обсуждение
У 100% больных отмечена высокая степень активности по DAS28-CRP, в среднем 5,6±0,6. У 55,5% пациентов масса тела была нормальной, у остальных 44,5% – предожирение.
У большинства пациентов уже после первой инфузии отмечена быстрая (в среднем через неделю) положительная динамика клинических и лабораторных проявлений РА. После 2-й и 3-й инфузий ИФ у 88,9% пациентов наблюдалось значительное клиническое улучшение (уменьшение болей и отечности пораженных суставов, длительности утренней скованности; увеличение объема движений в суставах), у остальных 11,1% имел место менее выраженный эффект. Динамика ЧБС и ЧПС на 14-й и 30-й неделях представлена в табл. 2.
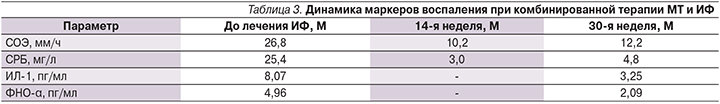
Данные, представленные в табл. 3, свидетельствуют о заметном снижении основных лабораторных показателей маркеров воспаления, а именно СОЭ и СРБ, что коррелирует с общей тенденцией уменьшения клинических проявлений РА и улучшения показателей качества жизни. Но с 30-й недели отмечается незначительное повышение значений указанных параметров, не выходящее за пределы нормы. Определение уровней ИЛ-1 и ФНО-α в сыворотке крови пациентов проведено до назначения ИФ и на 30-й неделе лечения. Для большинства больных полученные результаты существенно не выходили за рамки диапазона уровней в сыворотке условно здоровых доноров. Исключение составили двое больных, у которых концентрации ИЛ-1 и ФНО-α были выше нормы (в среднем 12,2 и 6,96 пг/мл соответственно), оба они вошли в группу с более выраженным эффектом от терапии по клинико-лабораторным показателям.

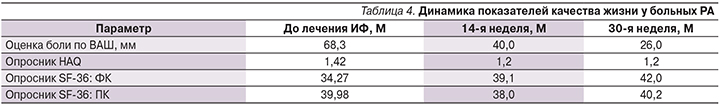
Наличие боли и функциональных ограничений негативно отразилось на всех параметрах качества жизни больных. Как следует из табл. 4, среднее значение боли по ВАШ на момент первичного осмотра составило 68,3 мм, затем этот показатель снизился через 14 недель лечения ИФ до 40,0 мм, а через 30 недель – до 26,0 мм. Средние значения ФК и ПК по опроснику SF-36 в начале наблюдения были равны 34,27 и 39,98 соответственно. На 14-й неделе лечения ИФ (после 4-го введения) средние их значения составили 39,1 и 38,0 соответственно, на 30-й неделе (после 6-го введения) – 42,0 и 40,2.
По результатам опросника HAQ среднее значение функционального статуса больных на начало исследования составило 1,42 (умеренное снижение качества жизни), а затем 1,2, что свидетельствует об улучшении данного показателя.
На представленном рисунке отчетливо видно снижение значений всех трех показателей активности заболевания: DAS28-CRP, CDAI и SDAI.
Была проведена оценка ответа на терапию по индексу DAS28-CRP: на 14-й неделе наблюдения группы с хорошим, удовлетворительным эффектом и без эффекта составили по 33,3%, на 30-й неделе комбинированного лечения ИФ и МТ группа с хорошим эффектом составила 33,3%, с удовлетворительным – 50%, а без эффекта – 16,7%. К 30-й неделе лечения значительно сократилось число пациентов без эффекта от терапии. При этом группы с хорошим и удовлетворительным ответом на комбинированную терапию МТ и ИФ составили пациенты с уровнем СРБ, превышающим верхнюю границу нормы более чем в 3 раза, внесуставными проявлениями в виде анемии легкой степени (колебания уровня гемоглобина от 109 до 117 г/л), меньшими значениями индекса массы тела (19,6–23,3 кг/м2), изначально более высокими показателями по DAS28-CRP и концентрациями ИЛ-1 и ФНО-α, которые снижались в ходе лечения.
Заключение
Результаты проведенного исследования свидетельствуют, что базисная противовоспалительная терапия в сочетании с генно-биологическими препаратами, в частности метотрексат с инфликсимабом, приводит к значительному улучшению клинико-лабораторных показателей, а именно заметному снижению уровней острофазовых маркеров воспаления, нормализации гемограммы, а также качества жизни пациентов с РА высокой активности. Группы с хорошим и удовлетворительным ответом на проводимую терапию к 30-й неделе лечения составили пациенты с меньшим индексом массы тела, более высокой степенью активности, более высокими концентрациями СРБ и сывороточных цитокинов, а именно ИЛ-1 и ФНО-α, а также с внесуставными проявлениями заболевания в виде легкой степени анемии. Таким образом, был выявлен определенный фенотип больных РА, от которых возможно ожидать в дальнейшем хороший эффект от комбинированной терапии метотрексатом и ингибитором ФНО-α.


