Введение
Сахарный диабет 2 типа (СД2) является независимым фактором риска развития сердечно-сосудистых заболеваний, а сердечно-сосудистые события остаются одной из ведущих причин нетрудоспособности и смертности 50% пациентов с СД2 [1, 2, 10, 14]. Основные сердечно-сосудистые заболевания, ассоциированные с СД2, включают ишемическую болезнь сердца, хроническую сердечную недостаточность, острое нарушение мозгового кровообращения и заболевания артерий нижних конечностей. Хроническая гипергликемия ассоциируется с риском как макро-, так и микрососудистых осложнений СД [3]. В то же время инсулинорезистентность при СД2 также сопровождается более высоким относительным риском сердечно-сосудистых осложнений [4]. Однако не только гипергликемия, но гипогликемические состояния являются фактором риска сердечно-сосудистых исходов при СД2 [5]. Вопрос, имеется ли достоверная связь между интенсивным контролем уровня глюкозы при СД и риском сердечно-сосудистыми осложнений у пациентов с СД2, до сих пор остается предметом широкой научной дискуссии. В ранних международных клинических исследованиях по сравнению со стандартным лечением в группе интенсивной терапии достижение целевого уровня гликированного гемоглобина <6,5% ассоциировалось с повышенной смертностью и не приводило к значимому снижению частоты сердечно-сосудистых событий [6]. Однако стоит учитывать, что пациенты получали терапию инсулином или секретагогами, а более трети включенных пациентов имели сердечно-сосудистые заболевания. Тем временем результаты последних крупнейших исследований, включивших терапию ингибиторами натрий-глюкозного котранспортера 2-го типа и агонистами рецептора глюкагоноподобного пептида-1 показали кардиопротекторный эффект. Тем не менее интенсивное снижение гликемии может быть связано с увеличением риска макрососудистых событий и сердечно-сосудистой смертности среди отдельных категорий пациентов, в первую очередь с высоким риском тяжелой гипогликемии.
Ингибиторы дипептидилпептидазы-4 (иДПП-4) относятся к относительно новому классу сахароснижающих препаратов для терапии СД2 с инкретин-направленным действием. Ранее проведенные исследования показали хороший профиль безопасности, устойчивый сахароснижающий эффект и наличие ряда преимуществ, реализующихся через инкретиннаправленное действие. Несмотря на результаты крупных рандомизированных клинических исследований по сердечно-сосудистым исходам, показавших безопасность иДПП-4 в отсутствие дополнительных преимуществ в улучшении прогноза и нейтральном влиянии класса на сердечно-сосудистые исходы, сравнимое с группой плацебо, нельзя с полной уверенностью исключать положительный эффект иДПП-4 для отдельных категорий пациентов с СД2 в перспективе. С учетом данных последнего субанализа исследования EXAMINE целью данной работы стало проведение систематического обзора исследований по оценке сердечно-сосудистой безопасности и эффективности иДПП-4 в двух подгруппах: у пациентов с сохранной функцией почек или начальной стадией хронической болезни почек (ХБП) со скоростью клубочковой фильтрации (СКФ) более 60 мл/мин без альбуминурии, а также в субпопуляции пациентов, получавших метформин в монотерапии и в дополнение к иДПП-4.
Методы
Проведен систематический обзор клинических исследований, в которых оценивали влияние терапии СД2 с использованием иДПП-4 на сердечнососудистые исходы в двух субпопуляциях пациентов:
- с различным уровнем СКФ;
- получавших в качестве базисной терапии СД2 метформин.
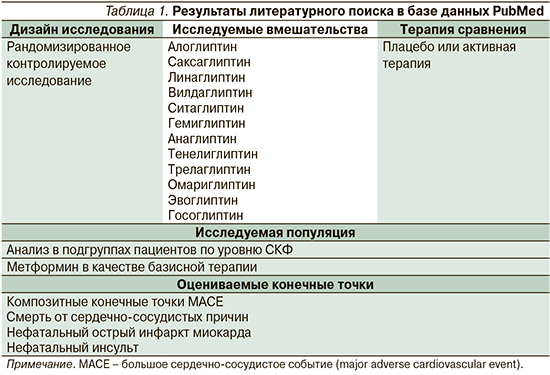
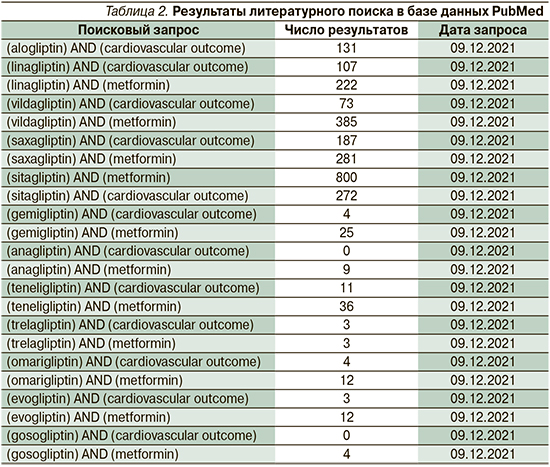
Поиск исследований выполнен в базе Национальной медицинской библиотеки Национальных институтов здоровья США PubMed. Критерии включения исследований в обзор приведены в табл. 1. Ключевые фразы, использованные для проведения поиска, а также результаты общей выдачи отражены в табл. 2. Поиск проводили без ограничений по дате публикации.
Результаты
В систематический обзор вошло 9 публикаций, остальные были исключены из обзора по причине несоответствия критериям включения по дизайну, оцениваемым параметрам или отсутствию данных в подгруппах интереса [7–15]. Критериям поиска соответствовали исследования алоглиптина, вилдаглиптина, саксаглиптина, ситаглиптина и линаглиптина.
Сердечно-сосудистые исходы в зависимости от функции почек
С целью оценки влияния нормальной и сниженной функций почек на сердечно-сосудистые исходы при терапии иДПП-4 проанализированы результаты исследований EXAMINE, TECOS, SAVOR-TIMI-53 и CARMELINA, включивших терапию алоглиптином, саксаглиптином, ситаглиптином и линаглиптина. Данные о дизайне исследований и исходных характеристиках включенных пациентов представлены в табл. 3 и 4.
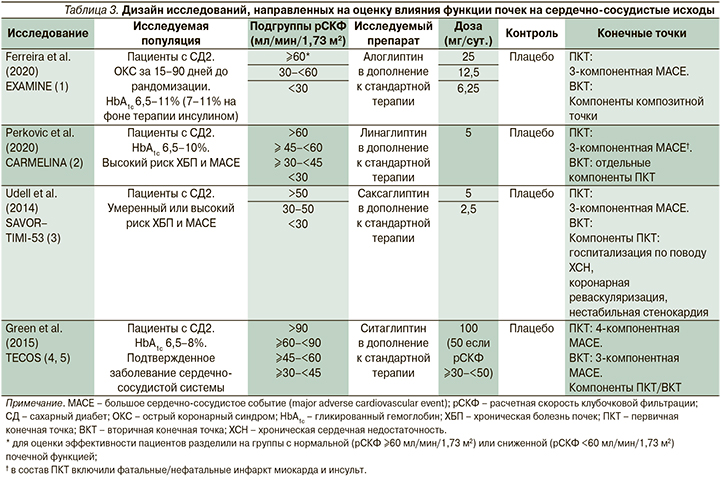
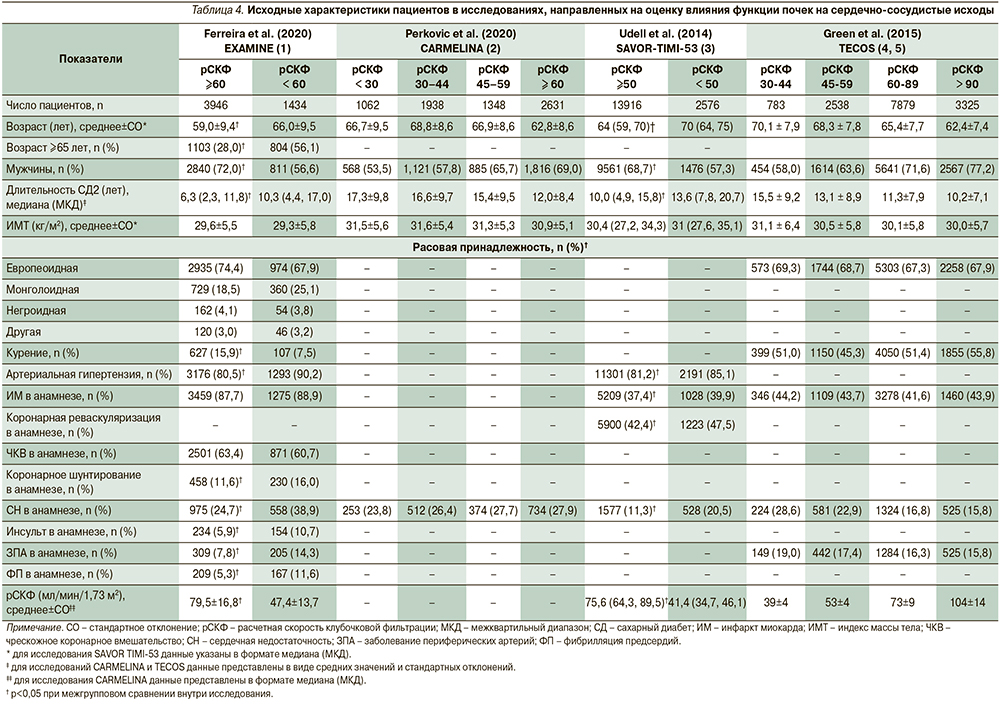
Включенные в обзор исследования проводились на несколько различающихся по своим исходным характеристикам популяциях пациентов. Так, в исследовании EXAMINE принимали участие пациенты, перенесшие острый коронарный синдром за 15–90 дней до рандомизации, в исследования SAVOR-TIMI-53 и CARMELINA включили пациентов с СД2 и умеренным либо высоким риском ХБП или больших сердечно-сосудистых событий (major adverse cardiovascular event, MACE), а в исследовании TECOS принимали участие пациенты с установленным диагнозом сердечно-сосудистого заболевания, который определялся как наличие в анамнезе ишемической болезни сердца с поражением крупных коронарных артерий, ишемической цереброваскулярной болезни либо атеросклеротического поражения периферических артерий. При этом общим для всех исследований является включение популяции пациентов с СД2, у которых исходная вероятность MACE достаточно высока. Помимо этого при сравнении исходных характеристик субпопуляций пациентов в зависимости от уровня расчетной скорости клубочковой фильтрации (рСКФ) наблюдались существенные различия внутри отдельных исследований (EXAMINE, SAVOR TIMI-53, TECOS, табл. 4) как в отношении распределения пациентов по степеням снижения рСКФ, так и по использованным градациям этого снижения. Пациенты в исследовании ситаглиптина (TECOS) характеризовались более высоким по сравнению с другими исследованиями средним уровнем рСКФ (74,9 мл/мин/1,73 м2 в обеих группах), и относительно низкой распространенностью выраженного снижения рСКФ (рСКФ <50 мл/ мин/1,73 м2 всего у 9,4% пациентов). Для исследования CARMELINA статистический анализ исходных показателей подгрупп пациентов не проводился. В качестве первичной конечной точки (ПКТ) во всех исследованиях, за исключением исследования TECOS, оценивали риск комбинированной трехкомпонентной конечной точки MACE, которая включала смерть от сердечно-сосудистых причин, нефатальный острый инфаркт миокарда и нефатальный инсульт. В исследовании TECOS трехкомпонентная конечная точка MACE оценивалась в качестве вторичной, а первичной точкой являлась комбинированная четырехкомпонентная конечная точка MACE, которая включала смерть от сердечно-сосудистых причин, нефатальный острый инфаркт миокарда, нефатальный инсульт и госпитализацию по поводу нестабильной стенокардии. Результаты исследований обобщены в табл. 5.
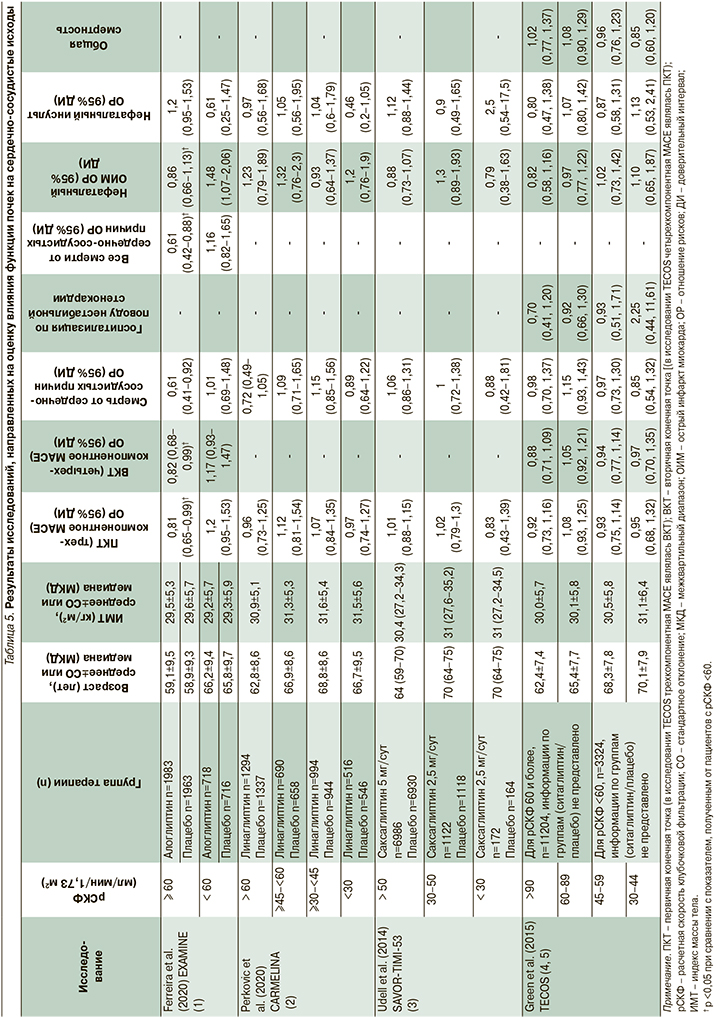
Исследование EXAMINE было исходно посвящено оценке влияния препарата алоглиптин на MACE у пациентов с СД2, недавно перенесших острый коронарный синдром. Функция почек, оцененная на скрининге при помощи рСКФ, использована при рандомизации пациентов в качестве фактора стратификации (страты ≥60 и <60 мл/мин/1,73 м2) для обеспечения равного представления в группах алоглиптина и плацебо пациентов с нормальной и сниженной функциями почек. Дополнительный анализ данных в подгруппах, сформированных в зависимости от функции почек (табл. 4), показал, что внутри каждой страты отмечалась сбалансированность по исходным характеристикам пациентов, однако между подгруппами пациентов в зависимости от исходной рСКФ отмечалась статистически значимая разница по многим показателям, включая возраст (59,0±9,4 года в страте ≥60 мл/мин/1,73 м2 против 66,0±9,5 года в страте <60 мл/мин/1,73 м2), гендерный состав (доля мужчин – 72,0% в страте ≥60 мл/мин/1,73 м2 против 56,6% в страте <60 мл/мин/1,73 м2), длительность СД2 (59,0±9,4 года в страте ≥60 мл/мин/1,73 м2 против 66,0±9,5 года в страте <60 мл/мин/1,73 м2) и прочие; таким образом, страты с разной функцией почек представляют собой с точки зрения анализа две различающиеся популяции пациентов с СД2, что подтверждается и результатами проведенного дополнительного анализа [7]. При оценке отношения рисков (выраженного в форме hazard ratio в рамках проведенного анализа времени до наступления события множительным методом Каплана–Мейера с применением регрессионной модели пропорционального риска по Коксу) среди пациентов с исходно нормальной функцией почек (рСКФ ≥60 мл/ мин/1,73 м2) алоглиптин статистически значимо снижал риск наступления трехкомпонентной MACE (первичная конечная точка) по сравнению с плацебо: отношение рисков (ОР) составило 0,81 (95% доверительный интервал [ДИ]: 0,65–0,99) [1)]. Кроме того, в подгруппе пациентов с исходно нормальной функцией почек (рСКФ ≥60 мл/мин/1,73 м2) отмечалось снижение риска наступления четырехкомпонентной MACE (вторичная конечная точка) – ОР=0,82 (95% ДИ: 0,65–0,99).
В подгруппе пациентов с исходно сниженной функцией почек (рСКФ <60 мл/мин/1,73 м2) алоглиптин не показал влияния на риски наступления конечных точек, ОР составило 1,2 (95% ДИ: 0,95–1,53) для трехкомпонентной и 1,17 (95% ДИ: 0,93–1,47) для четырехкомпонентной MACE [7]. При этом необходимо отметить, что между стратами выявлено статистически значимое различие в эффекте алоглиптина по сравнению с плацебо (уровень статистической значимости для взаимодействия) как для трехкомпонентной (p=0,014), так и для четырехкомпонентной MACE (p=0,021). При анализе компонентов MACE у пациентов с нормальной функцией почек на фоне алоглиптина достоверно снижался риск смерти от сердечно-сосудистых причин (ОР=0,61 [95% ДИ: 0,41–0,92]), при этом в группе пациентов со сниженной функцией почек достоверных изменений зафиксировано не было (ОР=1,01 [95% ДИ: 0,69–1,48]; p=0,079). ОР (алоглиптин против плацебо) для нефатального инфаркта миокарда среди пациентов с нормальной почечной функцией составило 0,86 (95% ДИ: 0,66–1,13) и 1,48 (95% ДИ: 1,07–2,06) при сниженной функции почек (в обоих стратах снижение ОР по сравнению с плацебо не достигло статистической значимости, но различия между стратами были значимыми; p=0,013) [7]. Наконец, среди прочих конечных точек необходимо отметить показатель «все смерти от сердечно-сосудистых причин», в подгруппе алоглиптина и нормальной функции почек риск снижался статистически значимо (ОР=0,61 [95% ДИ: 0,42–0,88]), при этом в группе пациентов со сниженной функцией почек достоверных изменений зафиксировано не было (ОР=1,16 [95% ДИ: 0,82–1,65]), выявлены статистически значимые различия между стратами (p=0,013).
С учетом массы различий между стратами с нормальной и сниженной функциями почек, а также дополнительным характером сравнительного анализа страт между собой к статистической значимости различий между стратами следует относиться с осторожностью, при этом сбалансированность групп алоглиптина и плацебо внутри каждой и страт по всем основным показателям позволяет сделать вывод: полученные значения ОР объективны и не смещены. Таким образом, у пациентов с СД2 с высоким риском MACE и сохраненной функцией почек терапия алоглиптином сопровождается снижением частоты трехи четырехкомпонентных MACE и смертей от сердечно-сосудистых причин.
В исследованиях CARMELINA и SAVOR-TIMI-53 не обнаружено статистически значимого влияния линаглиптина или саксаглиптина на риск наступления комбинированной первичной конечной точки MACE, а также риска наступления отдельных событий-компонентов MACE вне зависимости от уровня рСКФ, в связи с чем углубленный анализ данных исследований не проводился [8, 9].
В исследовании TECOS влияние ситаглиптина было статистически значимым в общей популяции в отношении первичной (четырехкомпонентной MACE) и вторичной (трехкомпонентной MACE) конечных точек, но только при анализе с использованием набора данных «по протоколу» (per-protocol analysis) при использовании набора данных «по намерению лечить» (intention-to-treat analysis) ни по одному из изученных параметров различий между группами выявлено не было [10]. Кроме того, был проведен анализ риска наступления первичной конечной точки в заранее выделенных подгруппах в зависимости от исходной рСКФ и не было выявлено значимого влияния функции почек в подгруппах с рСКФ >60 мл/мин/1,73 м2 (ОР=0,92 [95% ДИ: 0,78–1,10]) и с рСКФ <60 мл/мин/1,73 м2 (ОР=1,00 [95% ДИ: 0,89–1,13] (p=0,443). Тем не менее проведен дополнительный анализ данных исследования TECOS с целью углубленной оценки влияния функции почек (популяция исследования была разделена на подгруппы с рСКФ 30–44, 45–59, 60–89 и 90 и более мл/мин/1,73 м2) [11]. Ожидаемо с учетом результатов анализа основного исследования и небольшого размера подгрупп (особенно подгрупп с низкими значения рСКФ, в которых получено всего несколько десятков событий по каждой конечной точке), что ни в одной подгруппе не было показано статистически значимого влияния ситаглиптина ни на первичную, ни на все изученные вторичные конечные точки.
Сердечно-сосудистые исходы при комбинированной терапии с метформином
С целью оценки влияния на сердечно-сосудистые исходы комбинированной терапии иДПП-4 и метформином проанализировано три клинических исследования, соответствовавших критериям включения [12–14]. Дополнительно в обзор включено исследование, в котором провели объединенный анализ 20 клинических исследований с использованием плацебо или активного контроля, в которых оценивали эффективность применения саксаглиптина, в т.ч. в комбинации с метформином, у пациентов с СД2 [15]. Дизайн исследований, включенных в обзор, отражен в табл. 6. В табл. 7 представлены исходные характеристики исследуемых популяций. В отличие от субанализа влияния функции почек на частоту сердечно-сосудистых событий при терапии иДПП-4 в исследованиях, включенных в обзор сердечно-сосудистых исходов при терапии метформином, в исследовании EXAMINE популяции были сопоставимыми по исходным характеристикам. В других исследованиях данных статистического сравнения исходных характеристик в публичных источниках не представлено.
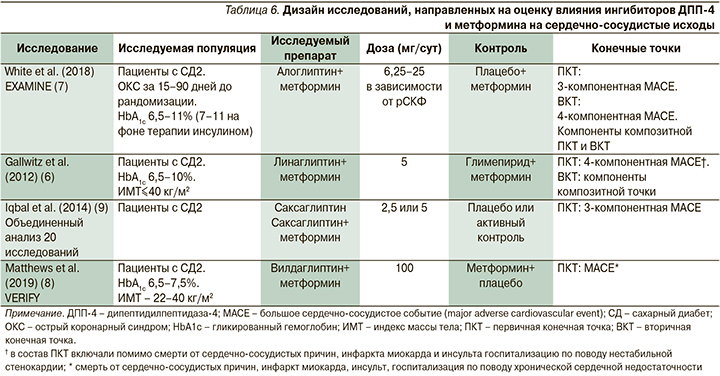
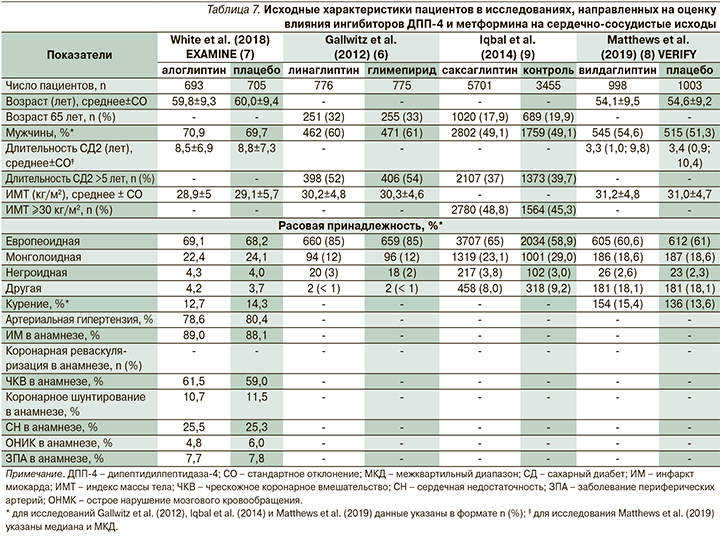
Сводные результаты исследований по влиянию комбинации ингибиторов ДПП-4 с метформином на сердечно-сосудистые исходы представлен в табл. 8. В исследовании EXAMINE при анализе комбинированной первичной конечной точки MACE с использованием метода Каплана–Мейера ОР для комбинации алоглиптина и метформина по сравнению с метформином и плацебо составило 0,77 (95% ДИ: 0,55–1,08, p=0,123 при межгрупповом сравнении). Таким образом, увеличения или уменьшения риска наступления комбинированной первичной конечной точки MACE при терапии алоглиптином не происходило. Отношение рисков развития нефатального инфаркта миокарда при терапии алоглиптином по сравнению с плацебо составило 0,94 (95% ДИ: 0,59– 1,5, p=0,803), развития нефатального инсульта на фоне приема алоглиптина по сравнению с плацебо ОР=0,92 (95% ДИ: 0,35–2,38, p=0,859) соответственно [13]. В то же время у пациентов, получавших алоглиптин и метформин, риск смерти от сердечно-сосудистых причин оказался статистически значимо ниже, чем среди больных СД2, получавших только метформин (ОР=0,49 [95% ДИ: 0,28–0,84], p=0,01).
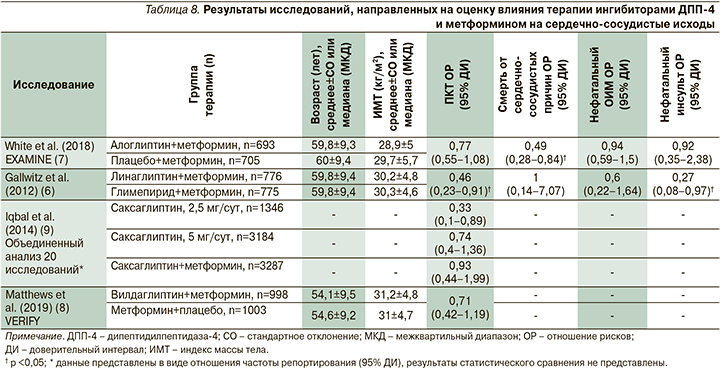
При оценке риска смерти от всех причин установлено, что среди пациентов, получавших метформин и алоглиптин, по сравнению с пациентами, которые получали только метформин, ОР для смерти от всех причин составило 0,49 (95% ДИ: 0,28–0,84, p=0,033). Таким образом, добавление алоглиптина к метформину сопровождалось уменьшением риска как общей, так и сердечно-сосудистой смертности [13].
В исследовании Gallwitz et al. (2012) в состав четырехкомпонентной первичной конечной точки были включены смерть от сердечно-сосудистых причин, инфаркт миокарда и инсульт, госпитализация по поводу нестабильной стенокардии. У пациентов, которые получали линаглиптин и метформин, ОР наступления комбинированной конечной точки по сравнению с пациентами, которые получали метформин и глимепирид, составило 0,46 (95% ДИ: 0,23–0,91, p=0,02). Авторы также показали снижение риска нефатального инсульта при терапии комбинацией линаглиптина и метформина (ОР=0,27 [95% ДИ: 0,08–0,97], p=0,03).
Существенных различий риска смерти от сердечно-сосудистых причин в данном исследовании не обнаружено, как и риска развития нефатального инфаркта миокарда, ОР=0,6 (95% ДИ: 0,22–1,64) [12].
В исследовании Iqbal et al. (2014) в качестве первичной конечной точки оценивали частоту любых MACE. В анализ включены данные 20 исследований независимо от используемых комбинаций саксаглиптина с другими препаратами, а также независимо от препаратов сравнения. Отдельно проводился анализ частоты MACE среди пациентов, которые получали комбинацию саксаглиптина (независимо от дозы) и метформина. В данной популяции пациентов отношение частоты репортирования MACE не имело существенных различий по сравнению с группами контроля и составило 0,93 (95% ДИ: 0,44–1,99). В исследовании не проводили анализа отношения частоты репортирования для отдельных компонентов MACE. В то же время для пациентов, которые получали саксаглиптин в суточной дозе 2,5 мг независимо от сопутствовавшей терапии, отношение частоты репортирования MACE было значительно ниже, чем у пациентов контрольных групп, и составило 0,33 (95% ДИ: 0,1–0,89) [15].
В исследовании VERIFY Matthews et al. (2019) показано, что ОР наступления комбинированной конечной точки (смерти от сердечно-сосудистых причин, инфаркта миокарда, инсульта, госпитализации по поводу хронической сердечной недостаточности) при терапии вилдаглиптином и метформином по сравнению с применением метформина и плацебо составило 0,71 (95% ДИ: 0,42–1,19, p=0,19). Таким образом, риск MACE и госпитализаций по поводу сердечной недостаточности был сопоставимым между группами. Авторы отметили, что статистическую мощность исследования не рассчитывали для формальной оценки данной конечной точки, которая носила поисковый характер [14].
Обсуждение
Целью данного систематического обзора стала оценка влияния ингибиторов ДПП-4 на риск сердечно-сосудистых событий в подгруппах пациентов с различной функцией почек, а также среди пациентов, которые получали препараты данного класса в качестве дополнения к метформину.
При анализе результатов включенных исследований показано, что терапия алоглиптином была ассоциирована со снижением риска наступления трехкомпонентной и четырехкомпонентной конечной точки MACE среди пациентов с нормальной функцией почек (рСКФ ≥60 мл/мин/1,73 м2), но не среди пациентов со сниженной функцией почек. У пациентов с нормальной функцией почек также наблюдали уменьшение риска смерти от сердечно-сосудистых причин, чего не отмечали у больных со сниженной функцией почек [7]. В исследованиях других представителей класса иДПП-4 (CARMELINA, SAVOR-TIMI-53 и TECOS) данные закономерности не были отмечены, не было выявлено разницы в риске наступления сердечно-сосудистых исходов, ни риска наступления композитных трехили четырехкомпонентных MACE, ни их отдельных компонентов [8–11]. К ограничениям анализа исследования эффективности иДПП-4 в зависимости от функции почек стоит отнести существенную гетерогенность исходных подгрупп, в связи с чем не стоит выносить однозначные суждения о достоверности результатов.
Добавление алоглиптина к метформину по сравнению с приемом только метформина приводило к снижению риска наступления MACE, а также смерти от сердечно-сосудистых причин и от всех причин [13]. В другом исследовании применение комбинации линаглиптина и метформина было ассоциировано с меньшим риском наступления MACE или нефатального инсульта, чем с использованием глимепирида в комбинации с метформином. Стоит, однако, отметить, что в данном исследовании не было группы сравнения на монотерапии метформином [12]. На основании данных анализа результатов 20 клинических исследований не удалось установить влияние комбинации метформина и саксаглиптина на риск сердечно-сосудистых событий [15]. Вилдаглиптин в комбинации с метформином по сравнению с монотерапией метформином также не снижал риска наступления четырехкомпонентной конечной точки MACE [14].
Заключение
Таким образом, анализ исследований, включенных в обзор, показал возможный протекторный эффект алоглиптина на риски развития отдельных сердечно-сосудистых событий у пациентов с нормальной функцией почек или начальными стадиями ХБП (СКФ>60 мл/мин/1,73 м2) и нормоальбуминурией, а также при использовании в комбинации с метформином. Однако данные результаты не были показаны на других представителях класса, что позволяет предположить, что выявленные различия рисков сердечно-сосудистых событий, вероятно, не относятся к класс-эффекту иДПП-4. При этом разница в результатах проанализированных исследований может быть обусловлена особенностями дизайна исследований, разницей в популяциях включенных пациентов и исходного уровня сердечно-сосудистого риска, распространенностью сопутствующих коморбидных патологий и пр. Выявленные взаимосвязи вызывают интерес и требуют подтверждения в будущих исследованиях, в т.ч. по изучению эффективности и безопасности различных комбинации сахароснижающей терапии с использованием иДПП-4. Кроме того, результаты систематического обзора демонстрируют практикующим врачам, что интенсификация сахароснижающей терапии иДПП-4 является рациональной и безопасной опцией, согласующейся с российскими и международными клиническим рекомендациями, и, что наиболее важно, может улучшать прогноз, качество и продолжительность жизни пациентов с СД2.



