Первичная профилактика сердечно-сосудистых событий у лиц с установленными факторами риска их развития является важнейшей задачей современной медицины. Сердечно-сосудистая смертность, включающая фатальные инфаркт миокарда (ИМ) и инсульт, остается ведущей среди других причин смерти в развитых странах. Так, в США в 2011 г. этот показатель составил примерно 30% [1]. Более 26 млн жителей США имеют установленный диагноз ишемической болезни сердца (ИБС), 8 млн перенесли ИМ и 6 млн – инсульт в анамнезе. Повышенный риск развития сердечно-сосудистых заболеваний (ССЗ) среди лиц старше 40 лет определяется у двух третей мужчин и у каждой второй женщины. После первого ИМ в течение года умирают 38% женщин и 25% мужчин [2]. Необходимость предотвращения первого сосудистого эпизода, который часто приводит к фатальному исходу или стойкой инвалидизации либо требует проведения интенсивного и дорогостоящего медикаментозного лечения, представляется более чем очевидной. Основным направлением как первичной, так и вторичной профилактики остается коррекция сердечно-сосудистых факторов риска, таких как артериальная гипертензия (АГ), гиперлипидемия, курение, сахарный диабет (СД), ожирение, малоподвижный образ жизни. Кроме того, учитывая наличие связей между активацией системы гемостаза и основными факторами риска, а также ее ведущую роль в развитии и прогрессировании атеросклероза и его осложнений, представляется патогенетически оправданным назначение антитромботических препаратов как для лечения, так и в целях профилактики ССЗ [3–5]. Ацетилсалициловая кислота (АСК) давно и с успехом используется в лечении таких неотложных клинических состояний, как острый ИМ или острый ишемический инсульт, а также при вторичной профилактике сердечно-сосудистых событий [6]. Однако целесообразность назначения АСК в целях первичной профилактики остается предметом дискуссий. Одними из основных вопросов, которые широко обсуждаются, являются следующие: кому следует назначать АСК, есть ли дополнительная польза от ее приема при коррекции основных сердечно-сосудистых факторов риска и насколько эта польза соотносится с риском возможных геморрагических осложнений? Результатом данных дискуссий являются значимые отличия в существующих рекомендациях по применению АСК, которые предлагают разные экспертные сообщества.
В 2009 г. были опубликованы результаты крупного мета-анализа, организованного Международной группой по изучению испытаний антитромбоцитарных препаратов, в котором сравнивалась эффективность применения АСК с целью первичной и вторичной профилактики сердечно-сосудистых событий [7]. Для анализа было отобрано 6 крупных контролируемых исследований по первичной профилактике, включивших 95 тыс. пациентов низкого/среднего риска развития сосудистых осложнений (Physicians Health Study, British Doctors Study, Thrombosis Prevention Trial, Hypertension Optimal Treatment Study, Primary Prevention Project, Women’s Health Study) [8–13]. Исследований по вторичной профилактике было 16 (6 исследований, включивших лиц, перенесших ИМ, 10 – инсульт/транзиторную ишемическую атаку), и они охватывали 17 тыс. больных высокого риска.
Снижение риска сосудистых событий на фоне терапии АСК в исследованиях по первичной профилактике составило 12%, что было достоверно (р=0,0001; табл. 1).
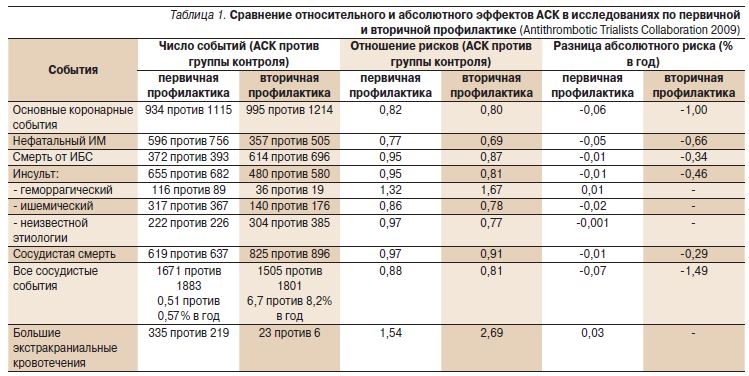
Однако в абсолютных цифрах эта разница выглядела следующим образом: 1671 (0,51% в год) событие у пациентов, принимавших АСК, против 1883 (0,57% в год) событий в группе контроля. Для сравнения: в исследованиях по вторичной профилактике 19%-ное снижение риска сосудистых событий на фоне применения АСК сопровождалось разницей в абсолютных значениях 6,7 и 8,2% (р<0,0001) в год среди получавших и неполучавших препарат.
Анализ исследований по первичной профилактике не выявил статистической разницы в снижении частоты сосудистых событий на фоне приема АСК в различных подгруппах: у мужчин и женщин, у курящих и некурящих, при наличии или отсутствии СД, АГ, при повышенных значениях индекса массы тела, уровня холестерина и при разном 5-летнем риске развития ИБС – менее 2,5%, от 2,5 до 5%, от 5 до 10% и выше 10% (численность последних была крайне мала).
В исследованиях по первичной профилактике уменьшение числа основных коронарных событий (все случаи ИМ, смерть от коронарных причин, внезапная смерть) на фоне терапии АСК достигалось прежде всего за счет снижения нефатального ИМ (табл. 1). В исследованиях по вторичной профилактике помимо нефатального ИМ применение АСК снижало сосудистую смертность на 9% (р=0,06), общую – на 10% (р=0,02).
АСК достоверно снижала риск ишемического инсульта на 14% в исследованиях по первичной профилактике. В то же время в исследованиях по вторичной профилактике применение АСК позволило значимо уменьшить не только количество ишемических инсультов на 22%, но и общее число инсультов на 19%. Большинство инсультов (84%) в исследованиях по вторичной профилактике отмечались у больных инсультами или транзиторными ишемическими атаками (ТИА) в анамнезе. Геморрагических инсультов на терапии АСК было несколько больше как в исследованиях по первичной, так и при вторичной профилактике, однако общее их число было невелико (табл. 1).
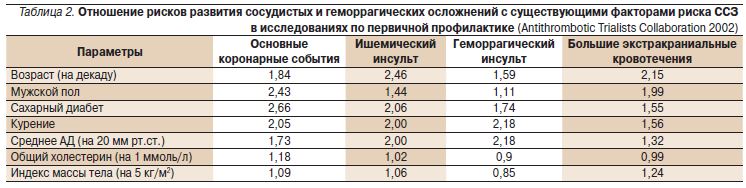
В данном мета-анализе впервые была проведена оценка риска развития сосудистых осложнений и больших кровотечений среди участников исследований по первичной профилактике. Наличие каждого из следующих факторов: возраста (на декаду), мужского пола, СД, курения, повышения среднего артериального давления – АД (на 20 мм рт.ст.), ассоциировалось не только с увеличением риска развития коронарных событий, но и с риском геморрагических осложнений (табл. 2).
Исходя из полученных результатов мета-анализа, было подсчитано, что назначение АСК с целью первичной профилактики позволит предотвратить развитие 5 нефатальных коронарных события при риске возникновения 3 желудочно-кишечных кровотечений (ЖКК) и 1 внутричерепного кровотечения на 10 тыс. пациентов в год [7].
В 2011–2012 гг. были опубликованы результаты еще 4 крупных мета-анализов [14–17], посвященных первичной профилактике сердечно-сосудистых событий с помощью АСК, включивших помимо 6 уже упомянутых крупных контролируемых исследований [8–13] данные еще 3 более поздних наблюдений (Japanese Primary Prevention of Atherosclerosis with Aspirin for Diabetes Trial, Prevention of Progression of Arterial Disease and Diabetes Study, Aspirin for Asymptomatic Atherosclerosis Trial) [18– 20]. Во всех этих мета-анализах было отмечено незначительное, недостоверное, но устойчивое снижение общей, но не сосудистой смертности (отношение рисков [ОР]=0,94; 0,88–1,02).
В 2012 г. Европейское общество кардиологов и Американское общество торакальных терапевтов дали противоречивые рекомендации по применению АСК с целью первичной профилактики ССЗ. Европейское общество кардиологов не рекомендовало прием АСК лицам с отсутствием ССЗ и цереброваскулярных заболеваний в связи с риском геморрагических осложнений [21]. В то же время Американское общество торакальных терапевтов признало целесообразным назначение АСК в дозе 75–100 мг/сут лицам ≥50 лет без предшествовавших ССЗ (уровень доказательности – 2В) [22], отмечая, что АСК вызывала некоторое уменьшение общей смертности вне зависимости от исходного сердечно-сосудистого риска при приеме свыше 10 лет. Прием АСК с целью предотвращения ИМ возможен у пациентов среднего и высокого рисков, если риск его возникновения превышает вероятность ЖКК.
Следует отметить, что представленные исследования по первичной профилактике значительно отличались друг от друга по критериям включения, демографическим характеристикам, числу участников, риску развития сосудистых событий в группе контроля, используемым дозам АСК и прочим показателям, что, вероятно, объясняет некоторые расхождения их результатов и нивелирование части данных при суммации во время мета-анализов. С учетом этих отличий в последующем была проведена отдельная оценка эффективности применения АСК при первичной профилактике у различных групп высокого риска.
У больных СД риск развития сердечно-сосудистых событий в 2–4 раза выше, чем в соответствующей по возрасту и полу популяции. Смертность в возрастной группе старше 65 лет в 68% случаев связана с ИБС, в 15% – с инсультом [23]. В 2010 г. были опубликованы результаты отдельного метаанализа [24], включившего пациентов с СД из 6 известных исследований по первичной профилактике [8–13], а также из 3 специально организованных наблюдений [18, 19, 25]. Применение АСК приводило к снижению риска развития фатального и нефатального ИМ на 9%, а инсульта – на 15%, что, однако, не было статистически значимо. В 3 других мета-анализах были получены схожие результаты [26–28]. Кроме того, как показали данные Международной группы по изучению испытаний антитромбоцитарных препаратов [7], риск больших кровотечений (в основном ЖКК) у больных СД был на 55% выше, при том что в исследования по первичной профилактике не включались пациенты с язвенным анамнезом (табл. 2). В настоящее время нет убедительных данных, чтобы рекомендовать прием АСК всем больным СД без сопутствующей сердечнососудистой патологии. Американская диабетическая ассоциация рекомендует прием АСК в дозе 75–162 мг/сут в целях первичной профилактики больным СД 1 и 2 типов, чей 10-летний риск >10%, что включает большинство женщин и мужчин ≥50 лет, при наличии по крайней мере одного дополнительного фактора риска (курение, семейный анамнез ССЗ, АГ, гиперлипидемия, альбуминурия), в отсутствие повышенного риска кровотечений. Прием АСК возможен пациентами среднего риска (10-летний риск – 5–10%) – возраст <50 лет и наличие одного дополнительного фактора риска и не рекомендован при низком риске сосудистых событий (10-летний риск <5%) [29].
Больные периферическим атеросклерозом (симптоматическим или бессимптомным) представляют собой группу повышенного риска развития сосудистых осложнений. Смертность от ИМ и инсульта на протяжении 10 лет наблюдения у таких пациентов в 6 раз выше, чем в соответствующей по возрасту и полу популяции [30]. В исследовании POPADAD, включившем 1276 больных СД 1 и 2 типов с бессимптомным периферическим атеросклерозом (плече-лодыжечный индекс [ПЛИ]≤0,99), не было отмечено значимого влияния АСК по сравнению с плацебо на первичную конечную точку (фатальные и нефатальные ИМ и инсульт, ампутация нижней конечности) [19]. Риск ЖКК также достоверно не увеличивался. Аналогичное исследование ААА было проведено на лицах с бессимптомным периферическим атеросклерозом, но без СД [20]. В нем участвовали 3350 пациентов с ПЛИ≤0,95, не имевших клинических проявлений какого-либо ССЗ, продолжительность наблюдения составила 8,2 года. За время наблюдения было отмечено 357 первичных конечных точек (фатальные и нефатальные коронарные события+инсульт+потребность в реваскуляризации): 13,7/1000 пациенто-лет у получавших АСК vs 13,3/1000 пациенто-лет – плацебо, без статистической разницы. Число вторичных конечных точек (первичная+появление клиники стенокардии, перемежающейся хромоты, ТИА) также не различалось в группах АСК и плацебо и составило соответственно 22,8 и 22,9/1000 пациенто-лет. Больших кровотечений, потребовавших госпитализации было недостоверно больше у получавших АСК: 34 (2%) против плацебо 20 (1,2%). По мнению авторов исследования, у лиц с периферическим атеросклерозом большее значение имеет АДФ-индуцированный путь активации тромбоцитов, а не тромбоксан А2-зависимый, о чем косвенно свидетельствуют результаты исследования CAPRIE (Сlopidogrel versus aspirin in patients at risk of ischaemic events), показавшего наибольшее преимущество клопидогрела перед АСК именно для лиц с атеросклеротическим поражением артерий нижних конечностей [31]. American Heart Association/American Stroke Association не рекомендуют прием АСК с целью первичной профилактики больным СД и бессимптомным периферическим атеросклерозом (ПЛИ≤0,99) [32].
Оценка эффективности и безопасности применения АСК в условиях подобранной антигипертензивной терапии проводилась в исследовании НОТ (Hypertension Optimal Treatment) [11]. В исследование были включены 18 790 больных АГ со значениями диастолического АД (ДАД) от 100 до 115 мм рт.ст. в возрасте от 50 до 80 лет, которым проводилась терапия фелодипином и при необходимости другими антигипертензивными препаратами. Все пациенты были рандомизированы к приему АСК 75 мг/сут или плацебо, продолжительность наблюдения составила в среднем 3,8 года. Применение АСК снижало риск развития ИМ на 36%, а общее число сердечно-сосудистых событий (ИМ, инсульт, сердечно-сосудистая смерть) – на 15%. Самая низкая частота сердечно-сосудистых событий отмечалась при достижении среднего ДАД 82,6 мм рт.ст., а самый низкий риск сердечно-сосудистой смертности – при уровне ДАД 86,5 мм рт.ст. В исследовании НОТ также были определены подгруппы с наибольшим эффектом от терапии АСК. Так, у больных СД частота сердечно-сосудистых событий на фоне терапии АСК уменьшилась на 51% при достижении ДАД≤80 мм рт.ст. по сравнению с группой с целевыми показателем ДАД≤90 мм рт.ст. Среди пациентов с хронической почечной недостаточностью (ХПН, cкорость клубочковой фильтрации [СКФ]<45 мл/мин/1,73 м2) снижение риска инсульта составило 79%, сердечнососудистой смертности – 64%, общей смертности – 49% [33]. Больных ХПН (СКФ<30 мл/мин/1,73 м2) было крайне мало и оценить эффект АСК для них не удалось. В исследовании HOT не было отмечено значимого увеличения числа геморрагических инсультов на терапии АСК, однако число нефатальных больших, а также малых кровотечений было в 1,8 раза больше [11].
Европейское общество кардиологов и Европейское общество по артериальной гипертонии рекомендовало прием малых доз АСК больным АГ с анамнезом сердечно-сосудистых событий. При первичной профилактике АСК целесообразно назначать больным АГ с нарушением функции почек или с высоким риском сердечно-сосудистых осложнений. Назначение АСК возможно только в условиях хорошо подобранной антигипертензивной терапии [34]. American Heart Association/ American Stroke Association рекомендуют прием АСК с целью первичной профилактики больным ХПН (СКФ<45 мл/мин/1,73 м2). Эти рекомендации не применимы для пациентов (СКФ<30 мл/мин/1,73 м2) [32].
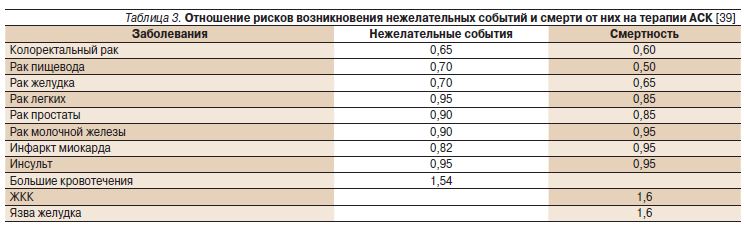
В последнее десятилетие активно изучаются некардиоваскулярные эффекты АСК, в частности ее позитивное влияние на возникновение онкологических заболеваний и связанную с ними смертность. Механизм действия неясен, но предполагается ингибирование ферментов циклоксигеназы-1 и -2, а также функции тромбоцитов, которые, возможно, участвуют в процессах метастазирования. В 2011 г. мета-анализ 8 рандомизированных исследований, включивший 6 по первичной профилактике [9, 10, 18–20, 25] и 2 по вторичной [36, 37], выявил достоверное снижение общей смертности (ОР=0,92; 0,85–0,99) через 15 лет наблюдения при продолжительности лечения АСК более 5 лет [35]. Снижение общей смертности практически полностью достигалось за счет снижения смерти от рака (ОР=0,79; 0,68–0,92; р=003). В 3 исследованиях [9, 10, 36] АСК снижала 20-летний риск смерти от рака желудочнокишечного тракта (ОР=0,65; 0,54– 0,78; р<0,0001), а также от солидного рака любой локализации (ОР=0,8; 0,72–0,88; р<0,0001). По гистологическому типу рака наибольший эффект был отмечен в отношении аденкарциномы (ОР=0,66; 0,56–0,77; р<0,0001). Антинеопластическое действие АСК не было связано c ее дозой (75 мг и выше), не зависело от пола, статуса курения, но было более выражено у лиц старше 65 лет. В 2012 г. был опубликован мета-анализ 34 исследований с применением АСК у 69 224 пациентов, в результатах которых имелась индивидуальная информация о причинах некардиоваскулярной смертности [38]. У лиц, принимавших АСК, риск смерти от онкологических заболеваний был ниже (ОР=0,85; 0,76–0,96; р=0,008), что было более очевидно после 5 лет приема препарата (ОР=0,63; 0,49–0,82; р=0,0005). Отмечено, что уменьшение числа основных сосудистых событий в первое время нивелируется риском кровотечений, но при дальнейшем наблюдении значимость обоих эффектов ослабевает и основное значение приобретает снижение риска рака, которое в абсолютных величинах составляет 3,13 на 1000/пациенто-лет начиная с 3-го года. В 2015 г. группой J. Cuzick и соавт., представляющих американские и английские онкологические институты, была проанализирована масса наблюдательных и рандомизированных исследований, а также данных предыдущих мета-анализов [39]. Подтверждено, что снижение риска возникновения рака начинается после 3 лет, а онкологической смертности – после 5 лет назначения АСК. При длительном применении АСК протективный эффект сохраняется еще на протяжении 5-летнего периода после прекращения приема препарата. Антинеопластическое действие наблюдается только в отношении онкологических заболеваний желудочно-кишечного тракта (пищевод, желудок, толстый кишечник, табл. 3).
Положительный эффект АСК отмечен для доз 75–325 мг/сут, прием более высоких доз не приводит к дополнительным преимуществам, но увеличивает риск побочных эффектов. Было подсчитано, что у пациентов среднего риска в возрасте от 50 до 65 лет прием АСК длительностью 10 лет сопровождается снижением риска рака, ИМ и инсульта на 7% для женщин и на 9% для мужчин на протяжении 15 лет, а общей смертности – на 4% на протяжении 20 лет. Факторы риска геморрагических осложнений: пожилой возраст, мужской пол, наличие СД, курение, АГ, ожирение, инфекция Helicobacter pilori, прием нестероидных противовоспалительных средств, алкоголя. Несмотря на полученные доказательства позитивного влияния АСК на риск колоректального и других видов рака, авторы считают преждевременным рекомендовать рутинный прием препарата с этой целью в популяции и считают необходимым получение дополнительной информации из долгосрочных наблюдений.
В 2016 г. US Preventive Services Task Force провело свой анализ по оценке влияния АСК на риск развития ССЗ и онкологических заболеваний при их первичной профилактике [40].
Новый мета-анализ по первичной профилактике АСК сердечно-сосудистых событий включил 11 исследований [8–13, 18–20, 25, 41] более 118 тыс. пациентов [42]. Снижение нефатального ИМ отмечено практически во всех исследованиях в среднем на 22%, что было достоверно. Влияние АСК на риск нефатального инсульта (всех типов) было противоречивым (ОР=0,64–1,26). Достоверное снижение риска нефатального инсульта на 14% наблюдалось в 8 исследованиях, применявших низкую (100 и менее мг) дозу АСК. Не было отмечено влияния АСК на сосудистую смерть, однако общая смертность достоверно снижалась (ОР=0,94; 0,89–0,99). На фоне приема АСК больших ЖКК было больше на 58%, а риск геморрагических инсультов возрастал на 33% (при применении низких доз – на 27%). Количество геморрагические инсультов было относительно редким – 15,5% от общего числа.
При анализе подгрупп не было выявлено значимых различий в снижении частоты сосудистых событий на фоне приема АСК: у мужчин и женщин при наличии или отсутствии СД в старших возрастных группах. Снижение нефатального ИМ и инсульта было несколько бóльшим у лиц с исходно более высоким риском сосудистых событий.
Для изучения влияния АСК на риск возникновения онкологических заболеваний и связанную с ними смертность было отобрано 20 исследований по первичной и вторичной профилактике, а также проанализированы результаты 4 мета-анализов [43]. В 10 исследованиях по первичной профилактике (n=103 787) не было выявлено достоверного снижения онкологической смертности (ОР=0,96; 0,87–1,06), а в 6 (n=72 926) – риска возникновения рака (ОР=0,98; 0,93–1,04). В 4 исследованиях по первичной и вторичной профилактике (n=14 033) АСК снижала 20-летнюю смертность от рака толстого кишечника (ОР=0,67; 0,52–0,86). Снижение риска возникновения рака толстого кишечника было отмечено в 3 исследованиях (n=47 464; ОР=0,6; 0,47–0,76), но этот эффект начинал проявляться через 10–19 лет после применения АСК.
US Preventive Services Task Force рекомендует назначение низких доз АСК в целях первичной профилактики ССЗ и колоректального рака пациентам в возрасте от 50–59 лет, чей 10-летний риск ≥10%, в отсутствие повышенного риска кровотечений, ожидаемой продолжительности жизни более 10 лет, но при их желании ежедневно принимать препарат на протяжении не менее 10 лет. Решение о применении низких доз АСК в целях первичной профилактики у пациентов в возрасте от 60–69 лет, чей 10-летний риск ≥ 10%, должно приниматься индивидуально, хотя и у них в отсутствие риска геморрагических осложнений и ожидаемой продолжительности жизни более 10 лет возможная польза превышает потенциальный вред. В настоящее время недостаточно доказательств пользы приема АСК в целях первичной профилактики лицами моложе 50 и старше 70 лет [40].
Заключение
АСК – единственный из антитромботических препаратов, который в настоящее время используется в целях первичной профилактики ССЗ. При назначении АСК лицам без клинических проявлений атеросклероза необходимо соотнести предполагаемую пользу и возможный риск от проведения подобной терапии. У пациентов молодого или очень пожилого возраста и при низком риске сосудистых осложнений достаточно коррекции основных предрасполагающих факторов. Однако при среднем и высоком рисках (≥10% на протяжении 10 лет) прием АСК может считаться вполне оправданным. Дополнительным аргументом в пользу назначения АСК являются появившиеся данные о ее позитивном влиянии на частоту возникновения рака толстого кишечника и связанную с ним смертность. Колоректальный рак занимает 3-е по частоте встречаемости место среди других случаев онкологических заболеваний в США, и возможность его профилактики очень важна. Идентификация пациентов высокого риска развития геморрагических осложнений позволит обеспечить эффективность и безопасность длительной терапии АСК.



