Введение
Заболевания сердечно-сосудистой системы (ССС) являются основной причиной преждевременной смерти и утраты лет жизни. Наиболее распространены заболевания коронарных артерий, ишемический инсульт и заболевания периферических артерий [1, 2]. Развитие дислипидемий может быть обусловлено другими заболеваниями (вторичными дислипидемиями) или сочетанием наследственной предрасположенности и неблагоприятных факторов окружающей среды. Профилактика и лечение дислипидемий рассматриваются в рамках предотвращения развития сердечно-сосудистых заболеваний – ССЗ [3].
Помимо повышения уровня общего холестерина (ОХ) и липопротеидов низкой плотности (ЛПНП) некоторые другие типы дислипидемий также способствуют увеличению риска развития ССЗ. Наиболее распространено определенное сочетание, получившее название атерогенной липидной триады. Эта триада включает повышение уровня ремнантов (остатков) липопротеидов очень низкой плотности (ЛПОНП), которое проявляется умеренным повышением уровня триглицеридов (ТГ), увеличением количества малых частиц ЛПНП и снижением уровня липопротеидов высокой плотности (ЛПВП). Данные клинических исследований, нацеленных на оценку эффективности и безопасности воздействия на перечисленные факторы для снижения риска ССЗ, ограниченны. Поэтому указанная триада и ее отдельные компоненты должны рассматриваться как дополнительные мишени для проведения профилактики заболеваний ССС.
При назначении лекарственной терапии наибольшее внимание следует уделять снижению уровня ОХ и ЛПНП, на которые можно повлиять, изменяя и образ жизни пациента (снижение излишней массы тела, повышение уровня регулярной физической активности, антиатеросклеротическая диета и др.). Терапия нарушений липидного обмена в настоящее время строится в зависимости от степени риска конкретного пациента, выявляемого по специальным таблицам [3]. Целевой уровень ЛПНП у пациентов с высоким и очень высоким риском равняется 1,8 ммоль/л. Сегодня мало ограничиваться достижением целевого уровня только для ЛПНП, необходимо также ориентироваться на целевые уровни ХС, не связанного с ЛПВП, уровнями ЛПВП и апо-В, в особенности для лиц с ожирением, метаболическим синдромом и сахарным диабетом 2 типа. Профилактика и лечение дислипидемий должны рассматриваться с точки зрения предотвращения развития заболеваний ССС.
В таблице представлена сравнительная характеристика лекарственных средств, корректирующих уровень липидов крови [4]:
Примечание. ЛПНП – липопротеиды низкой плотности, ЛПВП – липопротеиды высокой плотности, Апо ЛП – аполипопротеиды, ЛП(а) – липопротеид (а). ↑ – повышение уровня, ↓ – снижение уровня, 0 – отсутствие эффекта (число крестиков означает выраженность действия).
Как видно из таблицы, наиболее сильным гипохолестеринемическим эффектом обладают статины и секвестранты желчных кислот. Они вполне оправданно считаются гипохолестеринемическими средствами, хотя умеренно могут влиять и на уровни ЛПВП и ТГ. Эти препараты назначают при гиперхолестеринемии и умеренной гипертриглицеридемии.
Фибраты оказывают выраженный гипотриглицеридемический эффект и весьма умеренный гипохолестеринемический. Поэтому их назначают при изолированной и комбинированной гипертриглицеридемии. Никотиновая кислота сочетает равную гипохолестеринемическую и гипотриглицеридемическую активность. Препарат достаточно ощутимо увеличивает концентрацию ЛПВП и понижает уровень ЛП(а), поэтому его назначают в случаях смешанной гипер- и дислипидемии. Ингибиторы всасывания ХС умеренно снижают уровень ЛПНП и в основном используются для комбинированной терапии. Препараты рыбьего жира используются при гипертриглицеридемии и низких уровнях ЛПВП.
Таким образом, каждая группа препаратов имеет свою нишу в спектре липидных расстройств, но абсолютная значимость на практике остается за статинами ввиду наибольшей распространенности среди населения именно гиперхолестеринемии.
Омега-3 полиненасыщенные жирные кислоты
В 1971 г. в журнале Lancet была опубликована статья [5], в которой говорилось о более низком по сравнению с континентальными датчанами (различие статистически достоверно) содержании в плазме крови эскимосов атерогенных фракций липопротеидов, что объясняли особенностями пищевого рациона эскимосов, содержащего большое количество морепродуктов в своем составе. Однако это сообщение осталось практически без внимания.
Интерес к омега-3 полиненасыщенным жирным кислотам (ω-3 ПНЖК) возник после публикации результатов датского эпидемиологического исследования, в котором на протяжении 24 лет (1950–1974, число участников – 1800) изучали особенности заболеваемости гренландских эскимосов и континентальных датчан [6]. Было показано, что эскимосы практически не страдают инфарктом миокарда (ИМ), мультифокальным атеросклерозом, сахарным диабетом, тиреотоксикозом и псориазом. Эти различия связывали с особенностями питания эскимосов, т. к. они потребляют с пищей большое количество ω-3 ПНЖК (соответственно 13 г против 1 г в сутки). Эти наблюдения в дальнейшем были подтверждены рядом крупных эпидемиологических исследований, в которых прослежена и определена обратная статистически значимая корреляция между уровнем ω-3 ПНЖК в плазме крови и риском развития фатальных и нефатальных ИМ.
Например, в эпидемиологическом исследовании Honolula Health Program (период наблюдения за 8006 японцами – 1963–1988 гг.) исследовали влияние диеты, богатой морепродуктами (систематическое употребление свежей рыбы более 2 раз в неделю) на риск развития летальности от коронарной болезни сердца (КБС) [7]. Результаты этого исследования свидетельствовали, что у лиц, систематически употребляющих в пищу морепродукты, богатые ω-3 ПНЖК, риск летальности от КБС значительно ниже (р < 0,01).
В другом исследовании приводятся данные о том, что длительное (20 лет) ежедневное употребление в пищу свежей рыбы (30 г и более) уменьшает риск летальности от КБС на 40–50 % [8].
Жирные кислоты подразделяются на три группы:
• Насыщенные жирные кислоты (лауриновая, миристиновая, пальмитиновая и стеариновая). В их молекулах все атомы углерода соединены одинарными ковалентными связями, а две связи замещены атомами водорода. Эти кислоты в большом количестве содержатся в кокосовом, пальмовом, мускатном маслах, а также в свином жире. Диета, включающая эти кислоты, способствуют повышению в плазме крови атерогенных липопротеидов [9–11].
• Мононенасыщенные жирные кислоты (олеиновая, пальмитоолеиновая, эландиновая и др.) имеют в составе своей молекулы одну двойную связь. В рационе человека преобладает олеиновая кислота, которая в большом количестве содержится в оливковом масле и арахисе. Диета, богатая олеиновой кислотой, способствует снижению уровня антиатерогенных ЛПВП в плазме крови.
• Полиненасыщенные жирные кислоты – ω-3 и ω-6 ПНЖК. В углеродной цепи этих кислот имеется несколько двойных связей, число 3 указывает на наиболее удаленное от карбоксильной группы положение двойной связи.
ω-3 ПНЖК подразделяются на короткоцепочечные (γ-линоленовая) и длинноцепочечные (эйкозопентаеновая [ЭПК] и докозагексаеновая [ДГК]).
Ненасыщенные жирные кислоты в основном поступают с пищей. Выделяют три группы ненасыщенных жирных кислот в зависимости от атома углерода, участвующего в образовании последней двойной цепи. К основным ω-3 ПНЖК относят ЭНК и ДГК.
ω-3 ПНЖК улучшают эндотелиальную функцию, снижают агрегацию тромбоцитов и концентрацию ТГ в крови, оказывают противовоспалительное действие, влияют на синтез эйкозаноидов, повышают стабильность атеросклеротической бляшки [10, 12]. Прием в пищу 23 г/сут рыбьего жира (богатого длинноцепочечными ω-3 жирными кислотами) способствует снижению уровня ТГ на 25–30 % у пациентов с нормо- и гиперлипидемией. При ССЗ следует исключать жареную рыбу, приготовленную на предприятиях общественного питания (например, в ресторанах и пунктах быстрого питания), а также замороженные полуфабрикаты жареной рыбы, поскольку они содержат малое количество ω-3 ПНЖК и большое количество трансизомеров жирных кислот. Альфа-линолевая кислота (среднецепочечная ω-3 жирная кислота, содержащаяся в каштанах, некоторых овощах, в соевом и рапсовом маслах) менее эффективно снижает уровень ТГ. Длинноцепочечные ω-3 ПНЖК также уменьшают выраженность постпрандиального липидемического ответа. При их приеме в качестве добавки к пище в дозе 3 г/сут может наблюдаться повышение уровня Х-ЛПНП примерно на 5 % у некоторых пациентов, страдающих гипертриглицеридемией [13].
Источником ω-3 ПНЖК может служить или диета, богатая морской рыбой, или биологически активные добавки. Количество потребляемых с пищей и/или пищевыми добавками длинноцепочечных ω-3 ПНЖК (ЭПК и ДГК) должно быть в пределах 1 г/сут [14]. Наиболее богаты длинноцепочечными ω-3 ПНЖК такие виды морской рыбы (в порядке убывания), как лосось, скумбрия, сельдь, семга, сардины, тунец и форель. Например, 100 г лосося содержат 18 г ω-3 ПНЖК, из них 1,1 г – ЭПК, витамина Е – 0,3 мг, витамина Д – 6 мг.
Следует отметить, что термическая обработка существенно изменяет сis-конфигурацию (геометрическая, пространственная конфигурация) ω-3 ПНЖК. Поэтому их лучше употреблять в слабосоленом (3–5 % рассол) виде. Для максимальной сохранности ω-3 ПНЖК рыбу следует запекать, а не жарить. В вареной рыбе сохранность ω-3 ПНЖК несколько выше, чем в жареной, но меньше, чем в запеченой.
Предпочтительно потреблять жирную рыбу: хамсу (анчоусы), карпа, палтус, сельдь, форель, скумбрию, семгу (лососевые), полосатого морского окуня, тунца, сиг.
ω-6 полиненасыщенные жирные кислоты
Линолевая кислота (ЛК), являющаяся основным представителем семейств ω-6 ПНЖК, содержится в растительных жирах (подсолнечном, кукурузном, соевом) и маргаринах на их основе. Арахидоновая кислота – в печени и молочном жире млекопитающих.
Было показано, что низкое потребление ЛК (< 4 % общей калорийности питания) и низкое ее содержание в организме человека (Финляндия, Шотландия) сопряжены повышенным риском возникновения ишемической болезни сердца [15]. Оптимальным считается потребление ЛК в количестве 6 % от общей калорийности пищи. Рекомендуется включать в рацион питания продукты, являющиеся пищевыми источниками γ-линоленовой кислоты, такие как соевые бобы, грецкие орехи, соевое масло.
Согласно рекомендациям ВОЗ, оптимальное соотношение в пище ω-6/ω-3 ПНЖК должно колебаться в пределах 5 : 1–8 : 1. При таком соотношении ПНЖК, поступающие в организм человека с пищей или медицинскими препаратами (длинноцепочечные ω-3 ПНЖК – ЭПК, ДГК), будут вступать в конкурентный антагонизм с ω-6 ПНЖК и, следовательно, могут реализовывать мембрано- и кардиопротективное действия – подавлять синтез арахидоновой кислоты из линоленовой кислоты, т. е. конкурировать с арахидоновой кислотой за места связывания с фосфолипидами мембран, повышать электрическую стабильность кардиомиоцитов и т. д. [11].
Как правило, пищевые добавки, содержащие ω-3 ПНЖК, хорошо переносятся больными, однако на фоне их приема возможны отрыжка с запахом или привкусом рыбы, боли в эпигастрии, тошнота, рвота, метеоризм, диарея или запор, обострение хронического панкреатита, редко – акне, экзема.
Противопоказаниями к применению пищевых добавок являются экзогенная гипертриглицеридемия (гиперхиломикронемия I типа), выраженные нарушения функции печени и почек, состояние после тяжелых скелетных травм и хирургических вмешательств (риск кровотечения), детский и пожилой возраст, беременность, лактация, одновременный прием фибратов и непрямых антикоагулянтов.
На российском рынке представлено достаточно большое количество пищевых добавок, содержащих ω-3 ПНЖК в своем составе, но основным препаратов является Омакор (Норвегия) – зарегистрированный фармацевтический препарат на основе ω-3ПНЖК, стандартизированный по качественному и количественному составу, имеющий доказательную базу эффективного использования в кардиологии. Клинический опыт последних лет позволил установить оптимальный режим дозирования стандартных препаратов ω-3 ПНЖК (1–4 г/сут не менее 2–4 месяцев).
В рандомизированном контролируемом исследовании с участием 4837 пациентов, перенесших ИМ, добавление в пищу малых доз маргарина, обогащенного ω-3 ПНЖК (400 мг/сут) или a-линоленовой кислотой (2 г/сут), не вызывало заметного снижения уровня ТГ. Такая пищевая добавка не вызывала заметного снижения частоты развития сердечно-сосудистых осложнений [16].
Статины и ω -3 жирные кислоты
Лечение с использованием ω-3 жирных кислот (4 г/сут) в комбинации с симвастатином (40 мг/сут) в течение 8 недель в рандомизированном двойном слепом плацебо-контролируемом исследовании 254 пациентов способствовало более выраженному снижению уровня ТГ (29,5 против 6,3 %) и вызывало небольшое, но статистически достоверное повышение уровня ЛПВП (2,4 против 1,2 %) по сравнению с применением только статинов [17].
Использование ω-3 жирных кислот в комбинации с правастатином и фенофибратом в рамках тройной схемы лечения вызывало дальнейшее снижение уровня ТГ и гомоцистеина, в т. ч. у пациентов с диабетической дислипидемией. Не было отмечено существенного взаимодействия ω-3 жирных кислот с другими лекарственными препаратами.
В исследовании JELIS (Japan EPA lipid intervention study) [18], включившем более 18, 5 тыс. пациентов с высоким сердечно-сосудистым риском, 100 % исследуемых получали статины (80 % с целью первичной профилактики, 20 % – вторичной). Прием ЭПК в дозе 1,8 г/сут на фоне стандартной терапии привел к статистически значимому снижению числа сердечно-сосудистых событий (на 19 %) по сравнению с плацебо. Это исследование проводилось в японской популяции, изначально имеющей высокий ω-индекс, т. к. в этой стране исторически высока культура потребления рыбы и морских продуктов. Применение ЭПК в комбинации с правастатином в низких дозах по сравнению с использованием только статинов снижало частоту развития коронарной патологии, не влияя на частоту внезапной коронарной смерти. Эти эффекты достигались без значительного изменения уровней ОХ, ЛПНП или ЛПВП и лишь с незначительным снижением уровня ТГ. Эйкозапентаеновая кислота, возможно, может снижать риск развития ССЗ через другие механизмы помимо снижения уровня ЛПНП. При проведении анализа в подгруппах такая комбинированная схема терапии также снижала частоту развития патологии коронарных сосудов у пациентов из группы высокого риска, имеющих метаболический синдром с высоким содержанием ТГ в крови и низким cодержанием ЛПВП [19].
ω-3 ПНЖК и метаболический синдром
Метаболический синдром характеризуется артериальной гипертензией, избыточной массой тела, повышенными уровнями ТГ и глюкозы, пониженным уровнем ЛПВП в плазме крови и повышенной экскрецией альбумина с мочой. Применение ω-3 ПНЖК способствует нормализации липидного профиля, снижению артериального давления (через вазодилататорные свойства эйко- и докозаноидов), препятcтвуют потере альбумина с мочой, тем самым оказывая разностороннее воздействие на метаболизм и уменьшая риск возникновения сахарного диабета.
В исследовании когорты из 3504 человек (40–69 лет, Корея) потребление рыбы более одного раза в неделю соответствовало более низкому риску развития метаболического синдрома (отношение шансов [ОШ] = 0,43, 95 % доверительный интервал [ДИ] – 0,23–0,83). Чем выше было потребление ω-3 ПНЖК, тем меньше был риск развития диабета (OШ = 0,53, 95 % ДИ – 0,28–0,99) [20].
Применение Омакора при остром коронарном синдроме
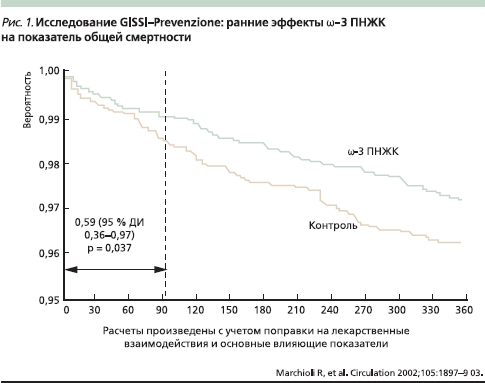
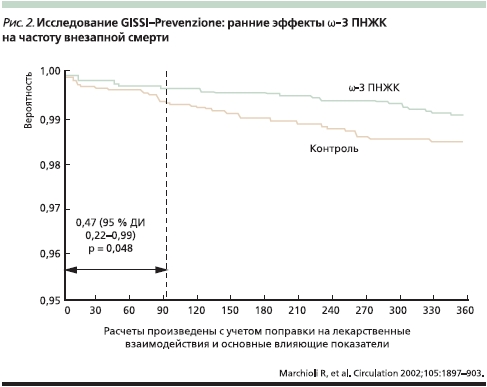
В многоцентровое рандомизированное плацебо-контролируемое исследование GISSI-Prevenzione study [21] были включены 11 323 больных, недавно перенесших (≥ 3 месяцев тому назад) ИМ. Эти больные в течение 3,5 лет принимали лекарственный препарат высокоочищенных ω-3 ПНЖК Омакор в дозе 1 г/сут (одна капсула содержит 84 % ЭПК и ДГК). В группах пациентов, принимавших Омакор, суммарный показатель, включавший смертность от всех причин, а также несмертельные ИМ и инсульты, был ниже на 15–16 %, чем в группе плацебо (р = 0,02), а риск смерти от ССЗ плюс несмертельный ИМ и инсульты был ниже, чем в группе плацебо, на 20–21 % ( р = 0,006). Наибольшим было снижение риска внезапной смерти – 45 % (р = 0,0006), которое проявлялось уже через 4 месяца лечения.
На рис. 1 показаны ранние эффекты ω-3 ПНЖК в исследовании GISSI-Prevenzione study на показатель общей смертности (расчеты произведены с учетом поправки на лекарственные взаимодействия и оcновные влияющие показатели). На риc. 2 показаны ранние эффекты ω-3 ПНЖК на частоту внезапной смерти в том же исследовании [22]. Анализ результатов исследования GISSI-Prevenzione study показал, что положительное влияние ω-3 ПНЖК наблюдается среди пациентов с дисфункцией левого желудочка после перенесенного ИМ, у которых высок риск смерти.
Исследовательская группа GISSI начала проведение еще одного исследования – GISSI and Prevenzionе (R@P) [23], направленного на изучение профилактических эффектов ω-3 ПНЖК у пациентов с высоким сердечно-сосудистым риском, но без истории ИМ. Более 12,5 тыс. пациентов участвуют в GISSI R@P. Сахарный диабет наряду хотя бы с одним фактором сердечно-сосудистого риска является основным критерием включения в это исследование (47 % пациентов).
Что касается рекомендации о повышении физической активности, то акцент делается на умеренном снижении массы тела и регулярных физических нагрузках аэробной направленности средней интенсивности, весьма эффективные для предотвращения развития абдоминального ожирения, метаболического синдрома, сахарного диабета 2 типа. Пациентам рекомендуются физические упражнения по 30 минут в день.
Сердечные аритмии и ω-3 ПНЖК
Существующие проблемы антиаритмической терапии (ограниченная эффективность, аритмогенное действие, экстракардиальные побочные эффекты и др.) диктуют необходимость поиска новых терапевтических подходов. Большой интерес представляет изучение возможностей применения при аритмиях ω-3 ПНЖК [24]. В экспериментальных и клинических исследованиях показано, что ω-3 ПНЖК обладают антиаритмическими свойствами; в частности, они блокируют вольтаж-зависимые натриевые каналы, кальциевые каналы L-типа и калиевые каналы [10]. Омега-3 ПНЖК оказывают благоприятное влияние на функцию вегетативной нервной системы, нарушение баланса которой способствует развитию аритмий и неблагоприятных сердечно-сосудистых исходов [25].
Омега-3-ПНЖК увеличивают вариабельность сердечного ритма (ВСP). Выявлена положительная корреляция между содержанием ДГК в мембранах клеток и увеличением ВСP у больных, перенесших ИМ, у больных с показаниями к проведению коронарографии, у здоровых лиц мужского пола и у женщин с исходно низкой ВСР [26].
В сравнительном эпидемиологическом исследовании Zutphen study [27] изучали эффективность систематического приема ω-3 ПНЖК (диета, содержащая в среднем 250 мг/кг ω-3 ПНЖК) на риск развития внезапной коронарной смерти 1373 пациентов в возрасте 40–60 лет. Срок ретроспективного анализа – 40 лет. Данные, полученные в этом исследовании, показали, что систематический прием длинноцепочечных ω-3 ПНЖК статистически значимо (р < 0,05) снижает риск развития внезапной коронарной смерти (в среднем на 54 %). При этом отмечено, что при регулярном приеме ω-3 ПНЖК каждое увеличение приема жирной рыбы на 20 г/сут статистически значимо (р = 0,03) уменьшает риск развития летального исхода на 7 %.
Согласно данным мета-анализа [28], в котором проанализированы результаты 13 рандомизированных исследований (средняя продолжительность – 11,8 года), включивших 22364 пациента, систематический прием ω-3 ПНЖК статистически значимо (р < 0,05) снижает риск летальности при коронарной болезни сердца.
Наибольшего антиаритмического эффекта при лечении ω-3 ПНЖК следует ожидать от больных ишемической болезнью сердца с желудочковыми нарушениями ритма без выраженных структурных изменений в миокарде, при нормальной или умеренно сниженной фракции выброса левого желудочка. В крупных рандомизированных контролируемых исследованиях установлена эффективность длительной терапии ω-3 ПНЖК в дозе 1 г/сут в профилактике сердечно-сосудистых исходов у пациентов с ИМ и сердечной недостаточностью, нередко ассоциированными с сердечными аритмиями.
Рабочей группой при Европейском обществе кардиологии (ESC – European Society of Cardiology) по изучению вопросов лечения больных острым ИМ с элевацией сегмента ST рекомендуется к проводимой терапии дополнительно назначать 1 г ω-3 ПНЖК, полученных из рыбьего жира (класс рекомендаций I, уровень доказательности В) [29].
Заключение
Одним из механизмов действия ω-3 ПНЖК является их влияние на синтез в печени ТГ и обогащенных ими ЛПОНП, а также усиление липопротеидлиполиза. Вследствие этого снижается содержание в плазме крови этих потенциально атерогенных липидных соединений при встраивании в них ω-3 ПНЖК, которые в основном потребляются с пищей [10].
Потребление длинноцепочечных ω-3 ПНЖК в дозах 3–4 г/сут и выше приводит к снижению гипертриглицеридемии за счет снижения синтеза ТГ, к снижению тромбогенеза, воспалительных и иммунных процессов, тонуса сосудов за счет конкуренции с арахидоновой кислотой в реализации синтеза тромбоксана, простагландина, лейкотриенов. Кроме того, свободные ЭПК м ДГК являются структурными компонентами клеточных мембран, так что их молекулы располагаются вблизи белков, формирующих натриевые, калиевые и кальциевые каналы и модифицируют функции трансмембранных ионных каналов. В связи с этим они оказывают антиаритмогенное действие, повышают ВСР, что положительно сказывается на снижении как общей, так и сердечно-сосудистой смертности, в наибольшей степени – внезапной смерти после перенесенного ИМ.
Результаты исследований, в которых изучалось влияние высокоочищенных ω-3 ПНЖК в виде препарата Омакор, доказали его высокую эффективность в снижении как общей смертности, так и смертности от ССЗ, особенно внезапной смерти пациентов, недавно перенесших ИМ. Применение стандартизированных препаратов ω-3 с высоким содержанием ПНЖК (т. н. ω-3 90 %, препарат Омакор) гарантирует положительный терапевтический эффект при адекватном дизайне клинического исследования [30]. Прием Омакора приводит к коррекции атерогенной дислипопротеидемии, главным проявлением которой является снижение уровня в плазме крови ТГ и холестерина ЛПОНП наряду с небольшим повышением уровня антиатерогенного ЛПВП [30–34].
Потенциально полезными эффектами ω-3 ПНЖК во вторичной профилактике являются конкурентное ингибирование продукции тромбоксана и лейкотриена В4, ингибирование агрегации тромбоцитов и образования тромбов, ингибирование или приостановка местного воспалительного процесса, вовлеченного в разрыв бляшки, включая экспрессию молекул эндогенной адгезии и хемотаксиса лейкоцитов [34–36].
Эффективность применения ω-3 ПНЖК настолько высока, что во многих странах препараты ω-3 ПНЖК, стандартизированные по химической структуре и процентному содержанию ПНЖК (более 90 %), вводятся в протоколы ведения пациентов с сердечно-сосудистой патологией (в т. ч. для лечения и профилактики хронической сердечной недостаточности) наряду с ацетилсалициловой кислотой, варфарином и другими препаратами [37].


