Введение
К одной из наиболее сложных проблем ведения пациентов с хроническим панкреатитом (ХП) относятся диагностика и коррекция внешнесекреторной недостаточности поджелудочной железы (ВНПЖ). Согласно современной дефиниции, ВНПЖ определяется как состояние, при котором количества секретируемых ферментов недостаточно для поддержания нормального пищеварения и физиологии человека [1]. Причины развития ВНПЖ различны (табл. 1), однако в большинстве случаев в основе ее формирования лежат воспалительное поражение экзокринной части поджелудочной железы (ПЖ) (при ХП, остром некротическом панкреатите), фиброз (исход любых панкреатитов, муковисцидоз), неоплазия (рак ПЖ), хирургические резекционные вмешательства на ПЖ [39].
Длительное прогрессирующее течение ХП, постепенное нарастание структурных изменений железы и степени ВНПЖ, персистенция абдоминальной боли с нередким постпрандиальным усилением и связанная с этим ситофобия неизменно приводят к трофологической недостаточности [2].

В свою очередь связанные с мальнутрицией осложнения могут приводить к сердечно-сосудистым и инфекционным заболеваниям, остеопорозу [3, 40]. Согласно ряду исследований, ВНПЖ без лечения ассоциирована с высокой смертностью после хирургических вмешательств, в т.ч. среди пациентов с нерезектабельным раком ПЖ [4, 5]. Абдоминальная боль у истощенных пациентов – наиболее часто наблюдаемый симптом и требует большей частоты и длительности госпитализации, нежели чем у пациентов без ВНПЖ [6, 41].
Заместительная ферментная терапия (ЗФТ) совместно с коррекцией питания на сегодняшний день служит основным методом лечения ВНПЖ, который используется в т.ч. и в качестве метода, доказывающего наличие ВНПЖ при положительных клиническом и лабораторном ответах на лечение.
Современные представления о диагностике ВНПЖ
Несмотря на клиническую значимость ВНПЖ, ее диагностика на практике является сложной задачей. Наиболее простым и распространенным методом диагностики в нашей стране остается качественное копрологическое исследование. Однако интерпретация его достаточно сложна и неоднозначна, поскольку нередко выявленные изменения (стеаторея, лиентерея и т.д.) могут иметь непанкреатическое происхождение [2].
В Европе и США «золотым» стандартом считается определение коэффициента абсорбции жира [7]. Однако этот тест является громоздким (подразумевает соблюдение диеты с высоким содержанием жира в отсутствие ЗФТ, сбор кала в течение 72 часов), сложный для пациентов, неприятный для лаборантов. Поэтому его применяют лишь в некоторых центрах в научных целях и для валидизации новых методов исследования экзокринной функции ПЖ. Кроме того, он неспе-цифичен, его данные почти всегда не укладываются в нормальные величины при поражении подвздошной кишки и бактериальной контаминации тонкой кишки.
Дыхательный тест с использованием 13С-смешанных триглицеридов (13С-СТГ-дыхательный тест) – точный, надежный, клинически приемлемый [8], но в нашей стране пока имеет ограниченное значение ввиду отсутствия зарегистрированного субстрата для его проведения [42]. Этот тест заключается в пероральном приеме С13-меченого субстрата (смесь триглицеридов), который гидролизуется в просвете кишки в степени, пропорциональной активности панкреатической липазы.
Тест на фекальную эластазу-1 (ФЭ-1) позволяет количественно оценить концентрацию панкреатической ФЭ-1. Это широкодоступный неинвазивный метод, успешно применяемый в качестве диагностики умеренной и тяжелой ВНПЖ при ХП и других заболеваниях ПЖ [9]. В настоящее время этот тест используется в качестве стандартного метода исследования экзокринной функции ПЖ. Однако относительно невысокая чувствительность эластазного теста при легкой степени ВНПЖ служит основанием для критических замечаний по поводу значимости этого метода. С его помощью можно уверенно диагностировать только тяжелую степень ВНПЖ. Следует учитывать также возможность ложных результатов при диарее любой этиологии, т.к. при этом происходит «разведение» кала и концентрация эластазы снижается. Следовательно, для получения достоверных данных необходима лиофилизация исследуемых образцов [43].
Классические прямые зондовые методы определения объема панкреатического сока, концентрации в нем ферментов и бикарбонатов в настоящее время имеют крайне ограниченное применение в диагностике ХП и ВНПЖ вследствие инвазивности, высокой стоимости, низкой доступности стимуляторов (до настоящего времени препараты не зарегистрированы для медицинского применения в РФ), а также из-за трудоемкости и плохой переносимости пациентами [2].
Таким образом, точность диагностики с использованием соответствующих эталонных методов недостаточно исследована с противоречивыми опубликованными результатами [10] и их оптимальные пороговые значения не определены. Существует потребность в альтернативных диагностических методиках для оценки ВНПЖ, которые являлись бы точными и легкоприменимыми в клинической практике.
Диагностика ВНПЖ: фокус на нутритивный статус
Как отмечено ранее, мальнутриция является главным следствием мальдигестии и ВНПЖ, именно поэтому оценка нутритивного статуса (НС) сегодня предлагается в качестве альтернативы для определения ее наличия у пациентов с ВНПЖ-ассоциированными заболеваниями [44].
До настоящего времени не определен единый подход к оценке состояния питания. Чаще всего в терминологии используются трофологический, пищевой, белково-энергетический или НС. Если исходить из того, что НС больного отражает как пищевой, так и метаболический компоненты состояния пациента, он представляется наиболее оптимальным для определения данного состояния, особенно для лиц с заболеваниями желудочно-кишечного тракта.
В то же время рутинная оценка питания редко проводится, т.к. для этого нет простого и соответствующим образом подтвержденного метода. Постоянная практика по определению группы риска больных мальнутрицией может быть весьма субъективной, т.к. зависит от интерпретации антропометрических данных, данных клинического обследования, а также знаний врача. Тяжелые случаи истощения относительно легко распознаются. Однако выявление больных с легким или умеренным недостатком питания или с риском возникновения этого состояния очень важно и не всегда проводится [40].
Для оценки НС используют комплекс клинических, антропометрических и лабораторных показателей, а также скрининговые методы, позволяющие выявлять больных группы риска мальнутриции.
Вес тела и индекс массы тела. Использование массы тела и антропометрических данных для определения пищевого статуса является темой для дебатов, в основном из-за отсутствия истинного золотого стандарта. Уровень потери веса в течение 6 месяцев, по мнению многих специалистов, – наиболее существенный клинический маркер недостаточности питания [11]. Однако индекс массы тела (ИМТ) не учитывает предварительного состояния пациентов, а также снижения объема мышечной массы [12]. Некоторые исследования показывают отсутствие корреляции между ИМТ и НС как инструмента оценки, в частности общей субъективной оценки [13], и гипотрофии как метода универсального скрининга. Кроме этого вполне очевидно, что больной может быть истощенным и с нормальным ИМТ или даже с ИМТ выше нормы [14, 45]. Однако в одном из исследований показано, что ИМТ значительно ниже у больных ХП с ВНПЖ, тяжелой стеатореей и биохимическим дефицитом питательных веществ по сравнению с пациентами без ВНПЖ [15]. Следует вспомнить, что не так давно в когортном исследовании была обнаружена положительная корреляция между ИМТ и уровнем ФЭ-1 у 101 больного алкогольным и тропическим ХП [16].
Другие антропометрические данные. Научные исследования в последнее время переходят от традиционной антропометрии к использованию визуализации для оценки состава тела. Признание того, что саркопения (потеря мышечной массы и силы) может возникать при наличии ожирения, скорее всего будет в центре внимания многих оценок питания [17].
Лабораторные показатели НС для диагностики ВНПЖ. Хорошо известен дефицит микро- и макронутриентов вследствие недостаточного питания пациентов с ВНПЖ. Распространенность отклонений в лабораторных исследованиях пищевых маркеров, включая витамины, минералы, микроэлементы и белки плазмы, была изучена в нескольких исследованиях.
Жирорастворимые витамины. Жиро-растворимые витамины относятся к числу наиболее хорошо изученных маркеров питания при ВНПЖ, недостаток их у пациентов с ХП и стеатореей описан еще несколько десятилетий назад [18].
Несколько исследований показали ассоциацию между уровнем витамина А и тяжестью ВНПЖ. Два небольших исследования при ХП свидетельствуют о высокой распространенности недостаточности витамина А при ВНПЖ [18, 19]. Однако большинство других исследований показывают, что дефицит витамина А не является клинически значимой проблемой. Недавние исследования показали аномально низкие уровни каротина в сыворотке только у 1 из 40 пациентов с ХП и с отсутствием связи между низким значением ФЭ-1 и витамином А в сыворотке крови [20, 21].
Распространенность дефицита витамина D у пациентов с ХП высокая в большинстве исследований и составляет от 33 до 87% независимо от статуса ВНПЖ или использования ЗФТ [20, 21]. В небольшом исследовании (40 пациентов с ХП) сообщалось о недостаточности витамина D, причем в большей степени у пациентов с ВНПЖ (53%) и особенно у больных ВНПЖ, не получающих ЗФТ (78%), по сравнению с пациентами без признаков ВНПЖ (33%) [21]. Другие исследования выявили высокую распространенность недостаточности витамина D при ХП без существенной разницы между наличием и отсутствием ВНПЖ [18, 22].
Безусловно, фактор, который необходимо учитывать в данном аспекте, – высокая распространенность дефицита витамина D в общей популяции. В двух из упомянутых выше исследований не было выявлено различий в распространенности дефицита холекальциферола у больных ХП по сравнению со здоровым контролем. Эти исследования были проведены в Ирландии [20] и Северной Германии [24], где низкая инсоляция может частично объяснить низкий уровень витамина D в организме. Аналогично при изучении муковисцидоза в США недостаточность витамина D была показана у 74% лиц в здоровой популяции (и у 90% пациентов с муковисцидозом на фоне ЗФТ с добавлением витамина D) [23]. В совокупности приведенные выше данные свидетельствуют о нецелесообразности оценки дефицита витамина D в диагностике ВНПЖ.
Ранние исследования показали высокую распространенность недостаточности витамина Е – от 67 до 83% пациентов с ВНПЖ или стеатореей имели уровень ниже референсных значений [18]. В других работах продемонстрированы значительно более низкие уровни витамина Е при ХП у пациентов со стеатореей [19].
В недавних исследованиях сообщения о распространенности недостаточности витамина Е у больных ХП определены как значительно более низкие – 2–24% [21, 24]. Возможно, свой вклад в это расхождение внесли различия в референсных значениях, в особенности у пациентов, принимающих полиферментные препараты и витаминные добавки.
Уровни витамина K в сыворотке были оценены в небольших исследованиях пациентов с ХП и ВНПЖ (без энзимотерапии), дефицит регистрировался с частотой 13–56% [18, 21]. Однако клинически значимый манифест дефицита витамина K крайне редок. В одном из исследований сообщалось об увеличении протромбинового времени в двух случаях, что было скорригировано с помощью лекарственных препаратов, в остальных случаях не наблюдалось каких-либо серьезных проблем (кровотечения или удлинения времени кровотечения). Не обнаружено также существенной разницы уровня витамина K у пациентов с ВНПЖ без таковой или же у больных, получающих ЗФТ [21].
Водорастворимые витамины. Иссле-дований на содержание в сыворотке крови водорастворимых витаминов у больных ВНПЖ немного. Статус витамина B12 изучали в двух исследованиях. Дефицит встречается крайне редко у больных ХП с (0 и 6%) и без (0 и 0%) ВНПЖ, не было в целом соответствия между степенью ВНПЖ и уровнем витамина B12 [25, 26]. Также сообщалось о низкой распространенности недостаточности фолиевой кислоты в обоих исследованиях, и ее уровни не коррелировали с ВНПЖ [26].
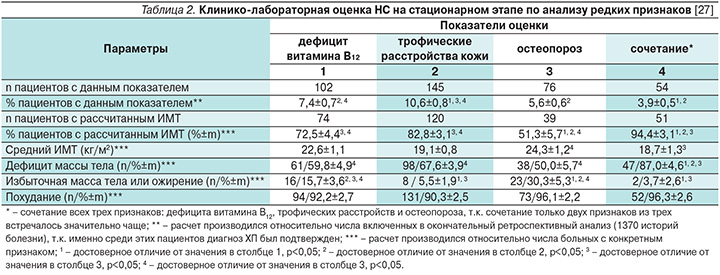
В ранее проведенном нами ретроспективном исследовании у 10,6% пациентов с ХП были зафиксированы признаки трофических расстройств кожи (что позволило предполагать наличие дефицита витаминов А, аскорбиновой кислоты, железа), 7,4% пациентов имели дефицит витамина B12. Остеопороз, по результатам денситометрии, имел место у 5,6% пациентов, у 3,9% выявлено сочетание остеопороза, дефицита витамина B12 и трофических изменений кожи [27] (табл. 2).
Белки плазмы. Суммарные и фракционные белки плазмы часто используются в качестве маркеров гипотрофии в целом. Аномально низкие концентрации общего белка в плазме представляются редкой находкой у пациентов с ХП и ВНПЖ [26]. В исследовании N. Lasztity распространенность гипоальбуминемии сообщалась у 11% из 35 пациентов с ХП и ЗФТ [38]; два других исследования сообщили о более высокой распространенности белковой недостаточности у пациентов с ВНПЖ и без нее (39 против 12%, 16 против 1%) [16, 26]. По результатам наших ранних публикаций [27], у пациентов с ХП показатели альбумина крови оказались сниженными статистически достоверно (p<0,05).
По сравнению с альбумином преальбумин – более ранний маркер дефицита питания при ХП и ВНПЖ. В небольшом исследовании (54 пациента с алкогольным и тропическим ХП, большинство с ВНПЖ), проведенном в Индии, дефицит преальбумина составил 63% [28]. Однако необходимо учитывать, что эти пациенты имели средний ИМТ 19,2 кг/м2 и у них могли присутствовать дополнительные причины гипотрофии. Европейские исследования свидетельствуют о частоте дефицита протеинов в пределах 23–24% [15, 26] у больных ХП и ВНПЖ и в пределах 5% при ХП без ВНПЖ [26].
Еще один плазменный белок, потенциально полезный в качестве маркера оценки питания, – ретинол-связывающий (РСБ). По результатам исследования F. Marotta, отмечены значительно более низкие уровни РСБ у больных ХП со стеатореей по сравнению с пациентами без нее [19]. В одном из исследований (31 клинически стабильный пациент с прогрессирующим алкогольным ХП и документально подтвержденной стеатореей) уровень РСБ был снижен у всех пациентов без энзимотерапии и у половины пациентов, принимавших полиферментные препараты [15]. Дальнейшее исследование распространенности низких значений уровня РСБ, связанных с ВНПЖ, установило существенное различие: дефицит РСБ у 24% больных ВНПЖ и у 8% без нее [26]. Как и для преальбумина, низкий уровень РСБ был значительно реже в рандомизированных клинических исследованиях больных ХП с ВНПЖ и постоянной энзимотерапией [29].
Минералы и микроэлементы. При сравнении результатов исследований пациентов с ВНПЖ и без нее уровни цинка в крови оказываются различными. Корреляция между ВНПЖ и концентрацией цинка в сыворотке предположительно связана с низким содержанием ФЭ-1, снижением концентрации цинка в эритроцитах при ХП и после панкреатодуоденальной резекции [30]. В одном из исследований абсорбция цинка была снижена у нескольких пациентов с ХП и ВНПЖ по сравнению с здоровым контролем [31]. Объяснить измененную абсорбцию цинка у пациентов с ВНПЖ можно снижением секреции в соке ПЖ связывающих белков, необходимых для усвоения цинка [32]. Можно предположить, что снижение поглощения цинка при ВНПЖ в большинстве случаев может быть скомпенсировано за счет гомеостатических механизмов регулирования. Кроме того, цинк может быть легко доведен до нормального уровня или даже выше с помощью заместительной энзимотерапии и биодобавок с цинком – исследования показали нормализацию уровня цинка у всех пациентов [33].
Менее 1% всего магния организма находится в сыворотке крови, поэтому этот маркер не считается диагностически информативным. В исследовании распространенности дефицита магния с помощью внутривенного теста с магнезиевой нагрузкой 10 из 13 пациентов с ХП (большинство с ВНПЖ) продемонстрировали признаки дефицита магния и только 1 имел явную гипомагниемию [34]. В другом исследовании провели корреляцию между уровнем сывороточного магния и ВНПЖ у пациентов с ХП [26]: продемонстрирована линейная корреляция между концентрацией магния в сыворотке крови и степени мальабсорбции жира. Уровень магния в сыворотке крови был значительно ниже у пациентов с ВНПЖ по сравнению с таковым у пациентов без ВНПЖ (среднее значение 1,87±0,19 против 2,09±0,18 мг/дл соответственно). Уровень магния <2,05 мг/дл был обнаружен у пациентов с ВНПЖ с чувствительностью 0,88 (0,66–0,97) и специфичностью 0,66 (0,48–0,80).
Исследований связи между уровнем кальция в сыворотке крови и ВНПЖ очень мало. Небольшие исследования, сравнивавшие больных ХП (статус ВНПЖ не уточняется) с контролем, не показали никаких значимых отличий [35]. Проведено лишь одно исследование по оценке уровня кальция в соответствии с состоянием ВНПЖ, при этом не выявлено никакой разницы между больными ХП с и без ВНПЖ [22].
Изучена связь между ВНПЖ и сывороточными маркерами, такими как железо, трансферрин и ферритин.
В двух исследованиях не найдено доказательств дефицита железа у больных ХП с ВНПЖ и без нее [15, 26]. При оценке ЗФТ у больных ВНПЖ средние уровни трансферрина были в пределах нормы [29].
Липиды. Прежние исследования показали более низкий общий уровень липидов в крови у больных ХП со стеатореей [36]. В недавнем исследовании пациентов с ВНПЖ средние уровни триглицеридов оказались неожиданно значительно выше у больных ВНПЖ, также отмечена статистически незначимая тенденция к снижению уровня общего холестерина у пациентов с ВНПЖ [81]. У пациентов с ХП, ВНПЖ с энзимотерапией, включенных в рандомизированные клинические испытания, уровни общего холестерина, липопротеидов высокой и низкой плотности, а также триглицеридов были в пределах нормы [29, 37].
Выводы
ВНПЖ часто возникает вторично в результате поражения экзокринной части ПЖ при ХП, муковисцидозе, раке ПЖ, а также после резекции ПЖ [1]. Однако диагностика ВНПЖ сложная. Тесты непосредственной оценки НС громоздки, неспецифичны или ограничены. Тест на ФЭ-1 широко используется, но оптимальные референсные значения для ВНПЖ четко не определены и ее диагностическая точность довольно низкая при легкой панкреатической недостаточности.
Имеются ограниченные доказательства по оценке ИМТ и других антропометрических параметров, чувствительных для диагностики ВНПЖ. Нутритивный дефицит – наиболее значимое следствие ВНПЖ, и нормализация пищевого статуса остается основной задачей ЗФТ. Таким образом, использование детальной оценки питания для диагностики ВНПЖ и мониторинга эффективности энзимотерапии – привлекательный подход в клинической практике. Наличие недостаточности питания может быть использовано для оценки вероятности ВНПЖ у пациентов с заболеваниями ПЖ в клинической ситуации, когда надежные функциональные тесты отсутствуют или если другие возможные причины неполноценного питания (например, ограничения по питанию) могут быть исключены.
Среди оцениваемых витаминов – витамины группы В, витамин Е, представляются как наилучшие маркеры ВНПЖ, поскольку некоторые исследования показали связь между их уровнем и ВНПЖ [19, 36]. Хотя большинство пациентов с ХП и ВНПЖ имеют дефицит витамина D [18, 20], он не является информативным маркером ВНПЖ из-за высокой распространенности его дефицита в общей популяции, по крайней мере в северных странах [20, 24]. Тем не менее это представляется важной клинической проблемой для больных ХП с учетом высокой частотой нарушений метаболизма костной ткани [3]. Клиническое значение дефицита других жиро- и водорастворимых витаминов, их использование в диагностике ВНПЖ менее заметны. Следует также учитывать, что содержание в сыворотке крови липидов и жирорастворимых витаминов является недостаточным маркером. Оценка уровня белков плазмы также может быть полезной для диагностики ВНПЖ, т.к. имеются убедительные данные снижения уровня РСБ как минимум у пациентов с ХП [19, 26]. Основываясь на результатах единственного исследования, низкий уровень сывороточного магния может быть точным маркером для прогнозирования ВНПЖ [26]. В этом исследовании при оценке пищевых маркеров у пациентов с ХП уровень магния в сыворотке крови составил <2,05 мг/дл и показал себя как самый высокий коэффициент соотношения для ВНПЖ с гемоглобином, альбумином, преальбумином. Уровень РСБ оказался ниже нормы, а уровень гликированного гемоглобина выше верхней границы нормы. Эти параметры также показаны в ассоциации с ВНПЖ [26]. Основываясь на этих выводах, авторы предположили, что нормальный пищевой статус (магний >2,05 мг/дл, нормальные уровни гемоглобина, альбумина, преальбумина, РСБ и гликированного гемоглобина) может исключить ВНПЖ у этих пациентов [26].
Поскольку лишь небольшая часть пациентов с ВНПЖ, возможно, имеет недостаток одного конкретного параметра, оценка пищевого статуса должна включать несколько нутритивных маркеров: как минимум уровни циркулирующих в крови жирорастворимых витаминов (преимущественно витамин Е), преальбумина, РСБ, цинка и магния [26]. Дополнительные параметры крови, а также антропометрические измерения обычно требуются для полной оценки пищевого статуса, но имеют ограниченную ценность для диагностики ВНПЖ.
Важно отметить, что дефицит всех пищевых маркеров, о которых ведется речь, конкретный для ВНПЖ, а другие причины (т.е. хронические заболевания печени, воспалительные реакции, недостаточное питание и т.д.) должны быть рассмотрены в контексте у отдельных пациентов. Для полной оценки диагностической чувствительности и специфичности различных питательных и антропометрических параметров при ВНПЖ и их эффективного использования в мониторинге ЗФТ требуется большое перспективное в идеале многоцентровое исследование, учитывающее правильную классификацию пациентов по заболеванию (например, ХП) и имеющее соответствующие референтные тесты для внешнесекреторной недостаточности ПЖ.


