Распространенность язвенной болезни (ЯБ) желудка и двенадцатиперстной кишки (ДК), по данным современной литературы, имеет тенденцию к снижению, более характерную для стран Западной Европы и Северной Америки [1]. Недолеченные случаи ЯБ служат главной причиной геморрагических осложнений (ГО), доля которых достигает 70% от всех осложнений данного заболевания и 50–70% – от общего числа кровотечений из верхнего отдела желудочно-кишечного тракта [2]. Поэтому ГО при ЯБ остаются одной из главных причин экстренных госпитализаций [3, 4]. Актуальность проблемы подчеркивается уровнем летальности, которая колеблется от 6 до 14%, а в группе пациентов с тяжелым кровотечением достигает 50% [6, 7]. Несмотря на достоверное снижение частоты обострений ЯБ после внедрения эрадикационной терапии Нelicobacter pylori [8, 9], риск кровотечений остается высоким из-за приема нестероидных противовоспалительных препаратов и антитромбоцитарных средств при заболеваниях сердечно-сосудистой системы, особенно у пожилых больных, а также из-за наличия коморбидной патологии [5, 1–12]. С целью профилактики кровотечений необходимо учитывать основные патогенетические аспекты формирования ГО – клинический, геморрагический и микроциркуляторный. Однако данные литературы, касающиеся оценки гемостаза при ГО, чаще затрагивают особенности острых эпизодов кровотечений, содержат противоречивые сведения о клинических особенностях ЯБ, причем проведенные исследования зачастую не предусматривали изучения микрогемоциркуляции в гастродуоденальной слизистой оболочке (СО) у больных ГО в анамнезе [3].
Цель исследования: изучение особенностей клинического течения заболевания и состояния плазменного гемостаза, а также скорости регионарного гастродуоденального мукозального кровотока и гистологических изменений СО желудка у пациентов с ЯБДК с ГО в анамнезе.
Материал и методы
Сравнительный анализ клинических данных (пол, возраст, давность заболевания, сроки возникновения ГО после выявления заболевания, статус курения, групповая принадлежность крови, семейный анамнез) был проведен 208 больным ЯБДК с ГО в анамнезе (157 мужчин и 51 женщина; средний возраст – 35,2±2,8 года), которым не проводилось хирургического вмешательства, и 300 пациентоам с неосложненной ЯБДК (231 мужчина и 69 женщин; средний возраст – 34,8±2,4 года). Оценка параметров гемостаза была проведена 129 больным ЯБДК с ГО в анамнезе (105 мужчин и 24 женщины; средний возраст – 33,4±2,3 года) и 138 – с неосложненной ЯБДК (114 мужчин и 24 женщины; средний возраст – 34,7±2,5 года). Контрольную группу составил 51 практически здоровый человек: 41 мужчина и 10 женщин в возрасте от 17 до 27 лет (средний возраст – 31,2±2,3 года). Состояние плазменного гемостаза оценивали с помощью тромбоэластографии (тромбоэластограф «TEG 5000») [13, 14]. Учитывались параметры, которые продемонстрировали статистически значимые сдвиги при сравнении неосложненной и осложненной ГО ЯБДК: Ci – индекс коагуляции и КCi – коэффициент индекса коагуляции; r+k – индекс хронометрической коагуляции и Кr+k – коэффициент индекса хронометрической коагуляции; E/K – индекс структурной коагуляции и КE/K – коэффициент структурной коагуляции; угол α – угловая константа, отражающая динамику образования фибрина, а также время реакции образования тромбопластина (R) и время образования сгустка (К) – показатель уровня протромбина. Для вычисления интегральных коэффициентов Кci и КЕ/К значение изучаемого параметра соотносили со средним значением в контрольной группе. При вычислении интегрального коэффициента Кr+k, величина которого уменьшалась при гиперкоагуляции, использовали обратное соотношение – среднее значение в контрольной группе соотносили со значением изучаемого параметра, что позволило выявлять однонаправленные сдвиги.
Во время эзофагогастродуоденоскопии провели биопсию СО антрального отдела желудка. Гистологическое состояние СО желудка оценивали в срезах, окрашенных гематоксилином и эозином, с раздельной оценкой (в баллах) воспалительной (мононуклеарной) инфильтрации, кишечной метаплазии и железистой атрофии. Измерение скорости регионарного кровотока в различных отделах гастродуоденальной СО полярографическим методом (LP-60, Чехия) по клиренсу водорода во время эзофагогастродуоденоскопии было произведено 86 больным неосложненной ЯБДК, 31 пациенту с ЯБДК с ГО в анамнезе и 15 лицам контрольной группы с вычислением кровотока по формуле: К=69,3/Т/2 мл/мин/100 г. Анализу были подвергнуты кривые кровотока, соотнесенные только к периоду моторного покоя желудка и ДК. Все больные ЯБДК и лица контрольной группы были сопоставимыми по возрасту и полу.
При статистической обработке данных была использована компьютерная программа «Excel 10». Количественные данные представлены в виде среднего значения (X) и стандартной ошибки среднего (m) с определением 95% доверительного интервала (p<0,05). При сопоставлении данных использовали парный критерий Стьюдента.
Результаты и обсуждение
Для группы больных ЯБДК, осложненной кровотечением в анамнезе, по сравнению с лицами с неосложненным течением заболевания были характерны следующие особенности: 1) доля мужчин в 1,5 раза меньше, но с более чем двукратным преобладанием над женщинами (коэффициент мужчины/женщины – 2,4 против 3,3; р<0,05); 2) в 1,5 раза большая частота положительного семейного анамнеза ЯБ (р<0,01); 3) более выраженная распространенность носительства 0(1) группы крови (52,2±4,3 против 35±5,1%; р<0,01), более характерная для женщин, чем для мужчин (59,4±3,7 против 25,0±6,1%; р<0,01); 4) в 1,4 раза большее число курящих (74,3±4,1 против 54,2±4,3%; р<0,05). В группе больных ЯБДК, осложненной кровотечением, отмечена более частая манифестация ГО в возрасте от 31 года до 40 лет по сравнению с другими возрастными периодами (29,1±2,5%) с преобладанием развития ГО в первые 5 лет от начала заболевания. У каждого 6-го больного ГО в анамнезе (17±5%) кровотечение являлось первым проявлением ЯБДК. По мере увеличения времени после развития первого кровотечения статистически значимо (р<0,05) возрастала вероятность повторных эпизодов ГО – с 13,9% в первые 5 лет до 35,3% через 5 и более лет, а среднее число рецидивов кровотечений в расчете на 1-го больного увеличилось в среднем с 1,7 до 3,7 соответственно временным периодам.
Изучение морфологии СО антрального отдела желудка у пациентов с неосложненной ЯБДК и больных ГО в анамнезе не выявило статистически значимых различий выраженности лимфоплазмоцитарной инфильтрации (1,4±0,03 и 1,5±0,07 балла соответственно), кишечной метаплазии (0,4±0,03 и 0,5±0,06 балла соответственно) и железистой атрофии (0,6±0,030 и 0,5±0,05 балла соответственно).
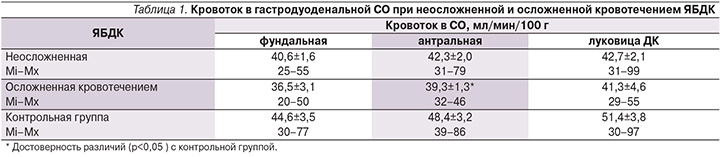
Состояние регионарного кровотока в гастродуоденальной СО у больных ЯБДК – неосложненной и осложненной кровотечением в анамнезе – изучалось вне обострения заболевания, т.е. в стадии белого рубца (табл. 1). Оказалось, что больные ГО в анамнезе характеризовались наименьшими величинами кровотока в СО фундального отдела желудка, но данная тенденция была статистически недостоверной. Результаты определения кровотока в СО антрального отдела желудка были несколько иными. Величины регионарного кровотока у больных неосложненной ЯБДК не отличались от таковых у здоровых лиц, а скорость кровотока у больных ЯБДК с ГО в анамнезе была на 19% меньше, чем у здоровых (р<0,05). Показатели кровотока в СО луковицы ДК у больных неосложненной ЯБ, пациентов с кровотечением в анамнезе, а также у здоровых лиц были статистически близкими. Таким образом, можно констатировать, что у больных ЯБДК наличие кровотечения в анамнезе существенно не отразилось на морфо-микроциркуляторном состоянии гастродуоденальной зоны.
Анализ параметров коагуляционных свойств плазмы крови показал статистически значимое преобладание свертывающего потенциала у пациентов с неосложненной ЯБДК и ЯБДК с ГО в анамнезе по сравнению с лицами контрольной группы (табл. 2). Так, временные параметры формирования сгустка (R и К) были достоверно укорочены (р=0,009), отразив более высокую скорость сгущения крови, а увеличенный угол α (р=0,05) указывал на более интенсивную структурную динамику формирования фибрина. Больные ЯБДК с ГО в анамнезе имели более выраженные гиперкоагуляционные сдвиги со стороны плазмы крови, чем пациенты с неосложненной ЯБДК: интервал R был короче на 21% (р=0,01), К – на 17% (р=0,05), а угол α увеличен на 36% (р=0,001).

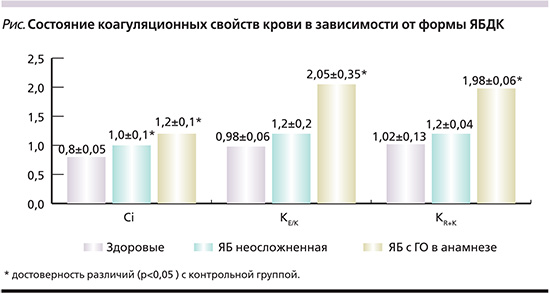
Также было установлено, что у больных ЯБДК с ГО в анамнезе по сравнению с больными неосложненной ЯБДК индекс коагуляции (Ci) был повышен в 1,2 раза (р=0,01), что свидетельствовало о более высокой свертывающей активности плазмы (см. рисунок). Интегральные коэффициенты индексов структурной (КЕ/К) и хронометрической (КR+К) коагуляций у лиц с ГО в анамнезе были в среднем на 66% (р=0,01) выше, чем при неосложненной ЯБДК. Эти различия касались как средних величин, так и частот выхода указанных показателей за верхнюю границу нормы. Так, частота превышения верхней границы нормы коэффициента индекса коагуляции (КCi) была в 1,5 раза больше у пациентов с ГО, чем у больных неосложненной ЯБ (48±5 против 33±5%; р=0,05), величина коэффициента индекса структурной коагуляции (КЕ/К) также была у них в 1,3 раза выше (57,3±4,1 против 44,2±4,8%; р=0,02), а частота превышения верхней границы нормы индекса хронометрической коагуляции (Кr+k) была одинаковой в обеих группах (25,3±4,8 и 23,3±5,0%).
Выявленные сдвиги коагуляционных свойств крови коррелировали с частотой и давностью ГО. У мужчин с ЯБДК, перенесших ≥2 эпизодов кровотечений, наблюдались разнонаправленные изменения временных (Кr+k был в среднем на 35,6% меньше) и структурных (E/K был на 42,4% выше) одноименных параметров в контрольной группе (р<0,01), что свидетельствовало о гиперкоагуляционных сдвигах. Аналогичные изменения были выявлены и у мужчин с «ранними» кровотечениями (срок от эпизода кровотечения до обследования не превышал трех месяцев). В то же время у лиц с однократными кровотечениями показатели свертываемости крови были близки к таковым контрольной группы.
Заключение
Проведенное исследование показало, что среди больных ЯБДК с ГО преобладали лица мужского пола, у которых первые признаки заболевания проявились в возрасте старше 30 лет, с положительным семейным анамнезом, группой крови 0(I), курящие, что находит подтверждение в научной литературе [6, 12]. По нашим данным, кровотечение в качестве первой манифестации ЯБ чаще встречалось среди женщин. Обращает на себя внимание отсутствие гистологических и микрогемоциркуляторных различий гастродуоденальной СО у больных неосложненной ЯБДК и пациентов с ГО в анамнезе. Ранее было показано, что изменения в распределении кровотока в СО желудочно-кишечного тракта в большей степени определяются фазой ЯБ [15]. Наши данные подтверждают более значимое влияние на вероятность развития ГО при ЯБ динамических изменений системы гемостаза. Причина выявленных гиперкоагуляционных сдвигов не может быть однозначной. Известно, что повышение тромбопластиновой активности крови и структурных свойств сгустка коррелирует с увеличением частоты геморрагических эпизодов. При этом у больных ГО в анамнезе описаны такие изменения, как повышение симпатической активности вегетативной нервной системы [16], увеличение фибринолиптической активности крови [17], возрастание агрегационной способности тромбоцитов [18], развитие эндотелиальной дисфункции, а также нарушения сосудистой стенки [19]. Не исключено, что развитие геморрагий при повышенной свертывающей активности крови может стать не только результатом влияния на гемостаз факторов агрессии, индуцируемых Н. pylori. С учетом того что СО желудка и ДК содержит активный тромбопластин и активаторы плазминогена, а в СО, окружающей язву, обнаруживается плазминоген и плазмин [17], влияние желудочного и дуоденального содержимого, провоспалительных цитокинов и хемокинов, а также ионов водорода, диффундирующих через порозный гистогематический барьер в кровяное русло, отчасти может объяснить причину кровотечения при гиперкоагуляционных сдвигах. Таким образом, прогностическое уменьшение вероятности ГО при ЯБ должно базироваться не только на учете таких факторов, как инфицированность НР, прием нестероидных противовоспалительных препаратов, пожилой возраст и наличие сопутствующей патологии, но и на обязательном мониторинге и коррекции плазменного гемостаза.


