Инфекция Helicobacter pylori является одной из наиболее распространенных среди людей. Более 50 % населения мира (более 3 млрд человек) инфицированы H. pylori. В странах Европы уровень инфицированности колеблется в пределах от 7 до 33 %, в России в настоящее время инфицированы 60–90 % населения в зависимости от частоты природных характеристик региона, этнографических особенностей жителей и социально-экономических условий [1, 2]. Носителем Н. pylori служит почти каждый второй человек, и передача микроба чаще всего осуществляется от человека к человеку. Колонизация слизистой оболочки желудка (СОЖ) происходит в раннем детском возрасте при тесном контакте ребенка с матерью. При этом почти в половине случаев возникает острое заболевание, которое в последующем переходит в разные формы хронического страдания. Все пути передачи возбудителя хеликобактериоза, очевидно, связаны только с человеком – без участия промежуточных хозяев или переносчиков. Наиболее изучен контактный путь передачи инфекции от больного человека или бактерионосителя орально-оральным или фекально-оральным путем [3].
К настоящему времени не только расшифрован геном Н. руlori, но и изучены достоверные характеристики его свойств, ассоциированность бактерии с широко распространенной патологией желудка и двенадцатиперстной кишки. Наиболее важные факторы патогенности микроорганизма приводят к синтезу белковых продуктов, которые вносят изменения в регуляторные и защитные механизмы организма хозяина, дезорганизуя их работу [4]. Наиболее изученной частью генома H. pylori является остров патогенности (PAI). Это область хромосомы, в которой сконцентрировано около 40 генов, кодирующих синтез факторов патогенности, обусловливающих вирулентность H. pylori. Чем больше генов PAI присутствует в геноме H. pylori, тем выше его потенциальная опасность для человека. Наиболее патогенными считаются гены группы cag, кодирующие синтез цитотоксинов; ureA, ureB, ureC, VacA – васкуолизирующий цитотоксин; sodB, кодирующий супероксидисмутазу; kat – каталазу; flaA, flab – жгутиковые антигены; iceA – ген, кодирующий фермент, вырабатываемый при контакте с эпителиальными клетками; BabA – белок, обеспечивающий адгезию к эпителиальной клетке и др. Кроме того, при лечении инфекции H. pylori необходимо учитывать, что в геноме микроорганизма присутствуют гены и точечные мутации, определяющие развитие резистентности к лекарственным препаратам, например frxA, fdxB, rdxA – кодирующие ферменты окислительного метаболизма, которые формируют резистентность к метронидазолу, широко используемому в лечении как хеликобактериоза, так и заболеваний пародонта [5, 6].
Впервые в 1998 г. в России на морфологическом уровне была доказана возможность генерации активных форм кислорода мембранными структурами самого микроорганизма благодаря генам, кодирующим ферменты окислительного метаболизма, что также совпадает с результатами исследований, проведенных в Японии [7, 8]. Позже группой ученых во главе с В.Г. Жуховицким было выявлено, что способность к продукции и динамика выброса активных форм кислорода у разных штаммов существенно различаются, что обусловливает различную степень их вирулентности [9]. Доказано, что при старении культуры H. pylori и применении антибактериальной терапии резко уменьшается количество вегетативных бактерий и возрастает число кокковых форм, которые считаются нежизнеспособными и некультивируемыми. Однако даже ферменты кокковых форм обладают очень высокой окислительной активностью [10]. Это весьма существенно, т.к. неудачная попытка эрадикации или прием антибиотиков по поводу интеркуррентных заболеваний создает опасность активации окислительных ферментов микроорганизма с усилением генерации активных форм кислорода и как следствие – опасность повреждения СОЖ [11]. Это говорит о необходимости следования утвержденным стандартам эрадикации хеликобактерной инфекции желудочно-кишечного тракта, в т.ч. сочетанной с воспалительными заболеваниями пародонта. Самым мощным фактором патогенности H. pylori считается белок CagA, кодируемый геном cagA, результатом деятельности которого является активная продукция интерлейкина-8, сильнейшего провоспалительного цитокина. Инфицирование штаммами H. pylori, содержащими cagA, сопровождается более выраженной воспалительной реакцией в СОЖ и двенадцатиперстной кишки и, соответственно, увеличивает риск развития ассоциированных с H. pylori язвенной болезни и рака желудка [12].
Наиболее благоприятными условиями для жизни, роста и размножения микроорганизма считаются температура +37 °С и рН среды 4,0–6,0, хотя H. pylori выживает и при более низких значениях рН. Способность H. pylori выживать в кислом содержимом желудка обеспечивается в основном высокой уреазной активностью и продукцией белка, ингибирующего секрецию соляной кислоты. В желудке всегда присутствует мочевина, проникающая в его полость через стенки капилляров. Уреаза расщепляет мочевину и за счет аммиака нейтрализует ионы водорода. Характерной особенностью H. pylori является то, что уреаза располагается не только в цитоплазме бактерии, но и на поверхности клеток. Будучи сильным антигеном, фермент связывает антитела, которые могли бы повредить H. pylori, и комплекс уреаза-антитело удаляется с поверхности клеток. Уреаза H. pylori действует как токсин, поскольку ионы аммония, образующиеся при гидролизе мочевины, повреждают эпителий; усиливает воспалительные реакции за счет активации моноцитов и нейтрофилов, стимуляции секреции цитокинов, образования радикалов кислорода и окиси азота, кроме того, большая субъединица уреазы (UreB) действует как аттрактант для лейкоцитов. Взаимодействие оксидазной и уреазной систем позволяет микроорганизму перекрывать большой диапазон изменений pH в своем микроокружении. В условиях кислой среды работает уреаза, ощелачивая среду, тогда как оксидазы не работают, при повышении pH > 6 включаются в работу оксидазные ферменты, закисляющие микросреду. Велико значение муциназы, продуцируемой H. pylori, в уменьшении защитных свойств СОЖ. Под влиянием фермента происходит разрушение муцина желудочной слизи, что приводит к локальному снижению ее вязкости. Гликосульфатная активность H. pylori снижает вязкость слизи с помощью сульфатированных гликопротеинов, которые выполняют роль механического барьера, защищающего слизистую оболочку от инфицирующих агентов. В качестве обязательных факторов колонизации H. pylori считают γ-глутамилтранспептидазу – ключевой фермент в метаболизме глутатиона.
 Вслед за инвазией существенным этапом на пути развития большинства инфекционных заболеваний является адгезия бактерий к клеткам и элементам соединительной ткани. У H. pylori выявлено несколько адгезинов, определяющих выбор хозяина и взаимодействующих с эпителиальными клетками. Из их числа лучше всего изучены – белки Bab, гемагглютинин (NLBH).
Вслед за инвазией существенным этапом на пути развития большинства инфекционных заболеваний является адгезия бактерий к клеткам и элементам соединительной ткани. У H. pylori выявлено несколько адгезинов, определяющих выбор хозяина и взаимодействующих с эпителиальными клетками. Из их числа лучше всего изучены – белки Bab, гемагглютинин (NLBH).
В качестве рецепторов адгезины H. pylori используют остатки сиаловых кислот (как, например, NLBH), сульфогруппы гликопротеинов, гликолипиды, фосфолипиды и остатки фукозы Льюис-подобных антигенов (как Bab) [13].
Помимо адгезинов к числу факторов, предохраняющих H. pylori от действия защитных сил и химиотерапевтических средств, следует отнести способность микроба к инвазии эпителиальных клеток. Высокая патогенность H. pylori связана с наличием токсинов, из которых лучше всего изучен цитотоксин А, вызывающий вакуолизацию эпителия путем образования пор в цитоплазматической мембране, уменьшение содержания АТФ в эпителиоцитах, изменение цитоскелета эпителиоцитов, что приводит к замедлению заживления микродефектов эпителия. Предполагается, что с цитотоксичностью могут быть также связаны поверхностные белки H. pylori, которые реагируют с плазминогеном и одновременно с ингибитором-2 плазмина, а также макроглобулином-2. В итоге происходит превращение плазминогена в плазмин, обладающий высокой протеолитической активностью. Большое значение имеет способность H. pylori индуцировать, активировать или стимулировать целлюлярные продукты макроорганизма, вызывать индукцию фактора активации тромбоцитов, лейкотриенов, прокоагулянтной активности, стимуляцию интерлейкинов и фактора некроза опухоли, активацию цитохрома P450, активацию системы комплимента, что приводит к инфильтрации лейкоцитами СОЖ. К факторам патогенности также относят наличие ферментов: каталазы, оксидазы, щелочной фосфатазы, алкогольдегидрогеназы, глюкосульфосфатазы, протеазы, фосфолипазы. Изучение факторов патогенности важно для расшифровки механизма развития инфекционного процесса и для решения проблемы специфической профилактики заболевания.
В настоящее время доказано, что проблема хеликобактериоза касается не только патологии желудочно-кишечного тракта, но и смежных областей, в частности стоматологии, т.к. многие авторы рассматривают полость рта как возможный источник инфицирования H. pylori и рецидивирования язвенной болезни [1, 14, 15]. Активно обсуждается вопрос и об участии полости рта в реинфицировании организма H. pylori и рецидивах заболевания. Ряд российских и зарубежных ученых в своих работах отмечают высокую вероятность рецидива язвенной болезни и хронического гастрита, ассоциированных с H. pylori, в результате неполноценной эрадикационной терапии, возможной из-за неэффективности некоторых хеликобактерных средств, недостаточности сроков лечения, сохранения резервуаров инфекции, в т.ч. в полости рта пациентов [14, 16].
За последние годы обсемененность полости рта H. pylori стали учитывать и как фактор, оказывающий влияние на развитие и течение стоматологических заболеваний. Обсуждается возможность выделения такого термина, как Helicobacter pylori-ассоциированные заболевания пародонта. В связи с этим встает вопрос об эрадикационной терапии как о базисной лечения заболеваний пародонта и гастродуоденальной зоны у больных язвенной болезнью двенадцатиперстной кишки, ассоциированной с H. pylori [16].
Эрадикация (уничтожение) H. pylori с помощью адекватных комбинаций антибактериальных средств способствует регрессу воспалительно-дистрофических изменений СОЖ и двенадцатиперстной кишки; восстановлению защитных свойств слизистой оболочки гастродуоденальной зоны; существенному снижению частоты рецидивов язвенной болезни (с 60–70 до 1–3 % в течение двух лет наблюдений), а следовательно, и ее осложнений; профилактике развития мальтомы и рака желудка [17]. Количество антибактериальных препаратов, используемых в эрадикационных схемах, ограничено из-за уникальной способности обитания этого микроорганизма в подслизистом пространстве. Бóльшая часть антибактериальных препаратов, попадая в желудок, остается там короткое время, которого, как правило, бывает недостаточно для проявления его активности в отношении Н. pylori.
К главным факторам, ограничивающим активность антибактериальных препаратов в отношении Н. pylori, относятся также низкое значение рН среды и ограниченная диффузия антибактериальных препаратов в СОЖ.
При наличии сочетанной H. pylori-ассоциированной патологии желудочно-кишечного тракта и пародонта целью лечения является:
- в кратчайший срок устранить симптомы заболеваний;
- уничтожить бактерии H. pylori в гастродуоденальной слизистой оболочке и полости рта;
- купировать активное воспаление в СОЖ, двенадцатиперстной кишке и пародонтальных карманах;
- предупредить развитие обострений и осложнений, включая лимфому, рак желудка, пародонтит тяжелой степени.
К сожалению, широкое и не всегда оправданное использование антибактериальных препаратов в целом и неадекватная противохеликобактерная терапия в частности (в смысле как доз, так и длительности лечения) зачастую приводят к формированию приобретенной резистентности у Н. pylori, что сокращает и без того малое количество антибактериальных препаратов, которые могут быть использованы для лечения хеликобактериоза [18–20].
В настоящее время самый высокий уровень резистентности у Н. pylori имеется к производным нитроимидазола, который в некоторых странах достигает 80–90 % [6, 21]. Резкое увеличение во всем мире штаммов H. pylori, устойчивых к нитроимидазолам, сделало актуальным поиск более действенных режимов эрадикации микроорганизма [22]. В связи с этим наиболее эффективной в регионах с низкой резистентностью хеликобактера к кларитромицину остается схема на основе комбинации ингибитора протонной помпы (ИПП), макролидного антибиотика (кларитромицина) и амоксициллина [17, 23]. В регионах с высокой резистентностью или там, где достоверные данные об уровне резистентности отсутствуют, хорошие результаты обнаруживаются при применении как классической квадротерапии, так и модифицированных схем с препаратом висмута в качестве терапии первой линии [23].
Доказано, что амоксициллин нарушает синтез гликопротеидов в стенке бактерий, обладает бактерицидным эффектом в отношении H. рylori и является одним из препаратов первого выбора при системной антибиотикотерапии заболеваний пародонта. В многочисленных работах показана эффективность применения схем, включающих макролиды для эрадикации H. pylori. Так, кларитромицин благодаря своим фармакокинетическим и фармакодинамическим особенностям присутствует в рекомендациях Маастрихт-2, -3 и -4 [17]. По мнению ведущих ученых, макролидные антибиотики, в частности кларитромицин, считаются наиболее перспективной группой антибиотиков в лечении одонтогенной инфекции, в т.ч. и у больных, имеющих изменения со стороны иммунной системы, что позволяет широко использовать их в лечении заболеваний пародонта.
В настоящее время описана резистентность Н. pylori к большинству антибиотиков, которые используются в схемах противохеликобактерной терапии [6]. Выходом из сложившейся ситуации могут стать принципиально новые пути воздействия на хронический воспалительный процесс и поиск оптимально эффективного комплекса лечебных и профилактических мероприятий для пациентов с сочетанной патологией. Работа, проведенная нашим коллективом в 2004–2007 гг., доказывает, что комбинированная со стоматологическим лечением и пролонгированная до 14 дней эрадикационная терапия сопровождается более выраженной положительной динамикой клинических проявлений и объективных симптомов пародонтита и язвенной болезни, а 2-недельный курс антибиотикотерапии приводит к достоверному снижению количества пародонтопатогенных микроорганизмов в пародонтальном кармане больных язвенной болезнью двенадцатиперстной кишки, ассоциированной с H. pylori.
В целом наш многолетний опыт использования кларитромицина и амоксициллина свидетельствует о хорошей переносимости данных лекарственных препаратов как при 7-, так и при 14-дневной эрадикационной терапии, позволяющей проводить полноценное лечение практически 100 % нуждающихся в ней больных без каких-либо серьезных последствий. По результатам проведенного лечения, эффективность тройной семидневной схемы эрадикации H. pylori составила 83,4 %. Двухнедельная схема тройной терапии оказалась более эффективной – 96,7 %.
Разница в 13,3 % говорит о несомненном преимуществе 14-дневного курса эрадикационной терапии [14, 16]. Использование рабепразола при лечении язвенной болезни в качестве базисного препарата терапии первой линии по Маастрихт-3 в режиме как 7-, так и 14-дневной терапии, имело ряд преимуществ перед антисекреторными препаратами предыдущих поколений, обусловленных более сильным, быстрым, продолжительным и достаточно предсказуемым антисекреторным действием [15, 24].
Таким образом, хронические воспалительные процессы в полости рта и гастродуоденальной зоне представляют собой не только воспаление слизистых оболочек, вызванное патогенными микроорганизмами, а сложное сочетание разбалансированности барьерных механизмов, механизма регуляции желудочной секреции, окислительно-восстановительных реакций и клеточного обновления.
Различная клиническая картина, выраженность субъективных симптомов у пациентов связаны с вирулентностью штамма хеликобактера, микрофлоры полости рта, в т.ч. пародонтопатогенов; состоянием иммунной системы; генетических факторов; особенностей пищевого поведения и образа жизни.
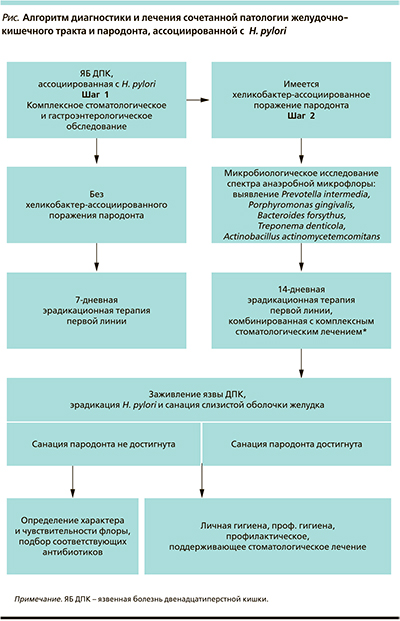
Серьезность последствий хронического воспалительного процесса в слизистой оболочке осознается через несколько лет после инфицирования, поэтому следование алгоритму обследования пациентов с сочетанной хеликобактерной контаминацией пародонта и гастродуоденальной зоны (см. рисунок), применение эффективных методов лечения имеют первостепенное значение в профилактике тяжелых осложнений язвенной болезни, онкологической патологии желудка и двенадцатиперстной кишки.


