Постгистерэктомический синдром (ПГЭС) определяется как специфический клинический симптомокомплекс, возникающий у женщин после удаления матки. В результате гистерэктомии и нарушения кровоснабжения, иннервации и функции яичников в организме развиваются характерные психоэмоциональные, нейровегетативные, сосудистые, метаболические, урогенитальные, сексуальные и другие расстройства, обусловленные эстрогендефицитным состоянием [1], существенно снижающие качество жизни женщины. ПГЭС тесно ассоциируется с развитием астении и синдромом хронической усталости, которые обусловливают физическую и социальную дезадаптацию пациенток [1, 2].
Доля гистерэктомий в структуре гинекологических операций в России достигает 25–38%, при этом средний возраст пациенток, которым выполняется гистерэктомия, по данным различных авторов, составляет 40,5 лет [3].
До настоящего времени внимание ученых и клиницистов в отношении этиологии, профилактики и лечения ПГЭС было сконцентрировано на нарушении овариального стероидогенеза. Недавно было показано, что главная роль в этом процессе принадлежит механизмам, связанным с оксидативным стрессом (ОС) и митохондриальной дисфункцией [4]. При этом нарушения клеточного энергообмена ведут к нарастанию ОС. Таким образом, замыкается порочный круг нарушения клеточного дыхания и метаболизма.
Исходя из выявленных новых механизмов, вовлеченных в возникновение и прогрессирование ПГЭС, его эффективная терапия должна быть направлена на ключевые звенья патогенеза заболевания – коррекцию ОС и митохондриальной дисфункции.
Примером эффективной метаболической терапии, получившей широкое применение в последние десятилетия, служит использование высокоочищенного гидролизата плаценты человека (ГПЧ) для подкожного применения (Мэлсмон, Япония), который используется в клинической практике с 1956 г. [5]. В 2011 г. препарат зарегистрирован на территории РФ в качестве рецептурного лекарственного средства для лечения астенических состояний у женщин в пери- и постменопаузе [6].
Цель исследования – изучение маркеров ОС и ментального статуса женщин с ПГЭС на фоне лечения ГПЧ.
Материал и методы исследования
Проведено нерандомизированное проспективное клиническое исследование, в которое на условиях добровольного информированного согласия были включены 62 женщины с ПГЭС в возрасте от 45 до 52 лет (средний возраст – 46,3±0,56 года), которым от 3 недель до 3 месяцев назад была выполнена гистерэктомия. В зависимости от наличия гонад исследуемая когорта пациенток была разделена на две группы: I группу составили 30 женщин после гистерэктомии, проведенной без аднексэктомии, во II – вошли 32 пациентки, которым была выполнена гистерэктомия с односторонней аднексэктомией. Пациентки не получали менопаузальной гормональной терапии.
Определяли степень тяжести ПГЭС с помощью опросника модифицированного менопаузального индекса, субъективно отражающего общее состояние женщины (по Уваровой Е.В., 1983); ментальный статус и уровень депрессии – с помощью психометрической шкалы Бека (Beck Depression Inventory); степень тревожных расстройств – по шкале Спилбергера.
Лабораторные исследования включили определение в сыворотке крови уровней маркеров ОС – супероксиддисмутазы (СОД) и глутатионпероксидазы (ГТП) – методом иммуноферментного анализа на спектрофотометрическом анализаторе (SHIMADZU UV-1800, Япония) до и после курса плацентарной терапии. Референсные значения: СОД – 164-240 ЕД/мл, ГТП – 4171-10881 ЕД/мл.
Пациенткам обеих групп проведена таргетная плацентарная терапия препаратом Мэлсмон по 6,0 мл (3 ампулы) 3 раза в неделю подкожно в область плеча и живота в течение 2 недель, далее – по 4,0 мл (2 ампулы) 2 раза в неделю в течение 10 недель.
Статистическую обработку данных производили на персональном компьютере с использованием пакета программ IBM SPSS Statistics (версия 23). Вычисляли среднюю арифметическую (М) и среднюю ошибку средней арифметической (m). Для определения статистической значимости различий средних показателей использовался t-критерий Стьюдента. Различия считались существенными при уровне значимости p<0,05.
Результаты исследования
Исследуемые группы были сопоставимыми по возрасту, антропометрическим показателям, образу жизни, социальному статусу и частоте экстрагенитальной патологии (p>0,05).
Изучение структуры перенесенных гинекологических заболеваний показало, что наиболее часто у пациенток встречались острые воспалительные заболевания внутренних половых органов (66,7 и 75,0% в I и II группах соответственно; р=0,47).
Показания к гистерэктомии: лейомиома матки с геморрагическим синдромом на фоне неэффективности консервативной терапии (38,7%), лейомиома матки в сочетании с аденомиозом и доброкачественными опухолями яичников (46,8%), рецидивирующая сложная железисто-кистозная гиперплазия (14,5%).
Исследование клинических проявлений ПГЭС с помощью опросников выявило наличие нейровегетативных симптомов у 46,7% женщин в I и 65,6% – во II группах (p=0,132), вегетососудистых симптомов («приливы» жара, слабость, потливость) – у 86,7 и 84,4% пациенток соответственно (p=0,798).
Изучение ментального статуса больных ПГЭС до лечения выявило в обеих группах высокий и средний уровни депрессии по шкале Бека, составившие в среднем 26,5±2,32 балла, соответствовавшие умеренной степени расстройства (норма – до 13 баллов). Средний уровень реактивной тревожности по тесту Спилбергера составил 49,4±1,86 балла, личностной тревожности – 46,5±1,76, что соответствовало высокой степени (значения теста при низкой тревожности ≤30 баллов, при средней – 31–45).
Эффективность терапии препаратом Мэлсмон в отношении вегетативно-сосудистой симптоматики была отмечена уже со второй недели терапии с достижением стойкого терапевтического эффекта на 3-й неделе лечения: частота «приливов» жара, слабости, потливости, в т.ч. в ночное время, заметно снизилась до 16,7% в I группе и до 21,9% – во II (p<0,001). Полученные данные представлены в табл. 1.
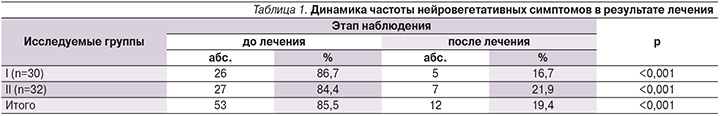
При оценке степени ментальных нарушений по психометрическим тестам на фоне проводимой терапии было выявлено снижение уровня депрессии по тесту Бека с 26,5±2,32 до 8,2±0,34 балла (р<0,001). Уровень тревожности по шкале Спилбергера также статистически значимо снижался: значения реактивной тревожности до и после лечения составили 39,4±1,86 и 15,44±0,24 балла соответственно в I группе (p<0,001), 37,4±0,74 и 13,24±0,95 – во II (p<0,001). Личностная тревожность снижалась с 36,5±1,76 до 11,2±0,94 балла в I группе (p<0,001) и с 34,55±2,96 до 10,4±0,62 балла – во II (p<0,001). Следует отметить, что стабильное купирование нейровегетативных проявлений и изменений в психоэмоциональной сфере сохранялось в течение первого года после завершения терапии Мэлсмоном у пациенток обеих групп.
Кроме того, в ходе наблюдения на фоне проводимой терапии 79,0% пациенток изучаемой когорты отмечали улучшение внешнего вида (76,7% в I группе, 81,3% – во II), 59,7% – когнитивных функций (63,3% в I группе, 56,3% – во II), 66,1% – настроения (60,0% в I группе, 71,9% – во II), 80,6% – сна (83,3% в I группе, 78,1% – во II). Улучшение сна преимущественно было связано с уменьшением дыхательных нарушений типа апноэ, отмечавшимся в 66,1% случаев (70,0% – в I группе, 62,5% – во II).
Анализ изменения уровней биохимических маркеров ОС представлен в табл. 2.
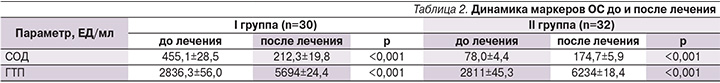
В группе с сохранными яичниками средний уровень СОД был повышен и составил 455,1±28,5 ЕД/мл, что свидетельствовало о выраженном ОС после гистерэктомии на фоне гипоксии и дефицита стероидов. Напротив, в группе с односторонней сальпингоофорэктомией показатели СОД были почти в 2 раза ниже нормы, статистически значимо отличаясь от данных I группы (p<0,001), и составили 78,0±4,4 ЕД/мл. Мы предполагаем, что выявленные уровни СОД могут свидетельствовать о дефиците коферментов, обусловленном ОС и нарушением овариального стероидогенеза на фоне прогрессирующей дестабилизации кровообращения. Показатели ГТП были стабильно ниже нормы, статистически значимо не различались между группами, составив 2836±56,0 ЕД/мл в I группе и 2811±45,3 – во II (p=0,766). Полученные данные о содержании ГТП могут косвенно свидетельствовать о дефиците селена и глутатиона, которые также развиваются на фоне выраженного ОС. В частности, в исследованиях отечественных ученых установлены низкие уровни глутатиона и селена крови, входящих в состав важного антиоксидантного фермента глутатионпероксидазы, а также снижение активности каталазы и глутатионредуктазы [7].
Изучение биохимических показателей ОС через месяц после проведенной терапии показало нормализацию уровней СОД и ГТП (p<0,001 во всех случаях).
Обсуждение результатов
Гистерэктомия является одной из наиболее часто выполняемых гинекологических операций в позднем репродуктивном возрасте в большинстве стран мира. ПГЭС в 20–80% случаев сопутствует выпадение функции яичников, что зависит от возраста пациентки, преморбидного фона, характера сопутствующей болезни, объема операции (после субтотальной гистерэктомии в 1,5, а после тотальной гистерэктомии – в 2,1 раза чаще), особенностей кровоснабжения яичников. Таким образом, сохранение одного или даже двух яичников при гистерэктомии не исключает развития ПГЭС [2]. Эти данные подтверждаются результатами настоящего исследования: нейровегетативные симптомы выявлены у более половины больных суммарно в обеих группах, вегетососудистые («приливы» жара, слабость, потливость) – у 85,5%, отмечены высокие уровни тревожности и депрессии.
Лидирующей причиной реализации ключевых патогенетических механизмов ПГЭС считаются нарушение микроциркуляции яичников и развитие острой ишемии в результате исключения из их кровоснабжения ветвей маточных артерий. После гистерэктомии изменяется архитектоника внутриорганных сосудов яичников, страдает интраовариальный кровоток, нарастают венозный застой и лимфостаз [1, 3]. Прогрессирующая ишемизация яичников ускоряет дегенеративные и атрофические процессы, приводит к угасанию их овуляторной и гормонопродуцирующей функций.
Механизмы клеточной дисрегуляции и нарушений клеточного метаболизма, реализующиеся при ПГЭС, стали изучаться относительно недавно [4]. ОС, являющийся следствием дисбаланса про- и антиоксидантных систем клетки и проявляющийся избыточным образованием в клетке активных форм кислорода, может стать причиной повреждения различных структур: ДНК–РНК–белка («катастрофа ошибок»); клеточных органелл, в первую очередь митохондрий, которые имеют слабую систему репарации и представляют собой один из главных источников клеточной дисфункции, приводящей к повреждению клеток, вплоть до апоптоза [8].
ОС принято связывать и со старением клеток. Накопление массы активных форм кислорода, а также снижение концентрации клеточного глутатиона (основного антиоксиданта) – одна из хорошо известных причин возникновения острых и хронических дегенеративных заболеваний, таких как атеросклероз, диабет, инсульт, болезни Альцгеймера и Паркинсона [9]. Поскольку ОС сопровождает многие нейродегенеративные заболевания, активные формы кислорода принято считать вестником клеточной смерти.
Ключевым звеном антиоксидантной системы клетки является митохондрия – органелла общего назначения, имеющаяся в цитоплазме всех эукариотических клеток и выполняющая жизненно важные для каждой клетки функции. Основные биохимические процессы, происходящие в митохондриях, – это окисление жирных кислот, цикл трикарбоновых кислот, окислительное фосфорилирование, регуляция внутриклеточного распределения кальция, образование стероидов, регуляция апоптоза. В митохондриях интегрированы пути метаболизма белков, жиров и углеводов, осуществляются основные энергетические процессы.
Результаты недавно проведенного исследования показали, что при анализе функциональной активности митохондрий на основе цитоморфоденситометрических параметров активности сукцинатдегидрогеназы, выполненном после гистерэктомии, в т.ч. с односторонней аднексэктомией, у 33% женщин имели место отклонения в показателях ферментного статуса лейкоцитов, свидетельствовавшие о митохондриальной дисфункции, которая может как быть следствием ПГЭС, так и выступать в качестве отдельного звена патогенеза [10]. Аналогичные результаты, полученные в настоящем исследовании, свидетельствуют о том, что в группе с сохранными яичниками средний уровень СОД, составляющий 455,1±28,5 ЕД/мл, говорит о выраженном ОС после гистерэктомии на фоне гипоксии и дефицита стероидов, тогда как в группе с односторонней сальпингоофорэктомией показатели СОД, которые были почти в 2 раза ниже нормы (78,0±4,4 ЕД/мл), свидетельствуют о дефиците коферментов на фоне ОС и нарушении овариального стероидогенеза. Показатели ГТП были ниже нормы, достоверно не различались между I и II группами, соствив 2836±56,0 и 2811±45,3 ЕД/мл соответственно. Полученные данные согласуются с результатами других исследователей [11].
Специфика изменений энергообмена лейкоцитов позволяет рекомендовать индивидуальную корригирующую терапию кофакторами и субстратами различных метаболических путей («метаболическую терапию») с целью не только лечения, но и профилактики развития «синдрома после искусственной менопаузы» у женщин, перенесших гистерэктомию. Применение метаболической терапии усиливает энергетический потенциал клеток, способствуя стабилизации клеточных мембран, а стимуляция роста митохондрий, синтеза нуклеиновых кислот, белков и других внутриклеточных структур приводит к оптимизации клеточного обмена в целом [12–14].
Примером эффективной метаболической терапии является применение ГПЧ Мэлсмон. В составе препарата содержатся 16 незаменимых аминокислот, в т.ч. проявляющих антиоксидантную активность (тирозин, триптофан, фенилаланин, урацил), глютаминовая и аспарагиновая аминокислоты, связывающие свободные радикалы; моносахариды, вступающие в реакции окисления и приводящие к образованию трех типов кислот (глюконовая, глюкуроновая, глюкаровая), которые принимают активное участие в обмене информацией между клетками и межклеточным веществом. Кроме того, в состав Мэлсмона входят полиненасыщенные жирные кислоты (стеариновая, пальмитиновая, миристиновая, арахиновая и др.), обеспечивающие пластичность клеточных мембран, снижающие ОС и увеличивающие экспрессию противовоспалительных маркеров, а также макро- и микроэлементы в эссенциальной форме (железо, цинк, магний, калий, кальций, медь, селен и другие, всего – около 30) [6].
Уникальной особенностью препарата Мэлсмон является наличие в его составе низкомолекулярных сигнальных пептидов (или сигнальных молекул), за открытие которых в 1999 г. была присуждена Нобелевская премия американскому биологу Гюнтеру Блобелу. Сигнальные молекулы – короткие аминокислотные последовательности (от 3 до 60 аминокислот), механизм действия которых реализуется через соединение с клеточными рецепторами, отвечающими определенными реакциями. Сигнальные молекулы обеспечивают котрансляционный и посттрансляционный транспорт белка в соответствующую органеллу (ядро, митохондрия, хлоропласт, эндоплазматический ретикулум, апопласт или пероксисома), тем самым влияя на экспрессию генов, задают оптимальный физиологический темп деления клеток, регулируют межклеточные взаимодействия и нормализуют метаболические процессы [15].
В результате высокотехнологичного производства, включающего этап ультрананофильтрации, препарат очищен от белковых молекул, таких как гормоны, факторы роста, ферменты, витамины и другие вещества белковой природы.
Таким образом, фундаментальные особенности молекул в составе препарата Мэлсмон служат ключом к пониманию механизма его действия. Биологически активные вещества в составе препарата повышают активность клеточного и тканевого дыхания, положительно влияют на процессы метаболизма в клетках, обладают антиоксидантным действием и улучшают регенерацию тканей, активизируют процессы саморегуляции организма, стимулируют адаптационные механизмы [6, 16].
В 2016 г. опубликованы результаты эксперимента in vitro, проведенного в Центре цитохимических исследований (Москва), которые продемонстрировали способность ГПЧ нормализовывать клеточное дыхание, повышая активность митохондриальных ферментов лимфоцитов и тромбоцитов. Интересно и то, что гиперфункции митохондрий отмечено не было, Мэлсмон активировал их до нормальных значений молодого организма (20–30 лет) [17].
Кроме того, у мышей с овариоэкто-мией [18] ГПЧ оказывал антидепрессивное воздействие, что проявлялось сокращением продолжительности периода обездвиженности – ключевого маркера депрессивного состояния у животных, сопоставимое с эффективностью 17β-эстрадиола. При этом не наблюдалось увеличения влажной массы матки, характерного для действия 17β-эстрадиола, что обусловлено отсутствием гормонов в составе препарата и связанных с ними влияний на половую систему. Данный факт может иметь позитивное значение, особенно при наличии противопоказаний к применению менопаузальной гормональной терапии.
Эффективность и безопасность применения препарата Мэлсмон в гинекологической практике подтверждаются 60-летним практическим опытом его использования, а также результатами зарубежных и российских исследований, в т.ч. у женщин в пери- и постменопаузе, при синдроме преждевременного истощения яичников, в программах вспомогательных репродуктивных технологий, в терапии недостаточности лютеиновой фазы и генитоуринарного синдрома, а также при лечении гипо- и агалактии (последние внесены в официальные показания к применению препарата Мэлсмон в Японии) [5, 19–25]. В то же время исследований, посвященных антиоксидантным эффектам ГПЧ и возможностям его использования для коррекции нейровегетативных и ментальных расстройств у женщин с ПГЭС, ранее не проводилось. Настоящее исследование показало, что Мэлсмон, оказывая положительное действие на систему антиоксидантной защиты организма, способствует быстрому купированию нейровегетативной симптоматики и улучшает психический статус (ослабляет проявления тревоги и депрессии до нормальных значений).
Особого внимания заслуживает тот факт, что терапия Мэлсмоном сопровождается т.н. позитивными побочными эффектами в виде улучшения состояния кожи и ее придатков и слизистых оболочек [2, 24, 26].
Заключение
Гистерэктомия оказывает повреждающее действие на гипоталамо-гипофизарно-гонадную ось, приводя к ослаблению защитно-компенсаторных процессов в организме женщины. Предположительно матка как орган-мишень закономерно влияет как на нейроэндокринную регуляцию функции яичников, так и на внутриклеточную регуляцию маркеров антиоксидантной защиты организма и энергетический потенциал клеток. Таким образом, выбор терапии ПГЭС должен определяться не только наличием или отсутствием дефицита половых стероидов, но и необходимостью устранения повреждений на клеточном уровне повреждений, что предусматривает проведение метаболической терапии.
Учитывая полученные в нашей работе результаты, считаем использование препарата ГПЧ Мэлсмон пациентками, перенесшими гистерэктомию, патогенетически обоснованным независимо от сохранности гонад с точки зрения купирования нейровегетативной симптоматики и восстановления ментального статуса, а также профилактики иных возрастассоциированных болезней.



