Введение
Изучение роли оксида азота (NO) в патогенезе многих заболеваний представляет большой интерес, т.к. он рассматривается как первый представитель нового класса сигнальных молекул, осуществляющих межклеточную коммуникацию и регуляцию множества функций в различных тканях и системах организма, таких как вазодилатация, снижение агрегации тромбоцитов, реакции иммунной системы [3, 8, 12, 14]. Изменения уровня метаболитов NO в биологических жидкостях отмечены при многих аутоиммунных и иммунокомплексных заболеваниях [2, 9, 11, 16, 17]. Значение NO в патологии суставов подтверждено в ряде экспериментальных и клинико-лабораторных работ, доказана его роль в поддержании воспаления при ревматических заболеваниях [4, 6, 15]. Угнетение синтеза NO наблюдается на фоне применения глюкокортикостероидов, цитостатиков, некоторых нестероидных противовоспалительных средств (НПВС) [5, 13].
Цель исследования состояла в изучении клинического значения показателей стабильных метаболитов (СМ) NO в сыворотке крови и моче больных анкилозирующим спондилоартритом (АСА) в зависимости от клинических особенностей болезни и их динамики в процессе применения базисной терапии.
Материал и методы исследования
Открытое контролируемое 12-месячное исследование включило 93 пациента с достоверным АСА и группу здоровых доноров (n=35), возрастной и половой состав которых соответствовал обследуемой группе больных АСА. Первая группа пациентов с АСА (n=30) получала только НПВС (диклофенак натрия в дозе 150 мг/сут), вторая (n=33) – терапию проспидином в сочетании с НПВС в той же дозе. Третья группа (n=30) получала метотрексат в сочетании с НПВС. Группы больных были сопоставимыми по основным демографическим и клиническим показателям. Во всех группах преобладали мужчины (22, 22 и 20 соответственно). Средний возраст пациентов в группах составил 38,2±6,1, 35,3±9,6 и 34,5±7,2 года соответственно, длительность заболевания – 7,6±5,4, 5,8±4,1 и 6,9±5,6 года. Преобладали пациенты со второй степенью активности: 21, 19 и 18 человек соответственно в каждой группе, II и III рентгенологических стадий сакроилиита. Во второй и третьей группах пациенты имели преимущественно периферическую форму АСА (20 и 17), в первой – центральную (19 больных). Около трети пациентов в исследуемых группах имели экстраартикулярные проявления в виде лихорадки, похудания, анемии, иридоциклита и полинейропатии.
Проспидин назначали в дозе 300 мг в неделю внутривенно капельно на стационарном этапе и по 200 мг в неделю внутримышечно в амбулаторных условиях. Доза метотрексата на стационарном этапе и в амбулаторных условиях составила 10 мг в неделю внутрь. Лечение проведено в условиях специализированного ревматологического отделения после тщательного клинико-лабораторного обследования для уточнения диагноза, выявления противопоказаний, получения информированного согласия больных на лечение и обследование.
Основу обследования больных составили общеклинические методы, принятые в ревматологической клинике. При этом определены суставной индекс (0–3 балла), общая оценка боли по визуальной аналоговой шкале (ВАШ; 0–100 мм), длительность утренней скованности в минутах, количество воспаленных (припухших) суставов, число болезненных суставов, позвоночный индекс. Для оценки активности заболевания использовали индекс BASDAI. Оценка функциональной способности пациентов проведена с помощью индекса BASFI, опросников состояния здоровья – HAQ, HAQ-S. Суммарный эффект терапии оценен в соответствии с градациями рабочей группы по изучению АСА (ASAS). Для оценки качества жизни пациентов с АСА применен общий опросник SF-36. Кроме клинической оценки суставного синдрома использован весь комплекс лабораторного обследования больных как для активного выявления противопоказаний, так и для контроля за возможными побочными явлениями. В этот комплекс были включены общий анализ крови с подсчетом тромбоцитов, определение С-реактивного белка (СРБ), фибриногена, общего белка и его фракций, мочевины, креатинина, билирубина, АЛТ, АСТ; общий анализ мочи. Иммунологические методы включили определение содержания сывороточных иммуноглобулинов классов А, М, G, циркулирующих иммунных комплексов. Всем пациентам проведено HLA-типирование (HLA-В27) для уточнения диагноза и выявления генетической предрасположенности к АСА (во всех группах имела место более чем у 80% пациентов).
Концентрация СМ NO в сыворотке крови и моче определена с помощью реактива Грисса [3]. Перед исследованием больным за 48 часов назначалась диета с исключением продуктов, содержащих большое количество нитратов (колбасы, консервы, свежие овощи и фрукты). Клинико-лабораторное обследование проведено до лечения, в конце стационарного этапа терапии и через 3, 6, 12 месяцев.
Статистическая обработка полученных результатов проведена с использованием ППП «Statistica for Windows 5.0». По каждому признаку определены средняя величина (X) и среднее квадратичное отклонение (σ). Изучение динамики исследуемых показателей в процессе лечения проведено с помощью критерия Стьюдента. Во всех случаях нулевую гипотезу отвергали при p<0,05.
Результаты исследования
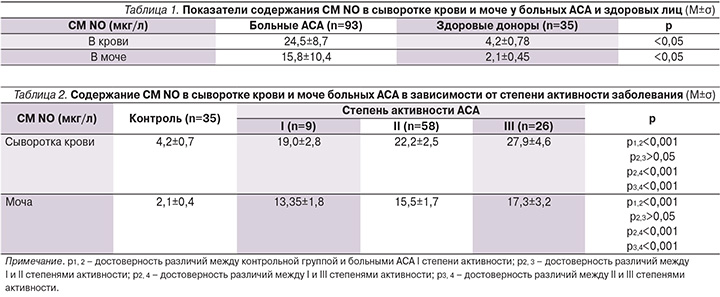
Как следует из табл. 1, в группе больных АСА содержание СМ NO в сыворотке крови и моче было достоверно выше, чем в контрольной группе здоровых доноров (р<0,05).
Нами было изучено содержание СМ NO в сыворотке крови и моче здоровых доноров и больных АСА в зависимости от степени активности заболевания (табл. 2). Как следует из таблицы, содержание СМ NO в крови и моче больных АСА было достоверно выше, чем у здоровых доноров, и их концентрация повышалась с увеличением активности заболевания. Содержание СМ NO в сыворотке крови и моче больных III степенью активности АСА было достоверно выше (р<0,001), чем у больных со II степенью активности.
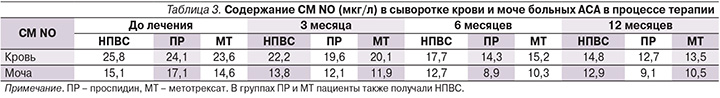
При изучении динамики показателей СМ NO в процессе терапии НПВС, проспидином и метотрексатом было установлено, что к 3-му месяцу лечения во всех группах наблюдалась тенденция к снижению уровня СМ по сравнению с показателями до лечения. К 6-му месяцу терапии в группе больных, получавших проспидин, отмечено достоверное снижение показателей СМ NO в сыворотке крови и моче (p<0,05), а на фоне терапии метотрексатом – только в сыворотке крови (p<0,05). К 12 месяцам терапии уровень СМ в сыворотке крови снизился, а в моче несколько возрос, но продолжал оставаться ниже, чем до начала лечения (табл. 3).
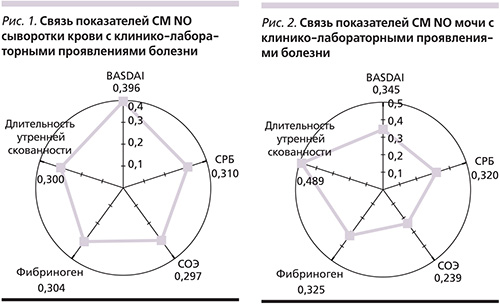
В нашем исследовании также была изучена взаимосвязь между содержанием СМ NO в сыворотке крови и моче и некоторыми клинико-лабораторными проявлениями АСА при помощи коэффициента корреляции Спирмена (рис. 1, 2). При проведении корреляционного анализа содержания СМ NO и некоторых клинических и лабораторных проявлений болезни отмечена прямая умеренная корреляция уровня СМ с индексом активности BASDAI: в крови (r=0,396), в моче (r=0,345); длительностью утренней скованности: в крови (r=0,30), в моче (r=0,489); СРБ: в крови (r=0,31), в моче (r=0,32); фибриногеном: в крови (r=0,304), в моче (r=0,325, p<0,05). Содержание СМ NO в сыворотке крови имело обратную корреляцию с длительностью заболевания (r=-0,375; р<0,05), в группе больных со стажем болезни более 10 лет выявлены наиболее низкие показатели СМ. Достоверных различий в зависимости СМ NO от формы и стадии АСА не выявлено (p>0,05).
Обсуждение
Полученные нами данные по изменению уровня СМ NO в сыворотке крови и моче у больных активным АСА в основном соответствуют данным литературы: повышение уровня СМ NO в биологических жидкостях в активную фазу болезни отмечено при ревматоидном артрите [7, 10] и системной красной волчанке [6]. Причем уровень СМ в указанных исследованиях, как и в нашем исследовании, был существенно выше в активной фазе болезни, чем в фазе ремиссии и у здоровых лиц.
Особый интерес вызывает динамика уровня СМ NO, которую мы наблюдали на фоне проводимой терапии. Снижение клинической активности заболевания сопровождалось уменьшением содержания СМ в сыворотке крови и моче у больных АСА.
Установлено повышение концентрации СМ NO в сыворотке крови и моче у больных АСА по сравнению со здоровыми людьми.
Таким образом, определение СМ NO у больных АСА может служить дополнительным критерием оценки активности заболевания и эффективности проводимой терапии. Снижение уровня СМ на фоне терапии проспидином и метотрексатом можно объяснить их иммуносупрессивным и противовоспалительным эффектами [1, 10].


