Ревматоидный артрит (РА) – наиболее частое воспалительное ревматическое заболевание неизвестной этиологии, характеризующееся развитием эрозивного симметричного полиартрита в сочетании с системным иммуновоспалительным поражением внутренних органов [1]. Из многообразия средств, входящих в комплекс лечения больных РА, только болезнь-модифицирующие антиревматические препараты (БМАРП) способны затормозить прогрессирование болезни [2, 3]. В литературе имеются лишь единичные сведения о тактике назначения БМАРП у больных ранним РА (РРА) [4–6]. Применяемые БМАРП далеко не всегда контролируют активность заболевания и имеют ряд побочных эффектов. В связи с этим продолжается поиск новых препаратов, способных существенно улучшать течение РА и уменьшать количество побочных эффектов. Одним из представителей нового класса лечебных средств является инфликсимаб (ИФ) – химерное моноклональное антитело против фактора некроза опухоли α. Сведения о преимуществах ИФ перед метотрексатом (МТ) в плане влияния на показатели качества жизни и психологический статус пациентов с РА немногочисленны [7, 8]. Целью исследования явилась сравнительная оценка показателей клинической активности болезни и качества жизни у пациентов с РРА при применении сульфасалазина (СС), МТ или лефлуномида (ЛФ) в качестве первых БМАРТ в течение 12 месяцев наблюдения, а также сравнение эффективности комбинированной терапии ИФ и МТ с монотерапией МТ больных с активным течением заболевания.
Материал и методы
Проведено клинико-лабораторное и инструментальное обследование 151 больного РРА. Диагноз РА был установлен по критериям ACR (1987) [9]. Длительность заболевания на момент первичного обследования составила от 3 недель до 12 месяцев (в среднем 6,5 ± 0,3 месяца). Средний возраст пациентов – 58,2 ± 5,5 года. Большая часть больных РРА была серонегативной по ревматоидному фактору (РФ) – 51,2 %. Среди обследованных пациентов преобладали средняя и высокая степени активности иммунно-воспалительного процесса по DAS 28 > 3,2; I–II рентгенологические стадии заболевания по классификации Штейнброкера (23,2 и 60,5 % соответственно) и II функциональный класс РА (59,7 %).
После установления диагноза РА больным методом случайной выборки была назначена базисная терапия: группа I (55 больных) в качестве базисной терапии получала СС в дозе 2 г/сут; группа II (55 больных) – МТ внутрь или внутримышечно в дозе 10 мг/нед; группа III (41 больной) – ЛФ в дозе 100 мг/сут 3 дня, затем по 20 мг/сут.
Наряду с базисной терапией всем больным назначался один из нестероидных противовоспалительных препаратов. Длительность наблюдения составила 12 месяцев.
Второй этап исследования заключался в отборе 46 пациентов из всех групп после 12 месяцев наблюдения с умеренной (DAS 28 > 3,2 < 5,1) и высокой степенями активности РА (DAS 28 > 5,1), несмотря на проводимую терапию СС, МТ и ЛФ. Обследованные больные были разделены на две подгруппы методом слепой выборки. В подгруппе I (30 человек) больные получали терапию МТ (15–20 мг/нед) и преднизолон 10 мг/сут; в подгруппе II (16 человек) пациентам с сохраняющейся клиниколабораторной активностью назначался инфликсимаб (Ремикейд) из расчета 3 мг/кг внутривенно капельно по схеме введения 0, 2 и 6 недель, затем через каждые 8 недель. Подгруппы были сравнимы по полу, возрасту, длительности течения заболевания, активности РА по DAS 28 и рентгенологической стадии. Длительность второго этапа наблюдения составила 24 недели.
При объективном обследовании осуществлялась оценка суставного синдрома с помощью индекса Ritchie, определялась длительность утренней скованности, применялся функциональный индекс оценки здоровья Health Assessment Questionnaire (HAQ). У 46 пациентов, получавших терапию МТ и ИФ + МТ после 24 недель лечения, проводилось определение показателей качества жизни с помощью опросника SF-36, стрессоустойчивости и социальной адаптации по опроснику Холмса и Раге, астенического состояния, тревоги и депрессии по шкале Цунга, госпитальной шкале тревоги и депрессии [10].
Эффективность лечения оценивалась с использованием индекса активности DAS 28 и критериев Американской Коллегии ревматологов (АСR) по 20-, 50-, 70 %-ному улучшению. Динамику лабораторной активности заболевания оценивали по значениям СОЭ и С-реактивного белка (СРБ).
Статистическая обработка проводилась с помощью компьютерной программы (Statistica 5,5 для Windows) с использованием критериев Стьюдента, Манна–Уитни, критерия Фишера, медианного хи-квадрата, модуля ANOVA, коэффициента корреляции Спирмена. Средние значения представлены в виде M ± m. Достоверными считались различия при p < 0,05.
Результаты и обсуждение
На фоне лечения СС через 12 месяцев в группе I высокие значения индекса Ричи, HAQ, СОЭ и СРБ достоверно не отличались от исходных. Отмечалось достоверное уменьшение продолжительности утренней скованности, однако ее средние значения оставались больше 60 минут. В группах II и III к 12-му месяцу наблюдения отмечено существенное снижением индекса Ричи, HAQ, СОЭ и СРБ без достоверных различий по группам. Средние показатели активности РРА через 12 месяцев лечения по значениям DAS 28 расценивались как умеренные в группе I и низкие в группах II и III.
К 12 месяцам лечения отсутствие эффекта по критериям ACR отмечено у 5,4 и 2,4 % больных I и III групп. 20 %-ное улучшение наблюдалось у большей половины больных группы I и незначительного количества больных II и III групп. 50и 70 %-ное улучшение отмечено у трети больных I и у подавляющего большинства больных II и III групп. Клиническая ремиссия достигнута у 20 (36,4 %) больных группы II и 16 (40 %) больных группы III (рис. 1).
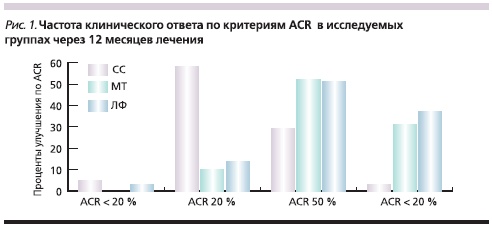
Через 12 месяцев отмена в связи с неэффективностью проводимой терапии произошла у 43 (78,1 %) больных I группы, 2 (4 %) больных II группы и 3 (7 %) больных III группы. Отмена в связи с побочными эффектами произошла у 9 (20 %) больных I группы, 8 (19,5 %) больных II группы и 1 (2 %) больного III группы на 8–12-м месяцах лечения, была связана с повышением уровня печеночных ферментов и развитием цитопенического синдрома.
В табл. 1 представлена динамика клинических показателей больных РА на фоне лечения МТ и МТ + ИФ (второй этап исследования).
Таблица 1.Динамика клинических показателей больных РА на фоне лечения МТ и МТ + ИФ.
В подгруппе I после 24 недель терапии МТ отмечалось достоверное снижение интенсивности боли по шкале ВАШ и числа болезненных суставов. К концу наблюдения у пациентов этой группы отмечена тенденция к снижению значений HAQ, СОЭ и DAS 28, однако достоверных различий с исходными показателями получено не было.
В подгруппе II у пациентов после 24 недель терапии ИФ + МТ наблюдалось статистически значимое уменьшение количества болезненных и припухших суставов, шкалы ВАШ, HAQ и СОЭ, достоверное снижение DAS 28 с 5,3 до 3,4 (DAS 28 > 3,2 < 5,1), что соответствует умеренной активности заболевания и удовлетворительному ответу на терапию по критериям ELUAR (Δ DAS 28).
В табл. 2 представлены показатели качества жизни больных РА по значениям шкалы SF-36 исходно и через 24 недели лечения МТ и ИФ + МТ.
Таблица 2.Показатели качества жизни по шкале SF-36 у больных РА, получавших терапию МТ и ИФ + МТ.
Через 24 недели лечения в подгруппе II по сравнению с показателями в подгруппе I отмечены достоверно более высокие значения физического функционирования, жизнеспособности и ролевого эмоционального функционирования (р < 0,05). Полученные результаты свидетельствуют о том, что увеличение физической активности на фоне уменьшения болевого синдрома у пациентов подгруппы II влияло на общий уровень здоровья и жизнеспособности, повышало их социальную активность.
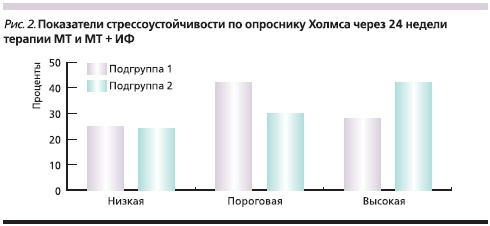
Сравнительные показатели стрессоустойчивости по опроснику Холмса через 24 недели терапии МТ и МТ + ИФ представлены на рис. 2. В подгруппе II через 24 недели терапии отмечено большее число пациентов, имевших высокую стрессоустойчивость, по сравнению с больными подгруппы I (43,7 и 29,9 %).
Оценка депрессии по шкале Цунга через 24 недели терапии МТ и МТ + ИФ представлена в табл. 3. Анализ показателей шкалы Цунга выявил, что различные степени депрессии определялись у пациентов во всех анализируемых группах, у 60,0 % больных первой подгруппы и у 100 % больных второй подгруппы через 24 недели патогенетической терапии.
Таблица 3.Показатели степени депрессии по шкале Цунга у пациентов РА, получавших МТ и МТ + ИФ.
Показатели степени астении у больных РА в исследуемых подгруппах через 24 недели терапии представлены на рис. 3. Различные степени астении определялись у 71,0 и 99,2 % пациентов в исследуемых подгруппах. На фоне применения комбинированной терапии МТ + ИФ у достоверно меньшего числа пациентов определена выраженная астения по сравнению с пациентами, получавшими терапию метотрексатом (6,2 и 20,4 % при р < 0,05). Показатели госпитальной шкалы тревоги и депрессии через 24 недели терапии МТ и МТ + ИФ представлены в табл. 4. Наличие тревоги и депрессии по госпитальной шкале зарегистрировано у подавляющего числа пациентов с РРА.
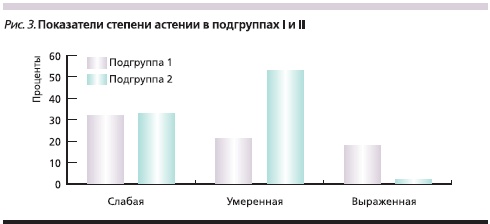
Таблица 4.Показатели госпитальной шкалы тревоги и депрессии у больных РРА через 24 недели терапии МТ и МТ + ИФ.
Отмечена прямая корреляционная взаимосвязь между значениями индекса НАQ и числом пациентов с тревожно-депрессивными расстройствами при РА. При значениях индекса НАQ ≥ 1,82 в 100 % случаев выявлены клинически выраженная тревога и депрессия, умеренная или выраженная астения и низкая сопротивляемость к стрессу.
Полученные данные свидетельствуют о том, что при снижении функциональных способностей у пациентов с РА нарастает выраженность тревожных и депрессивных расстройств.
Заключение
Полученные результаты исследования подтвердили имеющиеся сведения о неудовлетворительных отдаленных результатах стратегической схемы “пирамида” при лечении РА, когда на начальных этапах его развития назначались менее активные БМАРП. Проведенное исследование доказало преимущество ранней цитостатической терапии с использованием МТ и ЛФ как первых базисных препаратов для лечения больных РРА.
Результаты наблюдения за пациентами с активным течением РРА свидетельствуют о том, что комбинированная терапия ИФ и МТ имеет очевидные преимущества перед монотерапией МТ в отсутствие эффекта от его применения в дозе не менее 15–20 мг/нед в течение 3 месяцев и ведет к значимому клиническому улучшению, увеличению функциональных способностей суставов у больных РРА и улучшению показателей качества жизни.
Оценка психологического статуса больных РРА свидетельствует о наличии тревоги, депрессии и астении у подавляющего числа обследованных. Отмечена прямая корреляционная взаимосвязь между значениями индекса НАQ и числом больных РА с тревожно-депрессивными расстройствами. Полученные результаты свидетельствуют о необходимости объективно оценивать психологический статус больных РРА с помощью многофакторных психологических тестов для своевременного выявления лиц, нуждающихся в оказании специальной психологической помощи и решении вопроса о необходимости включения в комплексную терапию современных антидепрессантов.
Информация об авторах:
Октябрьская Ирина Валентиновна – врач-ревматолог клинической ревматологической больницы № 25.
Тел. 8 (812) 310-60-39;
Беляева Ирина Борисовна – доктор медицинских наук, профессор кафедры терапии и ревматологии
им. Э.Э. Эйхвальда Санкт-Петербургской медицинской академии последипломного образования.
Тел. 8 (812) 310-60-36


