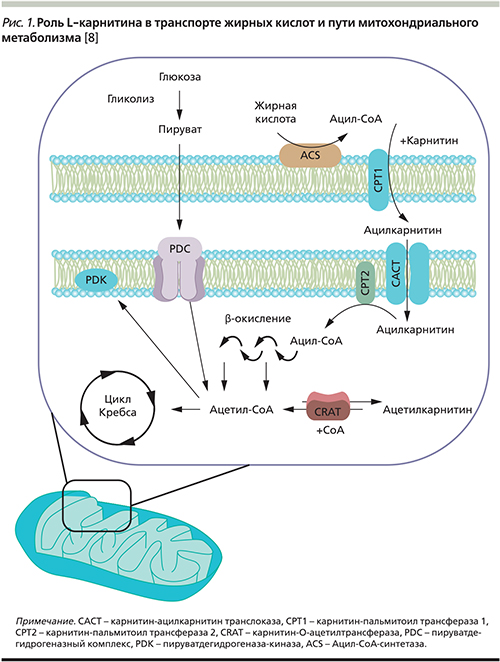
Интерес к возможности фармакологической коррекции нарушений энергетического обмена, сопряженных с гипоксией и энергодефицитом, постоянно растет, что связано с пониманием роли митохондрий, играющих доминирующую роль в обеспечении тканей организма энергией [1]. Нарушение митохондриальных функций является универсальным патологическим механизмом, задействованным в развитии большого числа различных патологических процессов. В настоящий момент принято выделять два вида митохондриальной дисфункции (МД): первичную как следствие врожденного генетического дефекта и вторичную, возникающую при различных приобретенных заболеваниях. Наиболее распространенными факторами, инициирующими вторичные процессы, являются нарушения липидного обмена, гипергликемия при сахарном диабете [2], ишемия/реперфузия при кардиоваскулярных заболеваниях [3]. Вторичная МД возникает при заболеваниях почек [4], нейродегенеративных [5] и онкологических заболеваниях [6]. По мнению Ю.А. Васюка и соавт. (2007), сложный механизм развития острого коронарного синдрома необходимо рассматривать с учетом развития гипоксии миокарда и как следствие – МД [7]. Именно в матриксе митохондрий происходят каскад сопряженных реакций аэробного окисления глюкозы в цикле трикарбоновых кислот и пируватдегидрогеназная реакция, в результате чего образуются субстраты, окисляющиеся в дыхательной цепи митохондрий, локализованной во внутренней митохондриальной мембране и непосредственно отвечающей за синтез аденозинтрифосфата (АТФ) – основного источника энергии для всех процессов, протекающих в клетке. В результате торможения аэробного окисления глюкозы происходит вынужденная перестройка энергообразования на анаэробный механизм с активацией гликолитического расщепления глюкозы, что ведет к разобщению гликолиза и цикла трикарбоновых кислот за счет торможения пируватдегидрогеназной реакции. Поступления ацетилкоэнзима А в цикл трикарбоновых кислот осуществляются за счет окисления свободных жирных кислот (СЖК). Переносчиком активированных длинноцепочечных жирных кислот через внутреннюю митохондриальную мембрану служит карнитин при участии специфического цитоплазматического фермента карнитин-ацилтрансферазы. Дальнейший процесс окисления СЖК представлен высокозатратным по отношению к кислороду каскадом энзиматических реакций с конечным образованием АТФ в цикле Кребса. Кроме того, избыток СЖК и ацетилкоэнзима А приводит к дальнейшему разобщению гликолиза, оказывает повреждающее действие на клеточные мембраны, в т.ч. и на мембранные структуры митохондрий, нарушая их функцию (рис. 1).
Повреждение митохондрий может способствовать активизации свободнорадикальных процессов и инициации механизмов программированной клеточной гибели, а нарушение митохондриального окислительного фосфорилирования, повреждение эндоплазматического ретикулума, изменение генной активности, в т.ч. генов, отвечающих за глюконеогенез, транспорт глюкозы, с одновременным увеличением синтеза провоспалительных цитокинов и нарушением в итоге углеводного и липидного обменов, может способствовать прогрессированию патологий, вызывавших вторичную МД.
К основным биохимическим проявлениям нарушения энергообмена относятся увеличение концентрации лактата и пирувата в плазме крови, в моче; наличие органических кислот в моче; изменения в спектре липидов и фосфолипидов крови; увеличение в плазме крови концентрации продуктов перекисного окисления липидов и снижение антиокислительной активности. Биохимические показатели не имеют значительного различия в зависимости от конкретного заболевания с митохондриальной недостаточностью – они служат диагностическим ориентиром [8].
Говоря о коррекции вторичной МД, следует отметить, что она может быть направлена на следующие процессы:
- окисление пирувата до ацетил-КоА;
- окисление ацетил-КоА до углекислого газа и образование носителей электронов (9 последовательных реакций цикла Кребса – конечный этап на пути окисления белков, жиров и углеводов);
- реокисление восстановленного коэнзима Q, энергия используется для синтеза АТФ из АДФ и фосфатов (окислительное фосфорилирование);
- транспорт СЖК через мембрану митохондрий в виде эфиров карнитина;
- окислительное дезаминирование аминокислот (их углеродный скелет поступает в цикл Кребса) [8].
Поэтому использование метаболических препаратов «энергокорректоров» должно носить дифференцированный характер и определяться особенностями формирующихся нарушений при различных метаболических процессах.
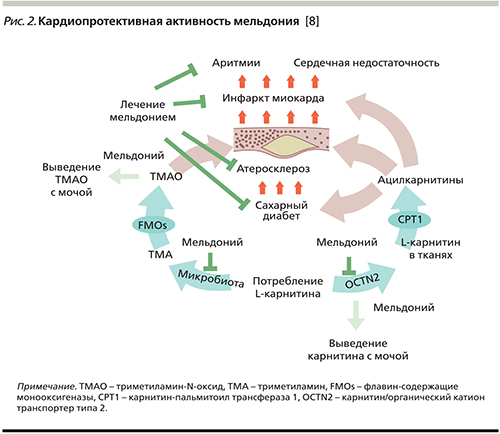
Собственный длительный опыт (более 10 лет) применения p-fox ингибитора СЖК мельдония в клинике внутренних болезней свидетельствует не только о его выраженном кардиопротективном действии, но и о возможности использования в практике лечения коморбидного пациента.
Кардиоцитопротективные эффекты мельдония
Механизмы кардиопротективного действия мельдония на сегодняшний день являются наиболее изученными (рис. 2).
Отмечено позитивное влияние мельдония на течение хронической сердечной недостаточности (ХСН) при ишемической болезни сердца [10]. Результаты проведенных клинических исследований доказали, что включение мельдония в комплексную терапию ХСН способствовало снижению функционального класса (ФК) сердечной недостаточности, повышению толерантности к выполнению физических нагрузок, увеличению сократимости миокарда (фракция выброса и систолический объем), росту диастолической функции левого желудочка (ЛЖ), улучшению самочувствия и качества жизни больных.
Мельдоний известен как лекарственный препарат, оказывающий негемодинамический антиишемический эффект. Доказана и востребована в клинической практике его антиангинальная активность [11]. Отмечена его эффективность при его использовании пациентами с острой ишемией миокарда [12]. Особенности фармакологического антиишемического эффекта мельдония опосредуются на обратимом ограничении скорости биосинтеза карнитина из γ-бутеробетаина за счет конкурентного ингибирования γ-бутиробетаингидроксилазы, который в свою очередь обеспечивает транспорт длинноцепочечных жирных кислот через мембраны митохондрий без воздействия на метаболизм короткоцепочечных жирных кислот в митохондрии клетки. Частичная блокада окисления жирных кислот включает альтернативную систему производства энергии – окисление глюкозы, которая значительно эффективнее использует кислород для синтеза АТФ [13, 14]. Кроме того, большое клиническое значение может иметь вегетостабилизирующее действие препарата [12]. По данным многочисленных исследований, мельдоний положительно влияет на показатели вегетативной регуляции по данным оценки вариабельности ритма сердца (ВРС), что может иметь большое клиническое значение для пациентов как с хроническими, так и с острыми формами ишемической болезни сердца. Известно, что перед ишемией снижается не только высоко-, но и низкочастотное воздействие на ритм сердца, при этом низкие значения спектральных показателей сохраняются во время эпизода ишемии миокарда в течение 20 минут после его окончания [15], отмечается корреляция вегетативных изменений с клиническими и электрокардиографическими проявлениями приступов ишемии миокарда [16]. Внутривенное применение мельдония в течение 10–14 дней в дозе 1000 мг/сут в составе комбинированной терапии в раннем постинфарктном периоде у больных сердечной недостаточностью оказывает позитивное влияние на течение восстановительного периода:
- уменьшает проявления ХСН, что сопровождается увеличением дистанции при проведении теста 6-минутной ходьбы (ТШХ), снижением тяжести ФК ХСН и уменьшением содержания в крови больных уровня NT-proBNP;
- уменьшает число эпизодов аритмии и ишемии;
- благоприятно влияет на структурно-функциональные параметры сердца (снижается число пациентов с неблагоприятными типами ремоделирования левого желудочка и улучшается диастолическая функция сердца);
- оказывает нормализующее влияние на основные показатели ВРС, увеличивает число больных с нормотонией и достоверно уменьшает число больных с гиперсимпатикотоническим вегетативным тонусом [17].
Данные собственных исследований также свидетельствуют о способности мельдония даже при краткосрочном (10–14 дней) применении (Идринол, раствор для внутримышечного, внутривенного введения, производитель ЗАО «ФармФирма «Сотекс») достоверно улучшать эндотелиальную функцию, состояние микрососудистого русла и благоприятно влиять на вариа-бельность сердечного ритма у пациентов с хронической сердечной недостаточностью и сахарным диабетом 2 типа.
Метаболический синдром и сахарный диабет 2 типа
В проведенных нами исследованиях по оценке эффективности мельдония в составе комбинированной терапии пациентов с ХСН и метаболическим синдромом, сахарным диабетом 2 типа (СД2) [18, 19] продемонстрированы «плейотропные» эффекты препарата по снижению уровня глюкозы. Кроме того, в составе комбинированной терапии ХСН у больных СД2 мельдоний способствовал достоверному снижению уровня гликозилированного гемоглобина, триглицеридов, холестерина липидов очень низкой плотности, что имеет принципиальное значение для больных ХСН и СД2. Сходные данные получены З.А. Суслиной и соавт [20, 21], которые отметили, что мельдоний повышал эффективность сахароснижающих препаратов, снижал уровень глюкозы крови, проявлял антиоксидантный эффект у больных ИБС в сочетании с СД2.
Нами изучено влияние мельдония на клинические проявления автономной кардиальной невропатии (АКН) у пациентов с СД2 и ХСН [22]. В ходе 16-недельного лечения мельдонием в составе комбинированной терапии ХСН отмечено достоверное снижение индекса централизации, к концу периода наблюдения имело место значимое усиление парасимпатических воздействий на синусовый узел. Обращает на себя внимание, что все отмеченные положительные эффекты мельдония проявили себя и в ходе проведения ортостатических проб в положении «стоя», что говорит о снижении степени выраженности гиперсимпатикотонии у больных ХСН и СД2 с АКН.
При использовании мельдония в составе комбинированной терапии больных СД2 и периферической (сенсомоторной) невропатией (ПСН) выявлено, что 12-недельная терапия мельдонием (1000 мг/сут) сопровождалась статистически значимым улучшением показателей, отражающих степень тяжести ПСН [23]. По данным шкалы НСС (Neuropathy Symptom Score), уменьшились такие симптомы периферической невропатии, как покалывание, жжение, онемение, ноющая боль, судороги, гиперестезии. По шкале НДС (Neuropathy Dysability Score), оценивающей уровень коленных и ахилловых рефлексов, болевую, температурную и вибрационную чувствительность, отмечено статистически значимое увеличение общего балльного показателя. Проведенное электронейромиографическое исследование показало, что через 12 недель лечения достоверно увеличилась скорость распространения возбуждения как по моторным, так и по сенсорным волокнам. Отмеченные клинические эффекты препарата могут быть опосредованы несколькими механизмами: уменьшением концентрации СЖК внутри митохондрий, индукцией образования оксида азота, оказывающего вазодилатирующее действие, возможностью коррекции оксидантного стресса.
Использование мельдония в неврологии
В 2010 г. было проведено исследование МАГНИТ (Возможности МилдронАта в коррекции коГНИТивных нарушений у пациентов с артериальной гипертензией пожилого возраста) по оценке эффективности различных схем использования мельдония (непрерывный и прерывистый) у пациентов пожилого возраста с артериальной гипертензией I–II степеней и сопутствующими когнитивными нарушениями [24, 25]. Показано, что прием препарата в дозе 500 мг/сут в течение 1 года сопровождается достоверным улучшением когнитивно-мнестических функций по данным опросника MMSE (Mini-Mental State Examination) в группе непрерывного приема. Достоверные изменения показателей по данным других нейропсихологических тестов были отмечены только в группе непрерывного приема мельдония. По данным теста Шульте, максимальное сокращение времени выполнения теста происходит в первые 3 месяца приема препарата, что соответствует первичной реакции клеток на прием метаболического препарата. Полученные результаты связаны с тем, что мельдоний может оказывать непосредственное воздействие на нервную систему, которое заключается во влиянии на нейронный метаболизм на уровне митохондрий, утилизацию АТФ, окисление липидов и захват глюкозы. Кроме того, описано возможное нейропротективное действие за счет подавления образования свободных радикалов как продуктов перекисного окисления липидов. Обсуждается нейротрансмиттерное холинергическое влияние мельдония на нейроны через формирование эфиров γ-бутиробетаина, активирующих ацетилхолиновые рецепторы [26]. Улучшение когнитивных функций напрямую связано с нормализацией кровоснабжения головного мозга. Поэтому положительное влияние мельдония на функциональную способность мозговых сосудов и кровоснабжение мозга может быть опосредовано NO-зависимым механизмом действия препарата.
Выраженное нейропротекторное действие мельдония продемонстрировано при его использовании в комплексном лечении острого периода ишемического инсульта. Отмечено ускорение восстановления двигательных, чувствительных и координаторных функций. Препарат способствует нормализации и восстановлению мнестических функций, фразовой речи, чтения, письма, снижает выраженность очагового неврологического дефицита, бытовой и социальной дезадаптации [27]. При хронической дисциркуляторной энцефалопатии препарат улучшает нейродинамические и регуляторные функции мозга [20].
Таким образом, накопленные к настоящему времени результаты клинических исследований свидетельствуют о том, что мельдоний, обладающий «энергокорректирующими» способностями, может быть использован для лечения вторичной МД у пациентов с сочетанной патологией. Эта способность характеризует мельдоний как «универсальный» цитопротектор и существенно расширяет возможности его применения при сердечно-сосудистой, неврологической патологии, СД, метаболическом синдроме и других заболеваниях, сопровождающихся коморбидной отягощенностью.



