Хроническая сердечная недостаточность (ХСН) с сохраненной фракцией выброса левого желудочка (ФВ ЛЖ) становится все более распространенной патологией, оказывающей значительное негативное влияние на каждого больного и общество в целом [1, 2]. Частота смертельных исходов и госпитализаций по поводу декомпенсации, средняя годовая стоимость лечения одного пациента при ХСН со сниженной и сохраненной ФВ ЛЖ сопоставимы [3–6]. Между тем достижения в области терапии ХСН со сниженной ФВ ЛЖ за последние 30 лет контрастируют с отсутствием доказательств улучшения прогноза при лечении ХСН с сохраненной ФВ ЛЖ [7, 8].
Бета-адреноблокаторы – один из классов препаратов, способных снижать смертность и частоту госпитализаций при ХСН со сниженной ФВ ЛЖ, а урежение частоты сердечных сокращений (ЧСС) является важным элементом их клинической эффективности. Ивабрадин, первый блокатор If-каналов, утвержденный FDA (Food and Drug Administration) и включенный в Рекомендации ACC/AHA/HFSA (American College of Cardiology/American Heart Association/Heart Failure Society of America) по новой терапии ХСН [9], существенно снижает число госпитализаций с декомпенсацией и смертельных исходов среди пациентов с систолической ХСН и повышенной ЧСС, уменьшает ремоделирование ЛЖ, повышает толерантность к физической нагрузке, улучшает качество жизни независимо от сопутствующих заболеваний, отличается хорошей переносимостью [10–12]. Вероятно, результаты проводимых и планируемых в будущем исследований позволят с успехом применять ивабрадин в клинических ситуациях, находящихся за пределами нынешних показаний [13–15]. К настоящему времени завершены единичные исследования краткосрочной терапии ивабрадином при ХСН с сохраненной ФВ ЛЖ, принесшие противоречивые результаты [16, 17].
Цель настоящего исследования – сравнение эффективности бисопролола и ивабрадина при длительном лечении ХСН с сохраненной ФВ ЛЖ у пациентов с артериальной гипертензией (АГ) и ишемической болезнью сердца (ИБС).
Материал и методы
В исследовании участвовали 126 больных в возрасте от 51 года до 70 лет с ХСН II–III функциональных классов (ФК) по классификации Нью-Йоркской Ассоциации сердца и сохраненной ФВ ЛЖ на фоне АГ III стадии и ИБС со стенокардией напряжения I–II ФК по классификации Канадского сердечно-сосудистого общества.
Критерии включения в исследование: АГ в анамнезе, ИБС со стенокардией не выше II ФК в анамнезе, одышка, утомляемость, сердцебиение при физической нагрузке, ФВ ЛЖ 50% и более [7], синусовый ритм с ЧСС в покое 70 уд/мин и более; 1-й тип диастолической дисфункции ЛЖ (с замедленной релаксацией), подписанное информированное согласие.
Наличие у пациентов диастолической дисфункции ЛЖ констатировали в соответствии с критериями Европейского общества кардиологов [18] и с учетом рекомендаций Американского общества эхокардио-графии и Европейской ассоциации эхокардиографии [19].

В исследование не включали пациентов с гемодинамически значимым поражением клапанов сердца, кардио-миопатиями, перенесенным острым коронарным синдромом или инсультом, синдромом слабости синусового узла, фибрилляцией предсердий, атриовентрикулярной блокадой II–III степеней, вторичными АГ; индексом массы тела (ИМТ) более 30 кг/м2, заболеваниями органов дыхания с дыхательной недостаточностью, анемией (уровень гемоглобина ниже 130 г/л у мужчин и 120 г/л у женщин), нарушениями функции печени или почек, сахарным диабетом, требовавшим инсулинотерапии. Получено одобрение локального Комитета по этике на проведение исследования.
После рандомизации лечение АГ проводили, переводя всех пациентов на прием фиксированной комбинации периндоприл/амлодипин, титруя дозу от 5/5 мг до 10/5, 5/10 и 10/10 мг 1 раз в сутки с целью достижения и поддержания офисного артериального давления (АД) ниже 140 и 90 мм рт.ст. Пациенты, которым для достижения целевого АД требовалось дополнительное применение других антигипертензивных препаратов, а также требовавшие существенных изменений сопутствующего лечения при длительном наблюдении, исключались из исследования. Одновременно с периндоприлом/амлодипином больным назначали один из вариантов терапии, урежающей частоту синусового ритма: бисопролол с титрованием дозы от 1,25 до 10 мг 1 раз в сутки или ивабрадин – от 2,5 до 7,5 мг 2 раза в сутки до достижения ЧСС в покое 55–60 уд/мин.
Комплексное обследование больных проведено исходно и через 12 месяцев подобранной терапии, кроме общеклинического исследование включило электрокардиографию в 12 отведениях, тест 6-минутной ходьбы, тредмил-тест в соответствии с модифицированным протоколом Bruce, оценку клинического состояния по шкале ШОКС (шкала оценки клинического состояния) в модификации В.Ю. Мареева, оценку качества жизни с использованием Миннесотского опросника (MLHFQ – Minnesota Living with Heart Failure Questionnaire), определение концентрации N-концевого предшественника мозгового натрийуретического пептида (NT-proBNP) в крови (на анализаторе СOBAS H 232, Roche Diagnostics GmbH, Германия), эхокардиографию (ЭхоКГ).
ЭхоКГ (в М- и В-режиме, импульсноволновую, в т.ч. тканевую, допплерографию) выполняли по стандартным рекомендациям [18, 19] с использованием ультразвуковой системы Aloka Alpha 7 (Япония) и векторного датчика с частотой 2,5 МГц. Размер и объем ЛЖ определяли по методу Simpson. Рассчитывали объем левого предсердия (ЛП), ФВ ЛЖ в автоматическом режиме с помощью интегрированного программного обеспечения, массу миокарда ЛЖ по формуле R.B. Devereux.
Для оценки диастолической функции ЛЖ использовали максимальные скорости раннего диастолического наполнения (Е) и наполнения в систолу предсердий (А), их соотношение (Е/А), время изоволюмического расслабления ЛЖ (IVRT), время замедления кровотока раннего диастолического наполнения (DТ). Показатели Е, А и DT оценивались из апикального доступа в проекции четырехкамерного сечения с помощью импульсно-волновой допплерографии, размещая контрольный объем между концами створок митрального клапана. Максимальную скорость диастолического подъема основания ЛЖ в раннюю диастолу (e’) определяли при помощи импульсно-волновой тканевой допплерографии из апикального доступа, устанавливая контрольный объем на митральное кольцо в области межжелудочковой перегородки и боковой стенки ЛЖ. Величину е’ получали путем усреднения скоростей из области межжелудочковой перегородки и боковой стенки ЛЖ. Значения отношения E/е’ усредняли из трех последовательных сердечных циклов.

В статистическую обработку включали только результаты обследования пациентов, полностью выполнивших протокол исследования, применяли пакет прикладных программ «Statistica 6.1» (StatSot Inc, США). Образовавшиеся группы проверялись на нормальность распределения с помощью одностороннего теста Колмогорова–Смирнова. Все данные представлены в виде средней арифметической (М), стандартного отклонения средней арифметической (SD). Достоверность различий показателей по количественным признакам определяли по t-критерию Стьюдента, по качественным – с использованием χ2-критерия, признавая их статистически значимыми при р<0,05.
Результаты исследования
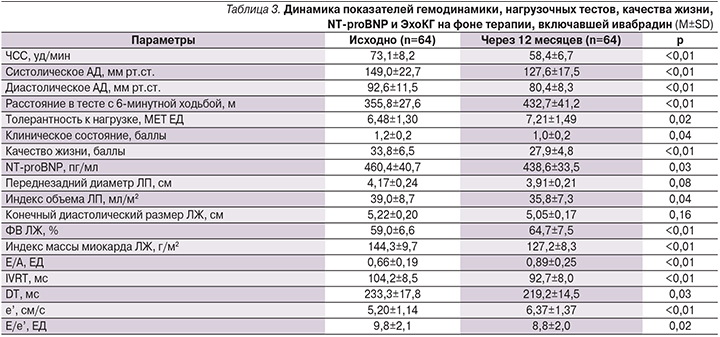
Характеристики двух образовавшихся групп пациентов оказались хорошо сбалансированными по ряду показателей (табл. 1). Изменения некоторых показателей гемодинамики, нагрузочных тестов, биохимического исследования крови, качества жизни и ЭхоКГ в процессе длительной терапии, включившей бисопролол или ивабрадин, представлены в табл. 2 и 3.
Наличие у обследованных пациентов диастолической дисфункции ЛЖ 1-го типа подтверждено величиной отношения E/A менее 0,8 (с учетом возраста), IVRT более 100 мс и DT более 200 мс, дилатацией ЛП. При этом отношение Е/е’ не превышало 15, что позволяло констатировать отсутствие явного повышения конечного диастолического давления в ЛЖ в покое, характерного для более тяжелого 2-го типа диастолической дисфункции ЛЖ.
В обеих группах удавалось обеспечить желаемое урежение ЧСС под действием средней дозы бисопролола 6,3±3,4 мг/сут, ивабрадина – 10,5±5,6 мг/сут. Для достижения целевого уровня АД в большинстве случаев применяли периндоприл/амлодипин в начальной дозе 5/5 мг/сут (66,1 и 57,8% случаев в группах бисопролола и ивабрадина соответственно; р>0,05). Периндоприл/амлодипин в дозах 10/5 мг, 5/10 и 10/10 мг использовали 12,9 и 14,1%; 8,1 и 10,9%; 12,9 и 17,2% больных в комбинации с бисопрололом или ивабрадином соответственно (р>0,05 для всех сравнений между группами).
Среднее расстояние, пройденное в тесте с 6-минутной ходьбой, и толерантность к физической нагрузке существенно увеличивались только при лечении ивабрадином. Также только в группе ивабрадина повышалось качество жизни пациентов, снижались уровень NT-proBNP и индекс объема ЛП. В обеих группах при длительной терапии происходило увеличение ФВ ЛЖ и значительное уменьшение его гипертрофии. При этом важнейшие показатели диастолической функции ЛЖ улучшались только в группе ивабрадина.
Обсуждение
Лечение больных ХСН и сохраненной ФВ ЛЖ остается в значительной степени эмпирическим, т.к. ни один из способов терапии не улучшил прогноза пациентов. В ходе продолжающегося изучения возможных патофизиологических механизмов данной формы ХСН рассматриваются две основные гипотезы: 1) повышенная артериальная жесткость и 2) пассивная жесткость ЛЖ. Предполагается, что у пациентов с ХСН и сохраненной ФВ ЛЖ естественное возрастное нарушение желудочково-артериальной взаимосвязи протекает особенно тяжело вследствие влияния сопутствующей некардиологической патологии [2, 20].
В клинических исследованиях подтверждается вклад эндотелиальной дисфункции и ремоделирования сосудистой стенки в развитие ХСН с сохраненной ФВ ЛЖ [21]. При наблюдении за 2290 здоровыми людьми в среднем в течение 11,4 года установлено, что более высокая скорость распространения пульсовой волны от сонной до бедренной артерии, свидетельствующая о повышенной жесткости артерий, ассоциировалась с повышенным риском развития ХСН с сохраненной ФВ ЛЖ. Однако после учета традиционных сердечно-сосудистых факторов риска и проведения корректировки выявленная связь утрачивала статистическую значимость [22].
АГ – не только основная причина ХСН с сохраненной ФВ ЛЖ, но и предиктор сердечно-сосудистых осложнений у таких больных, особенно при ночной гипертензии [23]. Поэтому для достижения целевого АД целесообразно выбирать препараты с доказанным позитивным влиянием на эндотелиальную функцию и структуру артериального русла, суточный профиль АД (в нашей работе периндоприл и амлодипин), которые можно рассматривать в качестве потенциальных терапевтических мишеней при лечении ХСН с сохраненной ФВ ЛЖ [21].
Традиционно более обоснованной представлялась терапия ХСН с сохраненной ФВ ЛЖ лекарственными средствами, способными уменьшать фиброз и, соответственно, жесткость ЛЖ. Но по данным мета-анализа 15 рандомизированных контролируемых исследований (n=15 671), антагонисты рецепторов альдостерона не снижали риска смерти от всех причин при ХСН с сохраненной ФВ ЛЖ (относительный риск – 0,91 при 95% доверительном интервале от 0,76 до 1,1) [24].
С механистической точки зрения при ХСН с сохраненной ФВ ЛЖ должно оказаться эффективным лечение, продляющее диастолу, т.е. время наполнения ЛЖ кровью. Такая возможность не исключается по результатам клинических наблюдений применения β-адреноблокаторов [25].
В нашей работе ивабрадин (но не бисопролол) увеличивал среднее расстояние, пройденное в тесте с 6-минутной ходьбой и толерантность к физической нагрузке, улучшая качество жизни больных. Только в группе лечения ивабрадином отмечено улучшение активного расслабления и податливости ЛЖ, на что указывала динамика ЭхоКГ-показателей. F.H. Erdem и соавт. недавно сообщили, что ивабрадин улучшает синхронизацию и индекс Tei (отражает функциональное состояние ЛЖ в комплексе – его систолическую и диастолическую функции одновременно) у больных ХСН [26].
Другим преимуществом ивабрадина перед бисопрололом, по результатам нашего исследования, следует признать уменьшение индекса объема ЛП, которое регулирует диастолическое наполнение ЛЖ посредством трех функций: резервуарной (во время систолы ЛЖ), транспортной (в периоды ранней и средней диастолы ЛЖ) и насосной (в фазу систолы ЛП). В исследовании TOPCAT (Treatment of Preserved Cardiac Function Heart Failure with an Aldosterone Antagonist) уменьшение объема ЛП ассоциировалось со снижением риска наступления первичной композитной конечной точки (сердечно-сосудистая смерть, госпитализация из-за ХСН и успешная реанимация при остановке сердца) у пациентов с ХСН и сохраненной ФВ ЛЖ [27]. Дисфункция ЛП, характерная для этой категории больных [28], ассоциируется с повышенным риском госпитализации по поводу декомпенсации вне зависимости от влияния других клинических факторов [29]. По данным S. Ozturk и соавт., добавление ивабрадина к стандартной терапии систолической ХСН сопровождалось значительным улучшением проведения импульсов по предсердиям и механической функции ЛП [30]. В то же время M. Sardana и соавт. [31] недавно установили, что использование β-адреноблокаторов связано со значительным нарушением резервуарной, транспортной и насосной функций ЛП при АГ. По мнению этих авторов, такое действие β-адреноблокаторов может лежать в основе повышенного риска развития фибрилляции предсердий и инсульта при их использовании (в отличие от других антигипертензивных препаратов), продемонстрированного в крупных клинических проектах [32].
Уровень NT-proBNP у участников нашего исследования снижался в группе ивабрадина, но не бисопролола.
В рутинной клинической практике снижение NT-proBNP при лечении ХСН с сохраненной ФВ ЛЖ связано с уменьшением смертности и заболеваемости [33].
Несмотря на то что β-адрено-блокаторы служат основой терапии ХСН, увеличение их дозы при сохранении высокой ЧСС связано с увеличением риска развития побочных эффектов. Применение ивабрадина в такой ситуации убедительно обосновано и безопасно [34].
Согласно мнению некоторых авторов, ХСН с сохраненной ФВ ЛЖ не следует рассматривать как патологию с отсутствием эффективных методов лечения. Несмотря на отсутствие «прорыва» в клинических исследованиях, некоторые существующие препараты могут оказаться полезными для конкретных подгрупп пациентов с ХСН и сохраненной ФВ ЛЖ [35]. В соответствии с результатами нашей работы ивабрадин по сравнению с бисопрололом имеет преимущества при лечении больных ХСН с сохраненной ФВ ЛЖ на фоне АГ и ИБС.


