Высокая распространенность хронической сердечной недостаточности (ХСН), ее прогрессирующее течение с нередким развитием жизнеугрожающих осложнений стимулируют как совершенствование своевременной диагностики, так и поиск рационального, научно обоснованного лечения больных с этим состоянием.
В мае 2016 г. на конгрессе Европейского общества кардиологов (ESС – European Society of Cardiology) по сердечной недостаточности (СН) во Флоренции были представлены новые клинические рекомендации специалистов ESС и Ассоциации по СН (Heart Failure Association) по диагностике и лечению острой и хронической СН – ХСН [1]. Обновленная версия рекомендаций, как и предыдущая (2012), содержит обобщенные за последние годы данные по этиологии, классификации, диагностике, лечению, а также ведению отдельных групп больных СН с учетом влияния на прогноз жизни.
В клинические рекомендации внесены некоторые изменения и дополнения:
- Предложены диагностические критерии СН в зависимости от фракции выброса левого желудочка (ФВ ЛЖ): менее 40%; 40–49% (HFmrEF – Heart Failure with mid-range ejection fraction); 50% и выше.
- Представлен алгоритм диагностики ХСН.
- Разработан комбинированный алгоритм диагностики и лечения острой СН, основанный на наличии/отсутствии застоя/гипоперфузии.
- Впервые в клинические рекомендации включен препарат ингибитор неприлизина, ингибитор рецепторов ангиотензина II (тип 1).
- Изменены показания к проведению кардиоресинхронизирующей терапии.
- Предложено раннее проведение адекватной терапии острой СН одновременно с ее диагностикой (концепция «time to therapy»).
Сердечная недостаточность – это клинический синдром, характеризующийся типичными симптомами (одышка, отеки лодыжек, усталость), которые могут сопровождаться признаками (повышение давления в яремных венах, хрипы в легких, периферические отеки и др.) в результате структурных и/или функциональных изменений со стороны сердца, приводящих к снижению его работы и/или повышению внутрисердечного давления в покое или при нагрузке.
Эксперты акцентируют внимание докторов на выявлении бессимптомных структурных или функциональных изменений сердца (систолическая или диастолическая дисфункция ЛЖ), которые рассматриваются в качестве «предшественников» СН и ассоциируются не только с неблагоприятным прогнозом, но и со снижением летальности при своевременно начатой рациональной терапии больных бессимптомной систолической дисфункцией ЛЖ.
Рекомендовано применять термин ХСН в том случае, когда у пациента имеются симптомы и/или признаки СН на протяжении некоторого периода времени. При сниженной ФВ ЛЖ и отсутствии симптомов или признаков СН, в т.ч. и в анамнезе, пациент рассматривается как имеющий «бессимптомную систолическую дисфункцию ЛЖ». Если в результате лечения состояние пациента остается стабильным на протяжении минимум одного месяца, пациент рассматривается как имеющий «стабильную СН». «Декомпенсацию». СН предложено рассматривать при обострении ХСН, которая может возникать внезапно и постепенно, нередко приводя к госпитализациям больных. Впервые возникшая (de novo) СН может манифестировать остро или постепенно. Термин «застойная» СН предложено использовать для описания острой или ХСН с признаками объемной перегрузки. Вышеуказанные состояния в большинстве случаев могут встречаться у одного и того же пациента в разные периоды времени в зависимости от течения СН.
Одним из существенных изменений последних рекомендаций является выделение в отдельную группу пациентов с ФВ ЛЖ 40–49%, на долю которых приходится от 10 до 20% больных СН (табл. 1).
Раздел 7 рекомендаций посвящен фармакотерапии СН со сниженной ФВ ЛЖ. Цель лечения СН направлена на улучшение клинического и функционального состояния, качества жизни, предупреждение госпитализаций и уменьшение смертности. Все препараты разделены на две группы – рекомендованные и не рекомендованные к применению больными СН.

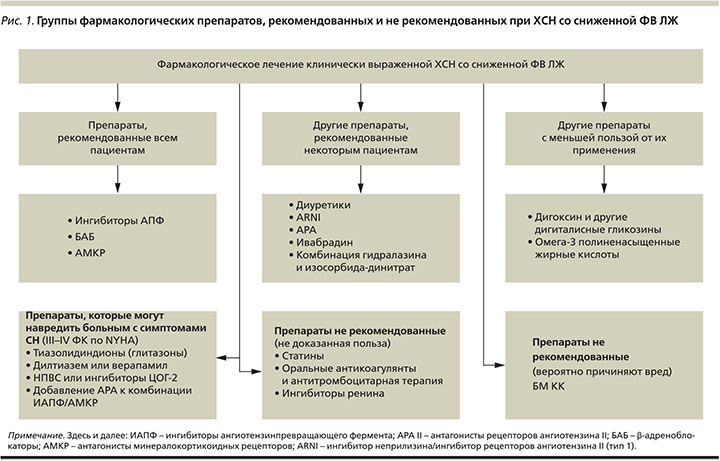
Препараты, рекомендованные к применению при клинически выраженной СН со сниженной ФВ ЛЖ, разделены на три группы (рис. 1):
- Препараты, рекомендованные всем пациентам.
- Другие препараты, рекомендованные некоторым пациентам.
- Другие препараты с меньшей пользой от их применения.
Препараты, не рекомендованные к применению при клинически выраженной СН со сниженной ФВ ЛЖ, также разделены на три группы (рис. 1):
- Препараты, нерекомендованные (не доказанная польза).
- Препараты, не рекомендованные (вероятно, причиняют вред).
- Препараты, которые могут навредить больным с симптомами СН (III–IV ФК по NYHA – New York Heart Association).
Нейрогормональные антагонисты (ИАПФ, АМКР и БАБ) из-за доказанного благоприятного влияния на выживаемость больных ХСН остаются рекомендованными к назначению всем больным клинически выраженной СН и сниженной ФВ ЛЖ (класс рекомендаций I, уровень доказательства A), за исключением их непереносимости или противопоказаний к применению (табл. 2).
ИАПФ следует титровать до максимально переносимой дозы для адекватного снижения активности ренин-ангиотензин-альдостероновой системы, поскольку существуют доказательства, что в клинической практике большинство больных принимают субоптимальные дозы ИАПФ [2].
ИАПФ также рекомендованы больным бессимптомной систолической дисфункцией ЛЖ с целью снижения риска прогрессирования СН, госпитализаций и смерти.

Совместное применение ИАПФ и БАБ обеспечивает взаимодополняющий эффект в начале лечения больных СН и сниженной ФВ ЛЖ (класс рекомендаций I, уровень доказательства А). Существуют весомые доказательства благоприятного влияния БАБ на заболеваемость и смертность пациентов со сниженной ФВ ЛЖ независимо от применения ИАПФ и в большинстве случаев – от диуретиков [3, 4].
БАБ рекомендованы к применению во всех случаях стабильного течения СН, начиная с минимальных доз с последующим постепенным повышением их до максимально переносимых с целью улучшения клинической симптоматики, уменьшения числа госпитализаций по поводу СН и повышения выживаемости. У пациентов с инфарктом миокарда в анамнезе и у пациентов с бессимптомной дисфункцией ЛЖ БАБ также являются препаратом выбора с целью снижения риска смерти.
Недавний мета-анализ всех крупных исследований по изучению БАБ при ХСН и сниженной ФВ ЛЖ (n=18 254, из них 13 946/76% больных имели синусовый ритм, 3066/17% – фибрилляцию предсердий – ФП) не выявил преимуществ влияния БАБ на частоту госпитализаций и снижение всех случаев смерти в подгруппе больных со сниженной ФВ ЛЖ и ФП [5]. Поскольку это был ретроспективный анализ данных и БАБ не увеличивали риск смерти, Комитет экспертов по созданию текущих рекомендаций решил не разделять показания в зависимости от ритма сердца. БАБ являются средством выбора для контроля ритма у пациентов со сниженной ФВ ЛЖ и ФП, включая и тех, у кого высокая частота сердечных сокращений (ЧСС).
АМКР (спиронолактон и эплеренон) назначают всем пациентам с сохраняющимися клиническими симптомами СН и ФВ ЛЖ≤35%, несмотря на лечение ИАПФ и БАБ, с целью уменьшения госпитализаций по поводу СН и смертности [6, 7].

Результаты первого крупного международного клинического исследования RALES [6] по применению cпиронолактона больными СН в небольших дозах (25–50 мг/сут) в течение 24 месяцев на фоне ИАПФ показали снижение cмертности на 30% как от прогрессирования СН, так и от внезапной cердечной смерти.
В отличие от спиронолактона cелективный антагонист альдостерона эплеренон имеет бóльшую тропность к альдостероновым рецепторам, а его аффинность к прогестероновым и андрогеновым рецепторам в 100 и 1000 раз соответственно ниже, чем у спиронолактона, в связи с чем побочные эффекты при применении этого препарата регистрируются значительно реже. В двойном слепом рандомизированном исследовании EMPHASIS-HF [8] приняли участие 2737 больных в возрасте 55 лет и старше с ХСН II ФК по NYHA и ФВ ЛЖ не более 35%. Эплеренон рекомендовали в начальной дозе 25 мг/сут (1-я группа) с титрацией до 50 мг/сут через 4 недели на фоне комплексной терапии ИАПФ, АРА и БАБ в максимально переносимой дозе. Группу контроля составили больные, получавшие плацебо. Промежуточный анализ через 21 месяц от начала исследования показал значимое снижение летальности от сердечно-сосудистых причин и снижение числа госпитализаций больных, что послужило основанием для преждевременного прекращения исследования (табл. 3).
Показано, что клинический эффект эплеренона объясняется не только благоприятными электролитными изменениями, но и уменьшением интерстициального фиброза миокарда, оксидативного стресса, улучшением эндотелиальной функции, снижением агрегации тромбоцитов, активности металлопротеиназ и симпато-адреналовой системы. Важен тот факт, что альдостерон связывается не только со своими специфическими рецепторами в миокарде, макрофагах, но и с фибробластами. В результате этого взаимодействия усиливается синтез и накопление коллагена III типа, что способствует повышению жесткости миокарда, развитию периваскулярного и интерстициального фиброза, ремоделированию миокарда и артериального русла. Ухудшение вазомоторного резерва коронарных сосудов, крово-снабжения миокарда приводит к гибели кардиомиоцитов, ускоряя процесс фиброза, диастолической и систолической дисфункции.

Благоприятным эффектом АМКР является и снижение риска фатальных желудочковых и наджелудочковых нарушений ритма, ФП. Возможно, что этот эффект обусловлен как предотвращением гипокалиемии, так и антифибротическим действием АМКР [9].
Гиперкалиемия является наиболее частым побочным эффектом терапии АМКР, однако тяжелых клинических осложнений гиперкалиемии возможно избежать при соблюдении осторожности в отношении пациентов со сниженной функцией почек и уровнем калия в сыворотке крови более 5,0 ммоль/л.
В зависимости от клинического состояния необходим контроль уровня калия и функции почек. Следует отметить немаловажный факт, согласно которому повышение уровня калия более 6,0 ммоль/л наблюдалось в 0,6% случаев среди пациентов, принимавших эплеренон, и не достигало статистически выраженной разницы по сравнению с пациентами, принимавшими плацебо (р>0,05). В трех крупных исследованиях по изучению АМКР (RALES, EPHESUS, EMPHASUS-HF) не было зарегистрировано летальных исходов в результате гиперкалиемии.
Ряд препаратов (в частности, итраконазол, кетоконазол, ритонавир, кларитромицин) может увеличивать концентрацию эплеренона в крови из-за подавления активности ферментов CYP3А4, что также следует учитывать при назначении данного препарата.
Диуретики показаны больным при отечном синдроме для уменьшения выраженности клинических симптомов и признаков СН (класс I, уровень В); выбор препарата и его дозы определяет лечащий врач (табл. 4).
Целью диуретической терапии является достижение и поддержание эуволемического статуса с применением наименьшей эффективной дозы в зависимости от состояния пациента. У пациентов со сниженной ФВ ЛЖ при наличии признаков застоя диуретики рекомендованы к назначению с ИАПФ (или АРА), БАБ и АМКР. У некоторых пациентов без клинических симптомов с эуволемией/гиповолемией диуретическая терапия временно может прекращаться. Пациенты могут самостоятельно корректировать дозу диуретиков в зависимости от клинической картины (симптомы/признаки застоя и ежедневное измерение массы тела).
В клинические рекомендации 2016 г. включен новый препарат, сакубитрил/вальсартан, сочетающий блокатор неприлизина (нейтральной эндопептидазы – НЭП) и АТ1-рецепторов. Неприлизин – фермент, вырабатываемый эндотелием сосудов и участвующий в деградации НУП и брадикинина. Кардиоваскулярные и ренальные эффекты НУП заключаются в снижении артериального давления (АД) через влияние на сосудистый тонус и водно-электролитный баланс, а также антипролиферативном и антифибротическом действиях на органы-мишени. К настоящему времени стало известно, что развитие сердечно-сосудистых заболеваний ассоциируется с дисрегуляцией системы НУП. Так, при ХСН на фоне дефицита наблюдается аномалия функционирования гормонов этой системы. Поэтому для потенцирования системы НУП с целью достижения дополнительного гипотензивного и протективных кардиоренальных эффектов возможно применение ингибиторов НЭП [10, 11]. Ингибирование неприлизина приводит к усилению натрийуретического, диуретического и вазодилатирующего эффектов эндогенного НУП и в результате – к снижению АД. Однако НЭП участвует в деградации и других вазоактивных пептидов, в частности АТI, АТII и эндотелина-1. Поэтому баланс эффектов воздействия на сосудистый тонус ингибиторов НЭП вариабельный и зависит от преобладания констрикторных и дилатирующих влияний. В связи с этим сочетание эффектов ИАПФ/АРА и ингибиторов НЭП может существенно потенцировать гемодинамические и антипролиферативные эффекты в результате комплементарного механизма действия.
Эффективность и безопасность сакубитрила/вальсартана были изучены в многоцентровом двойном слепом плацебо-контролируемом исследовании 8442 пациентов с ХСН (медиана наблюдения – 27 месяцев) PARADIGM-HF (Prospective comparison of ARNI with ACEI to Determine Impact on Global Mortailty and morbidity in Heart Failure trial) [12]. В исследование включены больные в возрасте 18 лет и старше с СН II–IV ФК NYHA, ФВ ЛЖ≤40% (в соответствии с поправками к протоколу от декабря 2010 г. для включения в исследования ФВ ЛЖ должна была быть 35%), уровнем BNP не менее 150 пкг/мл (или NT-proBNP не менее 600 пкг/мл), но при госпитализации по поводу СН в течение предшествовавшего года BNP должен был быть не менее 100 пкг/мл (или NT-proBNP не менее 400 пкг/мл). Больные получали терапию ИАПФ или АРА, но в течение не менее 4 недель до первого обследования необходимо было принимать БАБ и ИАПФ (или АРА) в стабильной дозе, эквивалентной не менее 10 мг эналаприла. Применение сакубитрила/вальсартана оказалось более эффективным, чем эналаприл, для снижения как госпитализаций по поводу декомпенсации СН, так и риска летального исхода (отношение риска [ОР]=0,80; р<0,001). В группе сакубитрила/вальсартана и эналаприла были госпитализированы 12,8 и 15,6% больных соответственно (ОР=0,79; p<0,001), общая смертность достигла 17 и 19,8% соответственно (ОР=0,84; p<0,001).
Результаты исследования PARADIGM-HF позволили рассматривать сакубитрил/валсартан в качестве альтернативы ИАПФ при сохранении клинических симптомов СН и ФВ ЛЖ≤35% у амбулаторных больных, принимавших в оптимальной дозе ИАПФ/АРАII+БАБ+АМКР, с целью снижения риска госпитализаций в связи с декомпенсацией СН и летального исхода (класс I, уровень B).
АРА II рекомендованы к применению при СН в качестве альтернативы ИАПФ при их непереносимости для снижения риска госпитализаций в связи с СН и сердечно-сосудистой смерти (класс I, уровень В) [13, 14]. Следует избегать комбинации ИАПФ/АРА, за исключением случаев клинически выраженной СН со сниженной ФВ ЛЖ при приеме БАБ и непереносимости АМКР.
Сохранение ивабрадина в текущих рекомендациях в качестве препарата выбора при СН с ФВ ЛЖ≤35%, синусовым ритмом с ЧСС≥70 уд/мин и госпитализацией в течение предшествовавшего года по поводу прогрессирования СН для снижения риска смерти и госпитализаций по поводу СН (класс IIa, уровень В) вполне закономерно. Результаты исследования SHIFT (Systolic Heart Failure Treatment with the If Inhibitor Ivabradine Trial), в котором приняли участие 6558 пациентов с клинически выраженной СН, ФВ ЛЖ≤35% и ЧСС≥70 уд/мин, показали снижение сердечно-сосудистой смертности и госпитализаций в связи с декомпенсацией СН в группе больных, получавших ивабрадин, по сравнению с группой плацебо на фоне лечения в соответствии с принятыми рекомендациями (ОР=0,82; р<0,0001), что соответствует целям лечения больных СН [15].
Комбинация гидралазина и изосорбида динитрата может быть рекомендована пациентам с клинически выраженной СН и сниженной ФВ ЛЖ при непереносимости (противопоказании) ИАПФ/АРА для снижения риска смерти (класс II b, уровень В). Но следует помнить, что эти рекомендации базируются на данных исследования Veterans Administration Cooperative Study, в котором участвовали пациенты, принимавшие только дигоксин и диуретики [16].
Сердечные гликозиды (дигоксин) показаны при сохранении клинически выраженной СН на фоне синусового ритма, несмотря на лечение ИАПФ/АРА, БАБ и АМКР, для снижения риска как общей, так и по поводу СН госпитализаций (класс II b, уровень В). В крупном клиническом исследовании DIG trial был показан нейтральный эффект влияния дигоксина на смертность и частоту госпитализаций пациентов с ХСН. Вместе с тем применение дигоксина на фоне ФП и ХСН способствует повышению смертности, что показано в ряде мета-анализов [17–22] (табл. 5).
Дигоксин рекомендован больным СН и сниженной ФВ ЛЖ, сочетающейся с ФП, для урежения ритма желудочков при невозможности применять другие методы лечения, что подтверждается в недавнем мета-анализе, построенном на результатах разных по дизайну клинических исследований. В него было включено 7 рандомизированных клинических исследования (n=8406), мета-анализ которых не показал негативного влияния дигоксина на смертность больных ФП и СН, большинство из которых имели сниженную ФВ ЛЖ (ОР=0,99) [23].
Препараты омега-3 полиненасыщенных жирных кислот могут быть рекомендованы пациентам при клинически выраженной СН в дополнение к основным средствам лечения для снижения риска госпитализации и смерти от сердечно-сосудистых причин (класс II b, уровень В). Эти показания базируются на результатах крупного клинического исследования GISSI-HF, в котором наблюдалось снижение сердечно-сосудистой смертности и госпитализаций при добавлении препаратов омега-3 полиненасыщенных жирных кислот к основному лечению СН [24].
Эксперты обращают внимание докторов на нецелесообразность начала лечения статинами большинство больных СН, поскольку не показано положительного влияния этих препаратов на прогноз жизни больных СН и сниженной ФВ ЛЖ, за исключением тех случаев, когда пациент принимает статины в связи с ИБС и/или гиперлипидемией.
В рекомендациях дан перечень не рекомендованных к применению при ХСН препаратов, краткое резюме по которому представлено ниже.
Прямой ингибитор ренина алискирен не рекомендован к применению больными СН как замена ИАПФ/АРА II.
Пероральные антикоагулянты не рекомендованы к применению больными СН и синусовым ритмом из-за отсутствия доказательств их влияния на заболеваемость/смертность. При ФП или высоком риске венозного тромбоза больным СН целесообразно продолжение приема этих препаратов.
Антитромбоцитарные препараты, включая ацетилсалициловую кислоту, пациентам с СН без сопутствующей ИБС не рекомендованы к применению из-за отсутствия существенных доказательств положительного влияния на прогноз жизни.
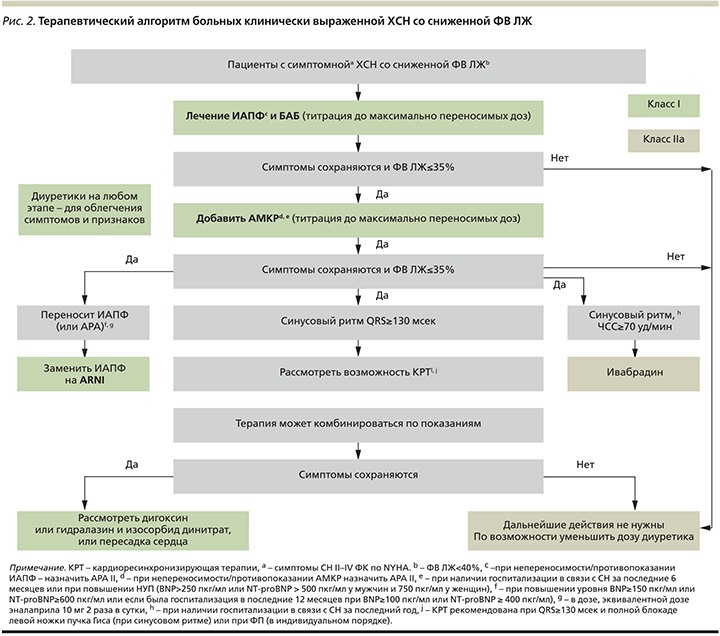
Тиазолидины (класс III, уровень A), нестероидные противовоспалительные средства (класс III, уровень В), дилтиазем и верапамил (класс III, уровень С), не рекомендованы к применению при СН со сниженной ФВ ЛЖ из-за увеличения риска прогрессирования СН и госпитализаций. Терапевтический алгоритм больных клинически выраженной СН и сниженной ФВ ЛЖ представлен на рис. 2.
При выборе тактики лечения больных СН и сохраненной ФВ ЛЖ большое значение придается своевременному скринингу и лечению сопутствующей патологии как сердечно-сосудистого, так и другого происхождения (класс I, уровень С). Это обусловлено тем, что на сегодняшний день окончательно не определена медикаментозная терапия, способная влиять как на заболеваемость, так и на смертность при этом виде СН. Основной целью лечения таких пациентов является улучшение клинического состояния и качества жизни, поскольку в большинстве случаев это лица старшего возраста.
Таким образом, стратегия лечебных мероприятий при СН комплексная и предполагает индивидуализированный подход к пациенту в зависимости от клинической ситуации. Широкий спектр медикаментозных препаратов и алгоритм лечения, предложенные в обновленных клинических рекомендациях, должны помочь врачам в повседневной клинической практике легко ориентироваться в выборе рациональной терапии с целью улучшения качества и прогноза жизни значительной части пациентов с СН.



