Дуоденитом называется заболевание двенадцатиперстной кишки (ДПК), в основе которого лежат патологические процессы воспалительно-дистрофического и дисрегенераторного характера, локализованные главным образом в ее слизистой оболочке [1–5]. Впервые патологический процесс в ДПК под названием «дуоденит» был описан Ф. Бруссе в начале XIX в. Дуоденит является одним из самых распространенных, если не самым распространенным, заболеванием ДПК, а вместе с гастритом – и всего желудочно-кишечного тракта. Частота регистрации дуоденита у взрослого населения составляет 19,4% [6], а среди заболеваний органов пищеварения – 30% [7].
Различают острый и хронический дуоденит. В общей структуре дуоденитов острый дуоденит встречается довольно редко (около 6% случаев), против 94% больных с явлениями хронического воспалительного процесса в ДПК. Среди больных диспепсическим синдромом морфологические признаки острого дуоденита выявляются у 1,5% обследованных, а хронического у 25,6% [8].
Предварительный диагноз дуоденита обычно ставится при наличии клинических проявлений болевого и диспепсического характера, подобных таковым при язвенной болезни ДПК, но без рентгенологических и эндоскопических признаков язвы. Диагноз изолированного дуоденита подтверждается морфологическими признаками воспалительной инфильтрации слизистой оболочки ДПК и отсутствием язвенного и прочих поражений органа. В целом по аналогии с гастритом дуоденит – это морфологическое понятие и его диагноз должен ставиться только после морфологического исследования [9]. На практике же обычно ограничиваются клинико-эндоскопическими данными, которые не совпадают с морфологическими на уровне 30% [10].
ДПК, подобно желудку, подвержена различным хроническим воспалительным состояниям. Корреляция результатов клинических, эндоскопических и гистологических исследований дуоденальных биоптатов полезна не только для диагностики воспалительных заболеваний ДПК пептической природы, но и для распознавания других воспалительно-дистрофических процессов. Это в первую очередь такие заболевания, как болезнь Крона, целиакия, а также некоторые инфекции, инвазии и пр. Главным классификационным принципом для данной патологии является понятие первичного и вторичного дуоденита. Причем доля вторичного дуоденита, по данным О.Н. Минушкина и соавт. (1991), значительно превышает таковую при первичном поражении ДПК (26,8 и 73,2% соответственно). Диагноз же первичного дуоденита, по сути, является диагнозом исключения хеликобактерного гастрита, язвенной болезни, аномалий развития ДПК, опухолевого процесса, поражения печени и желчновыводящих путей, поджелудочной железы и других заболеваний, вызывающих процессы воспаления в ДПК.
Существует также мнение, согласно которому изолированный (первичный) хронический дуоденит едва ли имеет место как отдельная нозологическая форма [12, 13], а является скорее синдромом, наблюдающимся при очень многих заболеваниях – и не только органов пищеварения. Вместе с тем, по последним данным, первичный неспецифический дуоденит как самостоятельное заболевание, по-видимому, имеет право на существование и тому приводятся довольно убедительные доказательства, которые будут рассмотрены ниже [14]. Вторичный же хронический дуоденит обычно рассматривается как сопутствующая патология или осложнение основного заболевания. В первую очередь хронический вторичный дуоденит наблюдается при язвенной болезни ДПК (до 95,7% случаев), гастрите, патологии поджелудочной железы, желчевыводящих путей, печени. Другой вопрос: как относиться к воспалительным изменениям в ДПК при патологии, привычно считаемой болезнями дистальных отделов кишечника? Как к вторичному процессу или как к основному проявлению? Например, при болезни Крона с локализацией в верхних отделах желудочно-кишечного тракта, в т.ч. в ДПК. Следует ли расценивать этот процесс как вторичное поражение или как стадию болезни? Данные последних исследований патологии тонкой кишки говорят в пользу того, что практически любой патологический процесс в тонкой кишке сопровождается поражением и ДПК в той или иной степени [15]. При этом разделение патологии кишечника по отделам, как и самой кишки, в большей степени условно и допустимо только для местных очаговых процессов.
Клиническое представление о дуодените как таковом стало четко вырисовываться после широкого внедрения эндоскопии с биопсией в диагностику патологии верхних отделов желудочно-кишечного тракта. Только после того, когда среди больных с типичной «язвенной» клинической картиной язвенный дефект обнаруживался лишь в 50% случаев, понятие дуоденита, введенного почти 200 лет назад и описанного G.E. Кonjetzny (1925, 1930), Р.А. Лурия (1929), стало приобретать новое значение.
Довольно трудно анализировать данные о частоте дуоденита среди другой патологии ДПК, и если отталкиваться только от эндоскопических признаков, то частота оказывается очень высокой. Так, по данным В.Г. Смагина и соавт. (1977), из 5000 эндоскопических исследований в 81% случаев был обнаружен дуоденит той или иной степени выраженности. С другой стороны, известно, что разные этиологические формы дуоденита могут иметь совершенно идентичную клинико-морфологическую картину. Причем такой универсальный ответ организма на различные воздействия выработан в процессе эволюции для сохранения вида и свойствен всему живому и растительному миру. В качестве примера можно привести любой как ассоциированный, так и не имеющий связи с H. pylori дуоденит. Связь первого с H. pylori отсутствует, второго доказана, оба реализуются в условиях кислотной агрессии и могут сопровождаться язвенно-подобной клиникой. По-видимому, при большом количестве разных этиологических факторов существуют общие патоморфологические механизмы их реализации, а это приводит к сходным клиническим проявлениям, что создает определенные трудности для назначения полноценной этиотропной терапии. В связи с этим важным фактором для осуществления качественного диагностического поиска является наличие рациональной классификации дуоденита.
Прежде чем перейти к классификации дуоденита, вернемся к некоторым вопросам эпидемиологии дуоденита. Так, дуоденитами в целом чаще (в 2,0–3,5 раза) страдают мужчины [16], что сходно с частотой язвенной болезни ДПК. Частота регистрации атрофических процессов в слизистой ДПК напрямую зависит от возраста пациентов (до 40% у больных после 70 лет) [17]. Но здесь необходимо различать закономерные инволюционные процессы и хронически текущие патологические состояния. Хронические воспалительные процессы (в морфологическом плане) обычно характерны для хронического дуоденита у молодых пациентов. Причем атрофические процессы при дуодените у юношей регистрируются главным образом в области луковицы ДПК (бульбит). В постбульбарном отделе кишки молодых мужчин с хроническим бульбитом атрофия, как правило, не регистрируется. Диффузный дуоденит у данной категории пациентов наблюдается в 50% случаев. У девушек, напротив, чаще обнаруживается диффузный дуоденит, а атрофия в постбульбарном отделе имеет место у каждой третьей пациентки с хроническим дуоденитом [18]. У взрослых женщин, обследованных по разным поводам, в 69,8% случаев обнаруживался хронический дуоденит. Пожалуй, можно согласиться с мнением Р.М. Филимонова (1990), согласно которому многое зависит от того, на фоне какой патологии выявляется дуоденит у мужчин и женщин. Так, если это вторичный процесс на фоне язвенной болезни, он чаще будет наблюдаться у мужчин, а если воспаление в ДПК развивается на фоне патологии желчевыводящих путей, то чаще у женщин. Этому не противоречат исследования Р.С. Богачева (1993), установившего путем 5-летнего наблюдения, что у 39% молодых женщин дуоденит сопровождается нарушениями моторной функции желчновыводящих путей (по результатам ультразвукового исследования). По нашим данным, такая взаимосвязь имеет место в основном для заболевших язвенной болезнью до 30 лет – это преимущественно мужчины, а среди заболевших язвенной болезнью после 30 лет женщины с мужчинами присутствуют на равных, как и явления вторичного дуоденита. В равной степени часто у заболевших язвенной болезнью после 30 лет мужчин и женщин наблюдается и сопутствующая патология желчевыводящих путей и поджелудочной железы.
До последнего времени общепринятая классификация дуоденита отсутствовала. Существовало очень много классификационных подходов и рациональных предложений по данной проблеме [19–21]. Прежде всего следует упомянуть, что данная патология ДПК в Международной классификации болезней 10-го пересмотра представлена несколькими рубриками:
- К.29. Гастрит и дуоденит;
- К.29.8. Дуоденит;
- К.29.9. Гастродуоденит неуточненный.
Однако данный рубрикатор лишь очерчивает самые общие контуры данной патологии, причем наиболее часто встречающиеся формы. Предполагается, что могут сосуществовать гастрит и дуоденит одновременно и это на самом деле очень часто имеет место при поражении желудка и ДПК H. pylori, причем главенствующая роль в данной сочетанной патологии – за желудком (хеликобактерный гастрит). Причем уместнее такую форму называть H. pylori-ассоциированным гастродуоденитом. Одновременно учитывается возможность и изолированного поражения ДПК.
Вообще понятие гастродуоденита чрезвычайно распространено, но здесь легко впасть в крайность и попытаться перенести все свойственное гастриту и на дуоденит. Чему есть примеры – классификация хронического дуоденита, предложенная в свое время И.И. Дегтяревой и Е.В. Родонежской (1989), построенная исключительно по гастритическому «досиднейскому» классификационному принципу. Компромиссным вариантом считается подход к проблеме хронического дуоденита с позиций Сиднейской системы, классификации хронического гастрита, принятой на IX Международном конгрессе гастроэнтерологов в 1990 г. с учетом некоторых вопросов, касающихся и поражения ДПК. В частности, не вызывает сомнений оправданность применения данной классификации для характеристики эндоскопически выявляемых признаков хронического дуоденита [22]. Такой подход, на наш взгляд, является наиболее рациональным в связи с чрезвычайно важным мнением эндоскописта о характере поражения органа по визуальным признакам после проведенной оценки клинических признаков, которые часто бывают неспецифичными.
Основываясь на визуально определяемых признаках, эндоскопически выделяют следующие формы хронического дуоденита:
- эритематозный (по признаку наличия гиперемии слизистой ДПК);
- геморрагический (при наличии геморрагических проявлений);
- атрофический (по признакам атрофии слизистой);
- эрозивный (при наличии поверхностных дефектов слизистой оболочки);
- узелковый (нодулярный, по наличию визуально регистрируемых фолликулярных образований.
Эритема (гиперемия, покраснение) слизистой ДПК может разделяться по яркости – от ярко-розовой до алой. Кроме того, гиперемия может быть очаговой (мелко- и крупноочаговой) и диффузной. Эритема является результатом шунтирования тока крови к верхушкам ворсинок под воздействием соляной кислоты.
Геморрагические проявления часто выглядят как точечные геморрагии в слизистой, кроме того, может отмечаться контактная кровоточивость слизистой при контакте с эндоскопом, кровоточащие эрозии.
Атрофия слизистой оболочки визуально проявляется ее истончением, причем важным признаком является визуализация подлежащей сосудистой сети. Слизистая имеет мелкопятнистый вид (на розовом фоне четко визуализируются серовато-белые участки округлой формы в виде углублений или втяжений с гладким дном и просвечивающими сосудами). Атрофия, так же как и гиперемия, может быть очаговой и диффузной.
Эрозивные дефекты слизистой оболочки – поверхностные дефекты слизистой. Могут быть единичными и множественными. Размеры эрозивных дефектов обычно бывают в пределах от 0,3 до 0,8 см. Наиболее часто эрозивные дефекты появляются при тяжелых формах воспаления в ДПК.
Фолликулы – беловатые узелки, чаще множественные, по типу «манной крупы» рассеянные по слизистой и имеющие размеры 0,2–0,3 см. Особенно часто фолликулы обнаруживаются в луковице ДПК.
Кроме перечисленных признаков, положенных в основу эндоскопических форм дуоденита, наблюдаются и общие признаки воспаления, характерные для всех форм. К таким проявлениям, в частности, относятся отек и набухание слизистой оболочки. Следует сказать, что эндоскопическая форма дуоденита – понятие довольно условное и квалифицируется по преобладающему признаку. Совершенно очевидно, что перечисленные визуальные особенности могут и довольно часто сочетаются друг с другом.
Кроме качественной оценки визуальных признаков поражения ДПК, представленных выше, выделяют выраженность поражения по степеням, площади поражения, ограниченности или тотальности, единичности или множественности. И здесь многие признаки часто используются совместно. Так, диффузная гиперемия, отечность, наличие эрозивных проявлений часто квалифицируются как резко выраженные явления дуоденита. Наиболее часто для квалификации выраженности воспалительных изменений в слизистой оболочке ДПК по данным эндоскопии применяется понятие активности воспаления.
Так, П.Я. Григорьевым (1986) для классифицирования степени активности сопутствующего язвенной болезни гастродуоденита предлагались следующие признаки:
- Активность I степени (умеренно выраженное воспаление):
- неравномерная отечность слизистой оболочки;
- участки гиперемии в виде пятен «пятнистая гиперемия»;
- наличие видимых слизистых наложений.
- Активность II степени (выраженное воспаление):
- диффузная отечность слизистой оболочки, ее рыхлость; складки становятся грубыми, высокими и широкими, тесно прилежат друг к другу;
- резкая, яркая, крупно-пятнистая гиперемия;
- наличие подслизистых геморрагий (чаще по типу мелких пурпур) и контактная кровоточивость с прибором;
- слизистая, местами покрыта налетами фибрина, клейкой слизью.
- Активность III степени (резко выраженное воспаление):
- диффузная отечность слизистой оболочки, ее рыхлость, складки грубые, высокие и широкие, тесно прилежат друг к другу;
- резкая, яркая, диффузная гиперемия;
- наличие подслизистых геморрагий (до крупных полей), контактная кровоточивость с прибором;
- слизистая, густо покрыта налетами фибрина, клейкой слизью; борозды между складками заполняются экссудатом и фибрином;
- наличие единичных или множественных эрозий.
Высокая степень активности, как правило, сочетается и с глубиной поражения стенки кишки. Эндоскопически о глубине поражения можно судить по тому, как быстро и равномерно расправляется кишка под действием вводимого в ее просвет воздуха во время эндоскопической процедуры. Так, если воспалительный процесс распространяется только на слизистую оболочку, то кишка легко расправляется воздухом, а перистальтика не изменяется. При вовлечении в процесс подслизистого и мышечного слоев кишка расправляется с трудом, просвет суживается, стенки могут быть деформироваными, а перистальтика не определяться. Выступающие складки слизистой оболочки ДПК могут соприкасаться своими вершинами, что придает в целом слизистой оболочке ДПК вид «зубчатого колеса».
Во время эндоскопических диагностических процедур, выполняемых методом хромодуоденоскопии, косвенно можно оценивать наличие и распространенность желудочной метаплазии слизистой ДПК. Метаплазированные участки слизистой не воспринимают краситель (метиленовый синий) и остаются неокрашенными. По данным указанной пробы выделяют отсутствие, слабую степень желудочной метаплазии – до 25% слизистой, умеренную – до 50% и выраженную – более 50% метаплазированной слизистой ДПК. Гистологически при умеренной и выраженной степенях желудочной метаплазии обнаруживается 100%-ная идентичность хромодуоденоскопическим данным.
По топографии и площади поражения выделяют:
- бульбит (проксимальный дуоденит);
- постбульбарный (дистальный дуоденит);
- локальный дуоденит (папиллит);
- диффузный дуоденит.
Следует сказать, что наиболее часто хронический дуоденит поражает именно проксимальный отдел ДПК, ее луковицу (бульбит), а в дистальном направлении воспалительные явления обычно равномерно снижаются. Однако это правило справедливо при условии, что ведущими причинами вторичного воспаления не являются патология системы желчно-выводящих путей и поджелудочной железы, дистальные аномалии ДПК, при которых наблюдается главным образом постбульбарный, дистальный дуодениты.
Поскольку термин «хронический дуоденит» является термином морфологическим, а эндоскопические признаки дуоденита только в 70% случаев совпадают, для точной верификации процесса в слизистой оболочке необходимо морфологическое исследование. Чаще всего для морфологической характеристики хронического дуоденита пользуются классификацией R. Whithead (1990):
- слабый дуоденит (1-я степень), характеризуется сохранностью структуры ДПК и поверхностного эпителия, в котором может быть увеличение количества межэпителиальных (интерэпителиальных) лимфоцитов, а в собственной пластинке слизистой оболочки обнаруживается выраженная лимфоплазмоцитарная инфильтрация, увеличивается количество лимфоидных фолликулов;
- умеренный дуоденит (2-я степень), характеризуется присоединением повреждения поверхностного эпителия, деформацией и укорочением ворсинок;
- тяжелый дуоденит (3-я степень), характеризуется выраженным укорочением ворсинок, углублением крипт, обильной лимфоплазмоцитарной инфильтрацией, часто сопровождается наличием эрозивных дефектов слизистой оболочки.
По глубине, степени дистрофических и атрофических процессов, распространения их в слизистой оболочке различают также:
- поверхностный хронический дуоденит (поражение только поверхностных слоев слизистой оболочки по типу дистрофии поверхностного эпителия, сопровождающегося уплощением призматических клеток и лимфоплазмоцитарной инфильтрацией);
- диффузный (интерстициальный) хронический дуоденит (поражение всей толщины слизистой, сопровождающееся кроме дистрофических изменений поверхностного эпителия отеком стромы, крово- и лимфостазом, выраженной лимфо-плазмоцитарной инфильтрацией, увеличением количества лимфоидных фолликулов);
- атрофический хронический дуоденит сопровождается дисрегенераторными изменениями, выражающимися истончением слизистой оболочки, уменьшением количества крипт, ворсинок, эпителия, в т.ч. и бокаловидных клеток, одновременно разрастается соединительная ткань как в собственном слое, так и в подслизистой основе. Строма обильно инфильтрирована нейтрофилами, эозинофилами, лимфоцитами, плазматическими клетками.
М.Р. Конорев и соавт. (2003) предлагают выделять:
- слабую степень атрофии (незначительная деформация и укорочение ворсинок);
- умеренную степень атрофии (деформация и укорочение ворсинок, углубление и уменьшение количества крипт, расширение их просвета, уменьшение количества бокаловидных клеток и клеток Панета);
- выраженную степень атрофии (выраженное укорочение ворсинок, на разных участках слизистой оболочки вместо ворсинок видны валикоподобные утолщения с гладкой поверхностью, между которыми располагаются широкие устья крипт. Одновременно отмечается резкое уменьшение количества бокаловидных клеток и клеток Панета).
Поверхностный дуоденит в отличие от атрофического дуоденита, как правило, обратимый процесс. При прогрессирующих процессах дистрофии и атрофии при хроническом дуодените меняется в целом рельеф слизистой оболочки ДПК: появляется много уплощенных ворсинок, наблюдается значительное преобладание листовидных и гребневидных пластинок над пальцевидными, складчатость уменьшается. Эпителий наряду с уплощением становится более базофильным с гиперхромными ядрами, с явлениями ядерной псевдомногослойности, щеточная каемка становится менее четкой, содержание межэпителиальных лимфоцитов увеличивается. Крипты удлинены, митотическая активность их эпителия усилена, ускоряется время миграции созревающих клеток на ворсинку, что увеличивает в их клеточном составе количество незрелых форм. Нейтрофилы обнаруживаются в криптах и выводных протоках бруннеровых желез. Могут отмечаться лимфоидная гиперплазия, расширение сосудов и отек [23].
По некоторым данным, успешная эрадикационная терапия, по-видимому, создает условия для восстановления нормальной слизистой желудка, во всяком случае в функциональном отношении [24]. Желудочная метаплазия ДПК может исчезнуть после эрадикации Н. pylori [25]. О наличии воспалительного процесса в слизистой судят по цитологической и гистологической реакции.
Оценивается лимфоплазмоцитарная инфильтрация в собственном слое слизистой оболочки (по М.Р. Конореву и соавт., 2003):
- слабая степень (равномерная рыхлая инфильтрация);
- умеренная степень (умеренно плотная инфильтрация);
- выраженная степень (очень плотная инфильтрация, наличие лимфоидных фолликулов).
О степени активности воспаления при хроническом дуодените (активный/неактивный) судят главным образом по характеру инфильтрации собственной пластинки слизистой оболочки ДПК, особенно эпителия, полиморфноядерными лейкоцитами.
Кроме того, учитывается количество нейтрофилов в собственном слое слизистой оболочки ДПК (по М.Р. Конореву и соавт., 2003):
- слабая степень (небольшое количество нейтрофилов без лейкопедеза в области ямок и апикальной части валиков);
- умеренная степень (умеренное количество нейтрофилов с умеренным лейкопедезом в области ямок и валиков);
- выраженная степень (обилие нейтрофилов с резко выраженным лейкопедезом и скоплением лейкоцитов с образованием «внутриямочных абсцессов»).
В инфильтрате слизистой ДПК при хроническом дуодените преобладают иммуноглобулины А (IgA). Обнаружена корреляция между количеством IgG, IgA и отеком слизистой оболочки, а также между IgG и наличием полиморфноядерных лейкоцитов в эпителии крипт. Возможно, лейкоциты могут участвовать в процессе повреждения эпителия ворсинок, приводя в конечном итоге к атрофии слизистой. Прогрессирование повреждения приводит к желудочной метаплазии и усугубляет атрофические процессы.
Желудочная метаплазия характеризуется замещением энтероцитов эпителием, сходным с поверхностным эпителием желудка. Следует различать гетеротопию и метаплазию. Врожденная желудочная гетеротопия в ДПК встречается как случайная находка среди 2% населения. Существует мнение, будто данная форма гетеротопии не имеет никакого отношения к пептическим заболеваниям и, вероятно, не имеет особого клинического значения. При врожденной гетеротопии участки перемещенного эпителия имеют париетальные и главные клетки, участки метаплазированного эпителия кишки в большинстве случаев таких клеток не имеют. Однако в биоптатах луковицы ДПК у некоторых пациентов с желудочной метаплазией также обнаруживают париетальные и изредка главные клетки. Данная форма метаплазии обычно сопутствует язвенному поражению ДПК. Имеются следующе данные: в 45% случаев резекций желудка по поводу дуоденальных язв выявляются случаи метаплазии, тогда как подобные результаты были отмечены только в 17% случаев резекций по поводу желудочных язв, большинство из которых были препилорическими [26]. И гетеротопия, и метаплазия желудочного эпителия в ДПК сопровождаются гиперсекрецией соляной кислоты в желудке. Более выражена метаплазия в луковице ДПК, особенно при выраженной и резко выраженной степенях хронического дуоденита. При тяжелом дуодените метаплазия регистрируется в 74%, а при умеренном – на уровне 36%. Как правило, желудочная метаплазия в ДПК бывает мелкоочаговой и замещает несколько эпителиоцитов на вершине ворсинок. Эпителий крипт подвергается метаплазии гораздо реже. Желудочная метаплазия не может быть идентифицирована эндоскопически, для ее подтверждения требуется биопсия. По Л.И. Аруину (1986), различают также полную желудочную метаплазию (включающую желудочные эндокриноциты) и неполную, в клеточный состав которой входят только клетки поверхностного эпителия желудка. Наиболее распространенная форма желудочной метаплазии – желудочная слизисто-клеточная метаплазия, при которой покровный эпителий ДПК заменен разновидностью желудочного эпителия, секретирующей слизь. Наличие желудочной метаплазии дает верный ключ к диагнозу пептического дуоденита. Решающим фактором, индуцирующим желудочную метаплазию, является фактор повышенного закисления в ДПК. Считается, что развитие желудочной метаплазии представляет собой адаптационный репаративный процесс слизистой ДПК к кислотно-пептическому фактору и может защищать от изъязвления, т.к. желудочный эпителий способен транспортировать ионы водорода из слизистой обратно в просвет кишки. Желудочная метаплазия связана со снижением активности щелочной фосфатазы кишечного эпителия, и эта особенность может помочь ее диагностировать [27].
Наиболее часто метаплазия затрагивает переднюю стенку проксимальной части ДПК. При выраженной кислотной желудочной гиперсекреции, сопровождающей синдром Золлингера–Эллисона, желудочные слизистые клетки могут простираться в дистальные отделы ДПК и тощую кишку. С другой стороны, желудочная метаплазия менее обширна у пациентов с язвенной болезнью желудка или раком желудка, а также при состояниях, часто сопровождаемых нормальным или низким уровнем кислотной желудочной секреции. Вместе с тем желудочная метаплазия представляет собой благоприятную почву для колонизации этих участков Н. pylori, развития ассоциированного с данными бактериями дуоденита и язвенного процесса в ДПК. Желудочная метаплазия наиболее выражена у пациентов с дуоденальной язвой, злостных курильщиков и у лиц мужского пола. Нередко желудочная метаплазия обнаруживается и у пациентов с функциональной диспепсией [28]. Кроме того, в 64% случаев очаги желудочной метаплазии также могут обнаруживаться и в отсутствие диспепсических симптомов у практически здоровых лиц.

Вне патологии бруннеровы железы наиболее многочисленны в луковице и проксимальной части ДПК, прогрессивно уменьшаются в размере и количестве в дистальном направлении. Аналогичное распределение сохранено у пациентов с желудочной гиперсекрецией и пептическим дуоденитом. Гиперплазия желез выражается в увеличении их количества и общего размера самой железы, что лучше всего представлено в луковице ДПК. Подобно желудочной метаплазии, гиперплазия бруннеровых желез более часто встречается у мужчин. Эндоскопически гиперплазированная железа имеет вид узелка на слизистой луковицы или, что реже, постбульбарной части ДПК. Узелки видны как единичные или множественные (диффузная гиперплазия бруннеровых желез) округлые или веретенообразные выпячивания от 0,2 до 1,5 см в диаметре. Гиперплазия может также иметь узловую форму. Иногда полипоидные образования достигают больших размеров и представляют угрозу обструкции просвета кишки. Редко узелки представлены в виде полипа на ножке. Пиковая кислотная продукция, как правило, значительно больше у пациентов с гиперплазией бруннеровых желез. Гистологически гиперплазия бруннеровых желез лучше видна в резецированных экземплярах, т.к. гиперплазированные железы преимущественно локализуются в подслизистом слое и не могут быть выделены целиком при обычной щипцовой биопсии. Однако рассеянные маленькие скопления ацинусов железы обычно расположены выше мышечного слоя слизистой оболочки, и они увеличиваются в количестве и размере, если есть гиперплазия бруннеровых желез. Это увеличение желез внутри слизистой оболочки позволяет выявлять гиперплазию и с помощью эндоскопической биопсии.
М.Р. Конорев и соавт. (2003) предлагают морфологически выделять следующие виды дуоденитов:
- неатрофические;
- атрофические;
- хеликобактерные;
- нодулярные;
- гранулематозные;
- эозинофильные;
- лимфоцитарные;
Так или иначе, хронические дуодениты, сопровождающиеся желудочной метаплазией (пептический, хеликобактерный дуоденит, язвенная болезнь ДПК) и другими специфическими морфологическими признаками, относят к отдельному виду специфических (особых) дуоденитов.
К характерным для них признакам относят:
- появление массы лимфоидных фолликулов (нодулярный дуоденит);
- гранулемы (болезнь Крона, туберкулез, саркоидоз, гранулематоз Вегенера, инородные тела, идиопатический гранулематоз);
- эозинофильную инфильтрацию (эозинофильный гастроэнтерит);
- гиперрегенераторные процессы на фоне лимфоцитарной инфильтрации (целиакия);
- наличие крупных PAS-положи-тельных макрофагов, инфильтрирующих собственную пластинку слизистой оболочки ДПК (болезнь Уиппла);
- признаки, характерные для лучевого поражения при радиационном дуодените, и другие признаки специфических поражений.
В свою очередь дуодениты, не отличающиеся ни этиологическими, ни морфологическими специфическими особенностями, носят название неспецифических, в т.ч. идиопатический изолированный первичный хронический дуоденит. Кроме того, дуодениты могут подразделяться на неатрофические, атрофические, проксимальные, дистальные и тотальные. Наиболее интересным, на наш взгляд, является классификационный подход к систематизации хронических дуоденитов, предложенный М.Р. Коноревым и соавт. в 1998 г. и существенно доработанный к 2003 г. Тем не менее некоторые его положения спорны, что безусловно объяснимо неясностью многих сторон самого понятия «дуоденит».
В первую очередь это касается варианта 1998 г. В классификации отсутствует упоминание о лучевом поражении кишечника, поражении при синдроме приобретенного иммунодефицита, общем вариабельном иммунодефиците и др. Конечно, можно спорить о том, первично или вторично то или иное поражение ДПК, но определение в этом вопросе облегчает назначение рациональной терапии заболевания. Если это вторичные нарушения, то успех лечения зависит от возможности излечения основной патологии, если это невозможно, то все усилия должны быть направлены на прерывание механизмов патогенеза поражения, защиту органа и коррекцию нарушенных функций. Если это первичный процесс, главнее – устранение прямого этиологического фактора. Можно спорить: что первично в хеликобактерном поражении ДПК – кислота или бактерия? Но на сегодняшний день совершенно очевидно, что кислота –лишь механизм поражения, условие, а H. pylori – причина. Да, влияя на кислотный фактор, мы добиваемся успеха, но временного, уничтожая бактерию, мы излечиваем больного. Также и с некоторыми другими патологическими процессами, например целиакией: исключение глютена – залог выздоровления.
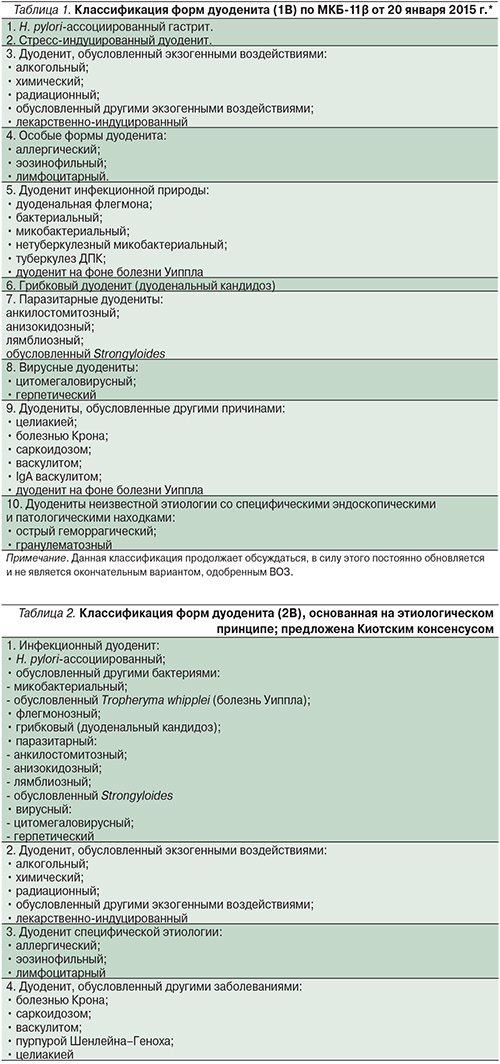
В начале раздела о классификации дуоденита мы оговорились, что общепринятой классификации до последнего времени не предлагалось. Так было до 2015 г., когда были опубликованы материалы Киотского консенсуса по хроническому гастриту и дуодениту [29]. Экспертным советом широко обсуждались вопросы, связанные с актуализацией текущих систем классификации хронического гастрита, дуоденита, анализом роли данной нозологической единицы в формировании и прогрессировании предраковых изменений слизистой оболочки желудка, а также с возможностями эрадикационной терапии в качестве метода канцеропревенции. Важно отметить, что Киотский консенсус является существенным вкладом экспертного сообщества гастроэнтерологов в модификацию Международной классификации болезней (МКБ). Как известно, международная конференция по Десятому пересмотру МКБ была проведена Всемирной организацией здравоохранения (ВОЗ) в Женеве в 1989 г. и была одобрена на 43-й сессии Всемирной Ассамблеи здравоохранения в 1990 г. Система МКБ-10 до сих пор является ведущей статистической и классификационной основой здравоохранения в мире. Однако в силу недостаточности данных об этиологической роли инфекции H. pylori на момент разработки данной системы форма гастрита, ассоциированная с данной инфекцией, не была включена в классификационную сетку.
Работа Киотского консенсуса является важным вкладом в совершенствование классификации форм дуоденита (1В) по МКБ-11β (табл. 1), которая в настоящее время продолжает активно обсуждаться. Экспертным советом Киотского консенсуса была предложена обновленная версия классификации дуоденитов, также базирующаяся на этиологическом факторе, однако структурированная по несколько другому принципу (табл. 2). Данная система также представляется актуальной, однако для ее внедрения в клиническую практику необходима широкая валидизация в различных странах мира.
К сожалению, в материалах консенсуса все ограничилось предложениями по новой классификации данной патологии, органически связанной с гастритом, в т.ч. ассоциированным с H. pylori, что, безусловно основываясь на ведущей роли хеликобактерной инфекции в этиологии хронического дуоденита, очень важно. Достаточно вспомнить, что именно H. pylori на фоне избыточного закисления в ДПК (пептического дуоденита) и последующей желудочной метаплазии, заселяя участки последней, является причиной ДПК-локализации язвы. Медикаментозное лечение хронического дуоденита определяется его этиологией и клиническим вариантом.
При язвенно-подобной форме хронического дуоденита, не ассоциированного с H. pylori и связанного с кислотно-пептической агрессией желудочного содержимого, назначается терапия антацидными, антисекреторными препаратами и их комбинациями. Среди антацидов наиболее широко применяются препараты, содержащие гидроокись алюминия и магния, и фосфат алюминия. Кроме того, фосфат алюминия обладает низкой токсичностью, связанной с выраженной способностью сопротивляться растворению и формированию нейтральных комплексов в присутствии пищевых кислот. Фосфат алюминия в отличие от гидроксида алюминия не приводит и к уменьшению уровня абсорбции фосфора из желудочно-кишечного тракта.
Важное место в терапии кислотозависимых заболеваний, и хронического гастродуоденита в частности, занимают препараты, содержащие висмута трикалия дицитрат (Де-Нол). Де-Нол, оказывающий цитопротективное и антихеликобактерное действие, нашел широкое применение в монотерапии кислотозависимой патологии желудка и ДПК, в частности терапии хронического гастродуоденита (см. рисунок).
Антациды быстро снимают такие симптомы, как висцеральный «ранний» и «поздний» болевой синдром, купируют изжогу, отрыжку кислым и горьким. Больным хроническим дуоденитом целесообразно назначать антациды через 1–3 часа после еды 3–4 раза в день и перед сном.
Одно из основных мест в лечении всех кислотозависимых заболеваний и хронического дуоденита на фоне сохраненной и повышенной продукции соляной кислоты, занимают антисекреторные препараты [30]. К ним относятся в первую очередь ингибиторы протонной помпы (ИПП) – последнее поколение антисекреторных средств, которые действуют непосредственно на протонную помпу париетальной клетки, ингибируя ее. Препараты этой группы блокируют фермент Н+К+-АТФазу, ковалентно связываясь с SН-группами β-субъединиц протонного насоса желудка и реализуя выраженный антисекреторный эффект, независимо от природы кислотостимулирующего фактора [31]. На сегодняшний день существует несколько поколений препаратов этой группы. Наиболее распространены омепразол, рабепразол и эзомепразол.
В настоящее время антихеликобактерная терапия считается основным стандартом лечения ассоциированных с H. pylori заболеваний, что отражено в международных (I–V Маастрихтские соглашения) и Российских рекомендациях по лечению гастроэнтерологических больных. К такой патологии относятся хеликобактерный первичный хронический дуоденит, гастродуоденит, а также вторичный дуоденит на фоне хеликобактерного гастрита, язвы желудка и ДПК. В целом цели лечения при наличии H. pylori-ассоциированного хронического дуоденита не отличаются от таковых при язвенной болезни ДПК и других ассоциированных с H. pylori заболеваний. При этом следует обратить внимание на то, что обследование и лечение больных хеликобактерным дуоденитом (гастродуоденитом) в отсутствие осложнений следует проводить в амбулаторно-поликлинических условиях.
В настоящее время для амбулаторной практики рекомендуются различные эффективные схемы эрадикации инфекции H. pylori в условиях растущей резистентности к основным компонентам классической тройной терапии. Последнюю, применяемую эмпирически, возможно использовать только в регионах с подтвержденной низкой резистентностью к кларитромицину (≤15%) – ИПП в двойной дозе 2 раза в сутки+кларитромицин внутрь 0,5 г 2 раза в сутки или джозамицин внутрь 1,0 г 2 раза в сутки+амоксициллин внутрь 1,0 г 2 раза в сутки. Во всех остальных случаях следует ориентироваться на рекомендации, предложенные МОО «Альянс клинических химиотерапевтов и микробиологов», разработанные на основании последних консенсусов по проблеме хеликобактерной инфекции (Киот-ский консенсус, Маастрихт-IV–V, V Московское соглашение и др.). В первую очередь это классическая квадротерапия с препаратом висмута (Де-Нол) (ИПП в двойной дозе 2 раза в сутки+висмута трикалия дицитрат 0,12 г 4 раза в сутки+метронидазол внутрь 0,5 г 3 раза в сутки+тетрациклин внутрь 0,5 г 4 раза в сутки. Как вариант: ИПП в двойной дозе 1–2 раза в сутки+кларитромицин внутрь 0,5 г 2 раза в сутки или джозамицин внутрь 1,0 г 2 раза в сутки+амоксициллин внутрь 1,0 г 2 раза в сутки+висмута трикалия дицитрат 0,12 г 4 раза в сут-ки). Все схемы назначаются на срок 10–14 дней.
Предпочтение следует отдавать препаратам последних поколений ИПП в дозировках соответственно инструкциям к препаратам.
Включение препаратов висмута (висмута трикалия дицитрата) в состав схем эрадикации является одним из наиболее эффективных и доступных способов оптимизации лечения инфекции H. pylori в эпоху растущей резистентности [32, 33]. Важно отметить, что висмут представляет собой единственное антихеликобактерное средство, к которому не было отмечено формирования резистентности. Стоит заметить, что висмут рассматривается как перспективное средство для преодоления резистентности H. pylori к антибиотикам. Интересны результаты исследовании Q. Sun и соавт. (2010), продемонстрировавшие повышение эффективности эрадикации на 15,4% и потенциальное преодоление резистентности H. pylori к кларитромицину [34]. Помимо этого при лечении больных заболеваниями, ассоциированными с Н. pylori, включение препарата висмута повышает клинико-экономическую эффективность эрадикационной терапии [35].
Успех лечения вторичного дуоденита зависит в первую очередь от лечения основного заболевания и факторов, которые его вызвали. Вместе с тем своевременная коррекция вторичных моторных и секреторных расстройств ДПК приводит к более быстрому и полноценному восстановлению или поддержанию ее функций. Таким образом, рассматривая проблему через призму хронического воспаления в ДПК, можно видеть, как многообразна и вместе с тем универсальна ответная реакция организма на множество повреждающих агрессивных агентов внешней и внутренней среды. Во многом едины и пути их коррекции.
Таких путей три:
- влияние на причину;
- разрыв болезнетворного механизма;
- компенсация утраченных функций.
Чем раньше будет начато лечение, тем быстрее и качественнее пойдет процесс выздоровления, улучшение качества жизни больного, возвращение его к полноценной деятельности.



