Введение
Гастроэзофагеальная болезнь (ГЭРБ) считается одним из самых распространенных гастроэнтерологических заболеваний во всем мире [1–3]. Возрастающая частота ГЭРБ и в развивающихся, и в развитых странах остается глобальной медицинской проблемой. Различные состояния, такие как ожирение, аксиальная грыжа, несостоятельность нижнего пищеводного сфинктера (НПС), преходящие релаксации НПС, повышенная кислотопродукция желудка, увеличение интрагастрального давления и пролонгация пищеводной кислотной экспозиции, служат фактором риска развития ГЭРБ [4, 5]. Однако механизмы ГЭРБ остаются не полностью выясненными [1, 6], а симптомы ГЭРБ не всегда связаны с наличием или отсутствием эрозивного эзофагита [7]. Приблизительно у 35% [8] и даже у 50% пациентов эрозивный эзофагит протекает бессимптомно [9]. Остается неполностью выясненной связь между инфекцией Helicobacter pylori и ГЭРБ. Имеются предположения как о патогенной [10], так и о протективной роли H. рylori в генезе ГЭРБ [11], подтвержденные не всеми исследователями [12].
Исходя из того, что примерно у 75% населения старше 40 лет выявляются два и более заболевания, протекающих одновременно [13], возникает вопрос о функционально-морфологических связях между выраженностью гастрита и дуоденита по гистологическим признакам и стадией ГЭРБ при коморбидности с такими кислотозависимыми заболеваниями, как язвенная болезнь двенадцатиперстной кишки (ЯБДПК) и язвенная болезнь желудка (ЯБЖ), включая и период после эрадикации H. рylori [10, 14].
Цель исследования: выявление связей между патогистологическими критериями выраженности гастрита и дуоденита, и стадией ГЭРБ, коморбидной с другой кислотозависимой патологией, и дополнительное определение моторно-секреторных изменений гастродуоденального (ГД) комплекса для выявления мишеней лечебно-профилактических воздействий.
Методы
Дизайн – исследование серии случаев. Оценка результатов была проведена в отношении 305 больных в возрасте от 18 до 69 лет (224 мужчины и 81 женщина, средний возраст – 42,6±0,8 и 42,8±1,3 года соответственно). Критерием включения в исследование стало наличие гастроэзофагеального рефлюкса (ГЭР), который подтверждался жалобами на изжогу и/или регургитацию соляной кислоты с частотой не меньше 1 раза в неделю [15] у больных ЯБДК и ЯБЖ в стадии ремиссии и хроническим панкреатитом. Критерии исключения: возраст старше 80 лет, наличие инфекционной, сердечно-сосудистой, эндокринной и онкологичской патологий, а также беременности.
Обследование пациентов, обратившихся за консультативной помощью с 2012 по 2017 г., проведено амбулаторно, а также в условиях стационара на базе клиники кафедры хирургии № 3 Кубанского государственного медицинского университета. Помимо общеклинического, лабораторных и инструментальных методов обследования, включая проведение максимального пентагастринового теста, все пациенты подверглись эзофагогастродуоденоскопии (ЭГДС) со взятием биоптатов из СО двенадцатиперстной кишки (ДПК), антрального отдела желудка (АОЖ) и тела (фундального отдела) желудка (ФОЖ) для гистологического, морфометрического исследований и определения инфицированности H. pylori, а также эндоскопической манометрографии методом открытого постоянно перфузируемого катетера. Во время ЭГДС, исходя из 2-го пересмотра Лос-Анджелесской классификации, определяли следующие степени состояния СО пищевода: N – отсутствие изменений; M – минимальные изменения; А – одна или более эрозий <5 мм; В – одна или более эрозий >5 мм; С – больше одной эрозии, распространяющейся за пределы двух складок; D – эрозии располагаются на всей окружности пищевода [16]. Изменения СО пищевода N–M-степеней относили к неэрозивной язвенной болезни (НЭРБ); рефлюкс-эзофагит A–D-степеней – к ГЭРБ. Морфологическое состояние ГД СО оценивали в срезах, окрашенных гематоксилином и эозином с раздельной оценкой (0–3-й степеней выраженности в баллах) воспалительной (мононуклеарной) инфильтрации, кишечной (или желудочной) метаплазии и железистой атрофии. Инфицированность H. pylori определяли в препаратах, окрашенных по Гимзе, выделяя 3 степени обсемененности: 1) слабую, до 20 микробных тел в поле зрения (п/з); 2) среднюю, 20–50 микробных тел в п/з; 3) сильную, более 50 микробных тел в п/з. Эндоскопическая манометрография (регистрацию полостного давления – Р в ДПК, пилорическом канале, АОЖ, теле желудка, в НПС и пищеводе) выполнена методом открытого постоянно перфузируемого катетера (после аспирации воздуха из желудка), последовательно протягивая его со скоростью не более 1 cм/с из ДПК в пищевод с задержками в сегментах максимальной активности привратника и НПС. Секреторную деятельность желудка изучали зондовым способом в межпищеварительном периоде (базальная выработка кислоты – БВК) и в ответ на максимальную стимуляцию (пиковая выработка кислоты – ПВК) пентагастрином (6 мкг/кг, п/к).
Для проведения дифференциальной межэтиологической диагностики морфологических и функциональных ГД-изменений в зависимости от стадии ГЭРБ были сформированы отдельные подгруппы, сопоставимые по полу и возрасту: пациенты с ЯБДПК и ЯБЖ, а также с коморбидной ГЭРБ смешанного генеза. От участников исследования было получено письменное информированное согласие, а также согласие на обработку персональных данных.
Статистическую обработку проводили, используя программы MS Excel 10 и Wizard-Statistics (США) с предварительной оценкой правильности математического распределения в соответствующих выборках (критерий Колмогорова). При нормальном распределении в сравниваемых группах использовали критерий Стьюдента (t-критерий) с представлением данных в виде среднего значения (Х), стандартной ошибки среднего значения (m) и указаний статистически значимого уровня p<0,05. В выборках с неправильным распределением использовали χ2-критерий, критерии Крускалла–Уоллиса, Манна–Уитни. Анализ корреляционных зависимостей проводили с расчетом коэффициентов корреляции по Пирсону или Спирмену, а дисперсионный анализ – однофакторным методом ANOVA.
Результаты
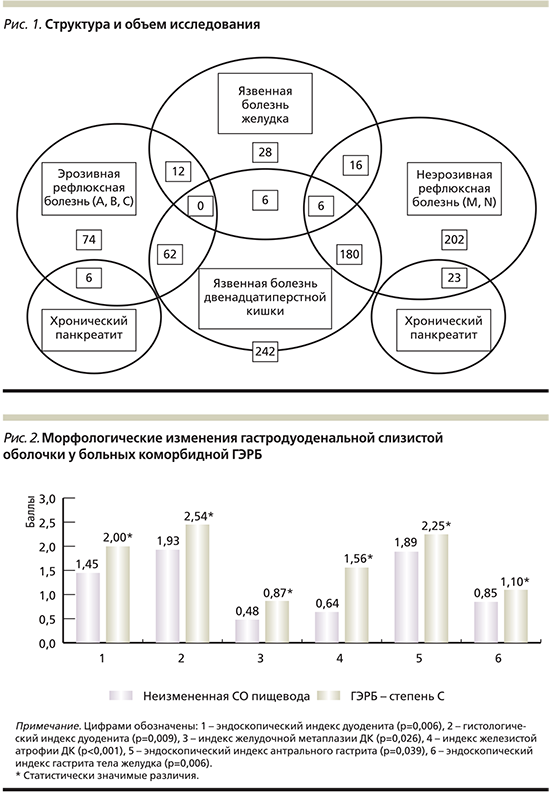
В структуру обследуемой когорты вошли 305 пациентов, имевших следующие коморбидные заболевания (с разной степенью эзофагита): 62 – ГЭРБ и ЯБДПК (А – 42, В – 7, С – 13), 12 – ГЭРБ и ЯБЖ (А – 8, В – 2, С – 2) и 6 – ГЭРБ и хронический панкреатит (А – 3, В – 3); среди пациентов с N- и M-степенями НЭРБ были 180 больных ЯБДПК (N – 111; M – 69), 16 – ЯБЖ (N – 9; M – 7), 6 – сочетанием ЯБДПК и ЯБЖ (N – 3; M – 3) и 23 – хроническим панкреатитом (N – 9; M – 14) (рис. 1).
Необходимо отметить, что выявленный нами параллелизм между степенями воспаления (в баллах) ГД СО по эндоскопическим данным и результатам гистологических заключений подтверждался прямой корреляцией (коэффициент Пирсона и t-критерий соответственно) между следующими диагностическими критериями:
а) выраженность дуоденита по эндоскопическим данным и такими гистологическими критериями, как инфильтрация (p<0,001; p<0,001), желудочная метаплазия (p<0,001, p<0,001) и атрофия ДПК (p<0,001, p<0,001);
б) выраженность антрального гастрита по эндоскопическим данным и по таким гистологическим данным, как инфильтрация (p=0,006, p=0,019) и атрофия АОЖ (p<0,001, p<0,001);
в) степень гастрита тела желудка по эндоскопическим данным и выраженности воспалительной инфильтрации (p<0,001, p<0,001), кишечной метаплазии (p<0,001) и атрофии СО (p<0,001).
Далее оказалось, что у больных с различной степенью поражения СО пищевода (N – 138, M – 87, A – 56, B – 8 и C – 16 человек) степень инфицированности H. pylori в СО ДПК, АОЖ и тела желудка не обнаружила статистически значимых различий. Необходимо отметить, что в большинстве исследований не было выявлено причинной взаимосвязи и прямой корреляции между инфекцией H. pylori и ГЭРБ [18, 19].
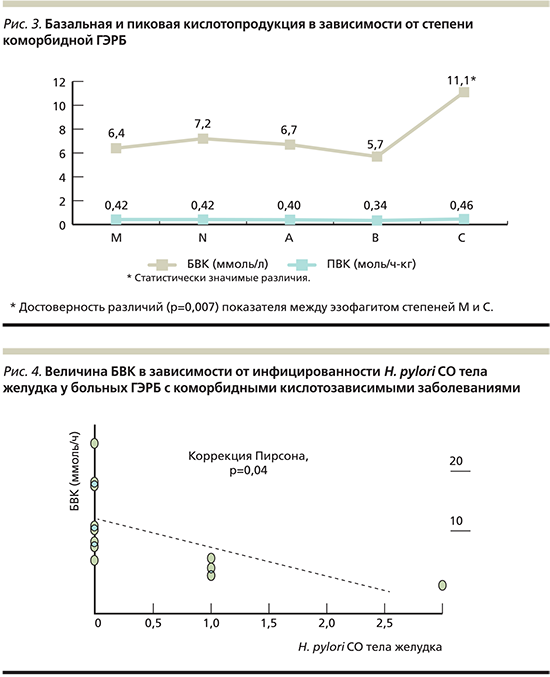
Проведенный нами анализ показал, что по сравнению с пациентами с N-степенью НЭРБ только у пациентов с С-степенью ГЭРБ имелись статистически значимые различия в выраженности:
- гастрита тела желудка;
- антрального гастрита по эндоскопическим признакам;
- дуоденита по эндоскопическим;
- гистологическим данным за счет преобладания желудочной метаплазии и желудочной атрофии (рис. 2).
Таким образом, при выраженном рефлюкс-эзофагите степени С воспалительные изменения проявлялись в луковице ДПК в более выраженной степени, чем в АОЖ и теле желудка. По нашим данным, только при ГЭРБ степени С величина межпищеварительной БВК достигала статистически значимых различий по сравнению с величинами БВК у пациентов с М- и N-степенями НЭРБ и A- и B-степенями ГЭРБ (рис. 3).
Нами выявлена обратная корреляция между величиной БВК и H. pylori инфицированностью тела желудка (t-тест; р=0,021). При этом инфекция H. pylori в СО тела желудка по сравнению с ее отсутствием сопровождалась меньшей величиной БВК (рис. 4). Однако при сравнении коморбидных групп больных – ГЭРБ и ЯБДПК (1-я группа) и ГЭРБ и ЯБЖ (2-я группа) оказалось, что несмотря на значимое повышение БВК у пациентов 1-й группы (8,34±0,43 против 3,47±0,54 ммоль/ч; р<0,001), степени рефлюкс-эзофагита (0,48±0,03 против 0,56±0,07 балла) и Рнпс (15,4±0,72 против 14,7±1,79 мм рт.ст.) были статистически неразличимы.
По нашим данным, внутри группы с коморбидной ГЭРБ при сравнении подгрупп больных ЯБДК и ЯБЖ оказалось, что при ЯБЖ более выражены патогистологические изменения СО тела желудка, а при ЯБДПК – СО ДПК (рис. 5).

Сравнительный анализ выявил статистически значимую прямую корреляцию (коэффициент Пирсона и χ²-критерий соответственно) между степенью эзофагита (в баллах) по данным эзофагоскопии и выраженности (в баллах) следующих ГД морфологических изменений:
- дуоденита (по эндоскопическому, [р<0,001] и гистологическому индексам [p=0,018], преимущественно за счет выраженности атрофии СО ДПК; p=0,001);
- антрального гастрита (по эндоскопическому [p=0,019] и гистологическому индексам, χ²-критерию; p=0,005, за счет более выраженной воспалительной инфильтрации χ²; p=0,046);
- гастрита тела желудка по эндоскопическому индексу (коэффициент Пирсона [р<0,001], χ²-критерий, p<0,001, и индексу воспалительной инфильтрации СО, χ²-критерий; p=0,021).
Более того, нами обнаружена статистически значимая прямая корреляция, подтверждающая ассоциативные связи между различными гистологическими изменениями СО в каждом из органов ГД-комплекса:
- В ДПК между HP-инфекцией, с одной стороны, и желудочной метаплазией и воспалительной инфильтрацией СО, с другой (коэффициент Пирсона; p=0,001; t-критерий; p=0,001); между желудочной метаплазией и атрофией СО (коэффициент Пирсона, p<0,001; t-критерий, p<0,001; Манна–Уитни, p<0,001), а также между желудочной метаплазией и инфильтрацией СО (коэффициент Пирсона, p<0,001, t-критерий, p<0,001, Манна–Уитни, p<0,001), между желудочной атрофией и инфильтрацией СО (коэффициент Пирсона, p<0,001; ANOVA, p<0,001, Крускалла–Уоллиса, p<0,001);
- В АОЖ между кишечной метаплазией и атрофией СО (коэффициент Пирсона, p=0,016), а также между атрофией и воспалительной инфильтрацией СО (коэффициент Пирсона, p<0,001; ANOVA, p<0,001; Крускалла–Уоллиса, p< 0,001);
- В ФОЖ между кишечной метаплазией и атрофией СО (коэффициент Пирсона, p<0,001; t-критерий, p<0,001; Манна–Уитни, p<0,001), с каждой из которых имелась прямая корреляция, соответственно, с инфильтрацией СО (коэффициент Пирсона, p<0,001; t-критерий, p=0,044) и (коэффициент Пирсона, p<0,001; t-критерий, p<0,001; Манна–Уитни; p<0,001).
Далее оказалось, что у 145 больных ГЭРБ коморбидной с кислотозависимыми заболеваниями мы не выявили статистически значимых различий абсолютных величин градиента давления ΔРНПС-ФОЖ при разных степенях поражения СО пищевода. Однако в разных отделах эзофагогастродуоденальной зоны было выявлено синергичное однонаправленное повышение полостного давления, подтвержденное прямой положительной корреляцией между РДК и РАОЖ (коэффициент Пирсона, p<0,001; ANOVA, p=0,001; тест Крускалла–Уоллиса, p<0,001), РАОЖ и РФОЖ (коэффициент Пирсона, p<0,001; ANOVA, p<0,001; тест Крускалла–Уоллиса, p<0,001), РФОЖ и РНПС (коэффициент Пирсона, p<0,001; тест Крускалла–Уоллиса, p<0,001). Более того, между повышением Р в дистальных отделах ГД-зоны и Р в НПС была определена статистически значимая прямая корреляция (РАОЖ-РНПС – коэффициент Пирсона, p<0,001; тест Крускалла–Уоллиса, p<0,043 и РДК–РНПС –коэффициент Пирсона, p<0,001; ANOVA, p<0,013; тест Крускалла–Уоллиса, p<0,004).
При этом была отмечена прямая корреляция между величиной давления в НПС и степенями воспалительной клеточной инфильтрации (критерий Колмогорова, p=0,002; коэффициент Пирсона, p<0,002; коэффициент Спирмена, p<0,001; тест Крускалла–Уоллиса, p=0,001), а также атрофии СО ДПК (критерий Колмогорова, p=0,011; коэффициент Пирсона, p<0,001; ANOVA, p=0,039, тест Крускалла–Уоллиса, p<0,001).
Обсуждение
ГЭРБ является полиэтиологическим заболеванием с чрезвычайно сложными патофизиологическими многофакторными взаимодействиями. Наши данные о превалирующей частоте больных НЭРБ (73,7%) по сравнению с ГЭРБ (26,3%) совпадают с результатами авторитетных исследований (67,9 и 32,8% соответственно) [17]. Исходя из выявленного нами параллелизма в оценках (в баллах) между степенями воспаления ГД СО по эндоскопическим и гистологическим критериям, можно полагать корректным клиническое применение эндоскопической балльной оценки выраженности воспаления ГД СО у пациентов с разной стадией ГЭРБ, предваряющей более точную балльную гистологическую диагностику.
Необходимо отметить, что в большинстве исследований, так же как и в нашем, не было выявлено причинной взаимосвязи и прямой корреляции между инфекцией H. pylori и стадией ГЭРБ [18, 19]. Вызывают интерес наши данные о более выраженных воспалительных изменениях в луковице ДПК по сравнению с АОЖ и телом желудка при рефлюкс-эзофагите степени С по сравнению с N-степенью НЭРБ. Последнее можно объяснить повышенной секрецией НСl с периодами закисления луковицы ДПК. Исходя из данных литературы, можно полагать, что у пациентов с выраженной стадией ГЭРБ нарушается последовательный потенциально протективный физиологический гомеостаз, состоящий в том, что пищевод может сигнализировать желудку изменять секрецию НСl и бикарбонатов [20]. Этот механизм подтвержден тем, что у здоровых людей инфузия НСl в пищевод редуцирует желудочную кислотопродукцию [20, 21].
Небезынтересно, что в нашей работе наличие инфекции H. pylori в СО тела желудка по сравнению с ее отсутствием сопровождалось меньшей величиной БВК, что могло минимизировать риск развития ГЭРБ. Наши данные не противоречат научным исследованиям, которые гласят, что H. pylori в теле желудка продуцирует протеины, транзиторно ингибирующие секрецию HCl [23], а результатом успешной эрадикации может быть повышение секреции НСl [22] и транзиторное возникновение «легких форм ГЭРБ» [24], т.е. НЭРБ. По данным авторитетных исследований, инфекция H. pylori у больных ЯБЖ сопровождается гастритом тела желудка с понижением секреции НСl, а у пациентов с ЯБДК манифестируется преимущественно антральным гастритом, который провоцирует увеличение секреции НСl [22]. Более того, при ГЭРБ часто выявлялся антральный гастрит (35,2%) легкой или средней степени, и его выраженность коррелировала со стадией ГЭРБ (p<0,01) [17]. Однако в этих исследованиях не изучалась коморбидная ГЭРБ, при которой, по нашим данным, при синтропии с ЯБЖ более выражен гастрит тела желудка, а при синтропии с ЯБДПК – дуоденит.
Что касается стадии коморбидной ГЭРБ, то, по нашим данным, степень эзофагита сопрягалась с выраженностью воспалительных изменений в каждом из отделов ГД СО, что необходимо учитывать при лечении ГЭРБ. Более того, между отдельными субстратами воспаления в каждом из сегментов ГД СО определялась статистически значимая положительная корреляция. Гистологические исследования показали, что после эрадикации H. pylori достоверное уменьшение атрофии и интестинальной метаплазии СО желудка подтверждалось по прошествии 10 лет [24, 25]. Это нацеливает на длительное наблюдение и превентивную терапию соответствующих патогистологических изменений.
Выявленное нами синергичное однонаправленное повышение полостного давления во всех отделах эзофагогастродуоденальной зоны сопрягается с данными литературы, согласно которым длительная контрактильность пищевода может провоцировать симптомы ГЭРБ [7]. Более того, обнаруженная в исследовании прямая корреляция между величиной давления в НПС и степенями воспалительной инфильтрации и атрофии СО ДПК предполагает, что дуоденит с атрофией СО, а не только хронический атрофический гастрит [7], может провоцировать нарушение гастродуоденальной моторики и гиперчувствительность СО пищевода.
В целом полученные результаты указывают на возможные мишени терапевтических воздействий в различных отделах ГД-комплекса.
Заключение
Среди больных ГЭРБ c коморбидными кислотозависимыми заболеваниями преобладали лица с НЭРБ. Сопутствующие эзофагиту значимые эндоскопические и гистологические изменения СО ДПК, АОЖ и тела желудка, равно как и повышенная межпищеварительная секреция кислоты, регистрировались только при С-стадии ГЭРБ по сравнению с M- и N-степенями изменений эзофагеальной СО. При этом наличие сочетанных метаплазии и атрофии в ДПК, АОЖ и в теле желудка как у пациентов с инфицированностью H. pylori, так и без инфицированности H. pylori сопровождалось нарушениями секреции НСl, ГД просветного давления и тонуса НПС не только при ГЭРБ, но и при НЭРБ. Таким образом, синтропические патогистологические изменения в каждом из отделов ГД СО имели определенную сопряженность с выраженностью ГЭРБ, коморбидной с кислотозависимыми заболеваниями. Исходя из конкретной коморбидной ситуации, пациент-ориентированное лечение больных ГЭРБ и НЭРБ должно предусматривать вероятную цитопротективную терапию [4], нацеленную на минимизацию, доказано обратимой атрофии и сопутствующей ей кишечной метаплазии СО желудка [25], являющуюся по сути онкопревентивной.



