На протяжении многих лет парадигма терапии гормонопозитивного (ГР+) HER2-негативного метастатического рака молочной железы (мРМЖ) оставалась неизменной. Вот уже более 15 лет (около 10 лет в мире и только 5 – в России) общепризнанным считается, что у больных люминальным HER2-негативным мРМЖ без висцерального криза стандартным вариантом первой линии лечения является эндокринотерапия (ЭТ). При этом вариант ЭТ (тамоксифен или ингибитор ароматазы) не столь существен в связи с тем, что отсутствуют различия в общей выживаемости (ОВ), а различия в выживаемости без прогрессирования (ВБП) не столь значимы в абсолютном выражении (табл. 1).
Исходя из данных последних исследований, доложенных на конференциях 2016 г. и послуживших существенным изменениям рекомендаций ASCO (American Society of Clinical Oncology), эта «стабильная» ситуация с эффективностью ЭТ в качестве первой линии лечения ГР+ мРМЖ в ближайшее время будет значительно изменена. Безусловно, факт того, что люминальный РМЖ является медленно прогрессирующей индолентной болезнью и при сопоставимой длительности ОВ предпочтение в первой линии должно отдаваться агентам с наилучшей переносимостью, остается неизменным.
А вот появление новых данных об эффективности в первой линии гормонопозитивного HER2-негативного мРМЖ ингибиторов циклин-зависимой киназы и фулвестранта, похоже, приводит к изменению пейзажа препаратов, предпочтительных для первой линии. Зачинщиками изменений подхода к выбору препаратов первой линии явились ингибиторы циклин-зависимой киназы, выигрыш в ВБП для которых по сравнению с ранее существовавшим стандартом – ингибитором ароматазы – оказался столь велик, что их комбинация с ингибитором ароматазы была зарегистрирована уже по результатам исследования 2-й фазы (различия медианы ВБП составили 10 месяцев: 20,2 и 10,2 месяца соответственно, отношение рисков – ОР=0,49; р=0,0004) [5].

Третья фаза исследования [6] подтвердила, что магнитуда выигрыша ВБП при использовании комбинации ингибитора циклин-зависимой киназы с летрозолом сопоставима с результатами 2-й фазы (медиана ВБП для комбинации составила 24,8 месяца по сравнению с 14,5 в группе монотерапии летрозолом, ОР=0,58; p<0,0001). Однако все же необходимо отметить, что токсичность данной комбинации отлична от таковой «чистой» гормонотерапии. Эти больные требуют тщательного мониторинга и так или иначе имеют серьезные побочные эффекты. В свете отсутствия данных об увеличении ОВ в регистрационном исследовании 2-й фазы и незрелости данных по ОВ в исследовании 3-й фазы, с нашей точки зрения, выигрыш ВБП должен соотноситься с потенциальными рисками токсичности проводимой терапии.
Нам представляется, что оптимальное место для данной комбинации – это пациентки с большим объемом болезни, но без признаков висцерального криза, больные, у которых прогрессирование болезни отмечено на фоне адъювантной ЭТ, и другие группы пациенток, которым раньше в качестве наиболее вероятной опции первой линии лечения рассматривалась бы химиотерапия.
Другим препаратом, существенно изменившим представление, а в этом году и рекомендации ASCO, об ЭТ гормоно-положительном распространенном РМЖ, оказался фулвестрант – селективный антиэстроген, приводящий к деградации рецепторов эстрогенов.
До последнего времени фулвестрант был показан к терапии женщин в постменопаузе с ГР+ HER2-негативным мРМЖ в качестве второй или третьей линии лечения после неэффективности антиэстрогенов. Так, в исследованиях 20/21 (NCT00635713) было продемонстрировано, что фулвестрант в дозе 250 мг имеет эффективность, сопоставимую с таковой при терапии этой подгруппы больных анастрозолом [7, 8], в исследовании EFFECT (NCT00065325) – при терапии экземестаном [9].
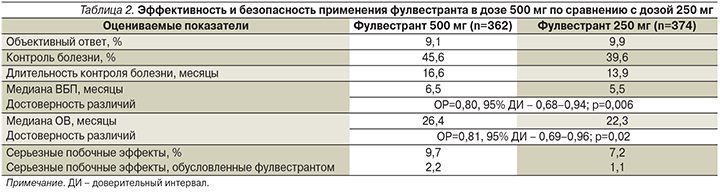
Начиная с 2010 г. на основании результатов исследования CONFIRM эффективной терапевтической дозой фулвестранта стала доза 500 мг. В этом двойном слепом рандомизированном исследовании 3-й фазы было продемонстрировано достоверное преимущество дозы фулвестранта 500 мг по сравнению с ранее применяемой дозой 250 мг в отношении как времени без прогрессирования, так и ОВ при сопоставимой переносимости (табл. 2) [10, 11].
Первое подтверждение большей эффективности фулвестранта в дозе 500 мг по сравнению с многолетним стандартом первой линии – ингибитором ароматазы анастрозолом – было получено в исследовании 2-й фазы FIRST. Анализ результатов показал, что при сопоставимой непосредственной эффективности (72,5% при терапии фулвестрантом и 67,0% при терапии анастрозолом; отношение шансов [ОШ]=1,3, 95% ДИ – 0,72–2,38; p=0,386) [12] медиана времени без прогрессирования была достоверно выше в группе терапии фулвестрантом: 23,4 месяца в группе терапии фулвестрантом и 13,1 – в группе терапии анастрозолом (ОР=0,66, 95% ДИ – 0,47–0,92; p=0,01) [13]. Несмотря на то что оценка ОВ не являлась первичной целью исследования, различия также оказались достоверными в пользу группы больных, получавших фулвестрант в качестве первой линии ЭТ распространенного РМЖ: 54,1 и 48,4 месяца соответственно (ОР=0,70, 95% ДИ – 0,50–0,98; p=0,04) [14]. Значимо бóльшие различия в пользу фулвестранта были продемонстрированы у пациентов с невисцеральным поражением и ранее не получавших ЭТ в нео- и/или адъювантном режиме. Как и в предыдущих исследованиях была подтверждена хорошая переносимость лечения при использовании фулвестранта в дозе 500 мг.
Финальным аккордом, подтвердившим, что возможности «чистой» ЭТ в первой линии лечения метастатической болезни далеко не исчерпаны и болезнь может продолжительное время адекватно контролироваться с очень незначительной токсичностью, стало исследование FALCON (NCT01602380), в котором сравнивалась эффективность применения фулвестранта и анастрозола в первой линии терапии ГР+ HER2-негативного мРМЖ у женщин в постменопаузе, результаты которого были доложены в Копенгагене M.J. Ellis на ESMO-2016 (LBA 14) [15].
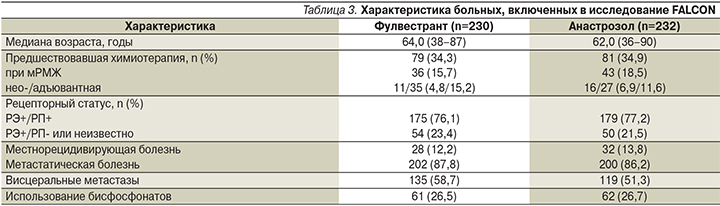
С октября 2012 по июль 2014 г. в исследование 3-й фазы FALCON (рандомизированное двойное слепое международное многоцентровое) были включены 524 и рандомизированы 462 женщины в постменопаузе с подтвержденным ГР+ HER2-негативным местнорецидивирующим или распространенным РМЖ, ранее не получавших ЭТ (230 – в группу терапии фулвестрантом и 232 – в группу терапии анастрозолом). Больные рандомизировались в соотношении 1:1. Группы были хорошо сбалансированы по основным характеристикам, которые в дальнейшем использовались для заранее запланированного субанализа ВБП (табл. 3).
Основной (первичной) целью исследования являлась демонстрация увеличения ВБП при использовании в качестве первой линии лечения распространенного РМЖ фулвестранта в дозе 500 мг в стандартном режиме (по 500 мг внутримышечно в дни 0-й, 14, 28-й и далее каждые 4 недели) по сравнению с терапией анастрозолом по 1 мг/сут ежедневно. Дополнительно (как вторичные цели) в исследовании оценивалась непосредственная эффективность (частота достижения и длительность объективного ответа и контроля болезни), безопасность терапии и качество жизни больных. Непосредственная эффективность оценивалась по критериям RECIST (Response Evaluation Criteria in Solid Tumours) 1.1, безопасность терапии – по CTCA (Common Terminology Criteria for Adverse Events) E, v. 4.0.
Запланированный анализ результатов исследования был проведен после 309 событий, которые включили прогрессирование болезни или необходимость проведения лучевой терапии или хирургического вмешательства вследствие ухудшения состояния или смерти по любой причине. В группе терапии фулвестрантом было зафиксировано 143 (62,2%) события, в то время как в группе терапии анастрозолом – 166 (71,6%).
Медиана времени без прогрессирования в группе терапии фулвестрантом оказалась на 2,8 месяца больше и составила 16,6 месяца по сравнению с 13,8 – в группе терапии анастрозолом (ОР=0,797, 95% ДИ – 0,637–0,999; p=0,0486).
Несмотря на сопоставимую непосредственную эффективность терапии фулвестрантом и анастрозолом (частота объективного ответа составила 46,1 и 44,9% соответственно), длительность объективного ответа от больных с измеряемыми проявлениями болезни была достоверно больше в группе терапии фулвестрантом: 20,0 и 13,2 месяца соответственно.
В связи с недостаточным временем наблюдения на момент проведения анализа данные по ОВ остаются незрелыми (события зафиксированы только в отношении 31% больных). Тем не менее в группе терапии фулвестрантом зафиксировано только 67 (29,1%) событий, в группе терапии анастрозолом – 75 (32,3%) (ОР=0,88, 95 ДИ – 0,63–1,22; p=0,428).
На момент проведения анализа медиана длительности применения фулвестранта составила 14,7 месяца (0,9–37,7 месяца), анастрозола – 13,9 (0,2–36,0 месяца). При этих сроках терапии в целом у 166 (72,8%) больных в группе терапии фулвестрантом и у 173 (74,6%) в группе терапии анастрозолом были зафиксированы те или иные побочные эффекты. Частота встречаемости и спектр побочных эффектов при использовании фулвестранта и анастрозола были в целом сопоставимыми. Наиболее часто встречались артралгия (16,7% при терапии фулвестрантом и 10,3% при терапии анастрозолом), приливы (11,4 и 10,3% соответственно по группам терапии), утомляемость (11,4 и 6,9% соответственно), гипертензия (6,6 и 9,1% соответственно), боли в спине (9,2 и 6,0% соответственно), миалгия (7,0 и 3,4%), периферические отеки (3,9 и 5,6%), одышка (3,9 и 5,6%). Указанные побочные эффекты имели преимущественно 1–2-ю степени выраженности.

Побочные эффекты 3-й и более степеней были отмечены у 51 (22,4%) больных, получавших фулвестрант, и у 41 (17,7%) больной группы терапии анастрозолом. Серьезные побочные эффекты зафиксированы у 30 (13,2%) и 31 (13.4%) больных соответственно, при этом ни одно из них не было связано с терапией исследуемыми препаратами. Вследствие отмеченных побочных эффектов только 16 (7,0%) больных группы терапии фулвестрантом и 11 (4,7%) группы терапии анастрозолом прекратили участие в исследовании.
В целом, как и во всех предыдущих исследованиях, в исследовании FALCON новых данных о переносимости терапии получено не было, также не было отмечено и неожиданных видов токсичности.
Итак, исследование показало, что применение высоких (стандартных на сегодняшний день) доз фулвестранта позволяет на 2,8 месяца увеличить медиану ВБП по сравнению с анастрозолом. Однако это не единственный вывод из этого исследования.
Сопоставимая непосредственная эффективность фулвестранта и анастрозола свидетельствует, что на оба препарата отвечают одни и те же больные. Но «правильным» больным фулвестрант позволяет контролировать болезнь значительно лучше, чем существовавший до настоящего времени стандарт первой линии – ингибиторы ароматазы.
Заранее запланированный поданализ показал, что таргетной популяцией для назначения фулвестранта в качестве первой линии терапии метастатического ГР+ HER2-негативного мРМЖ у женщин в постменопаузе являются больные, не имеющие висцеральных проявлений заболевания. В этой группе (n=95) без увеличения токсичности применение фулвестранта позволило больным жить с адекватным контролем болезни в среднем на протяжении 22,3 месяца, в то время как при использовании анастрозола эффект терапии заканчивался в среднем спустя 13,8 месяца (ОР=0,59, 95% ДИ – 0,42–0,84; см. рисунок).
Заключение
Более 15 лет имеющиеся варианты терапии ГР+ HER2-негативного мРМЖ оставались неизменными. Но сегодня мы находимся на пороге больших перемен. Почему же происходят эти изменения? Продемонстрированная уже в исследованиях 3-й фазы магнитуда выигрыша ВБП, обусловленная применением в первой линии фулвестранта или комбинации ингибитора циклин-зависимых киназ и летрозола, не позволяет ее игнорировать, считая незначительным преимуществом перед ранее существовавшими видами терапии, как это было при сравнении ингибиторов ароматазы и тамоксифена.
Как следствие – как минимум фулвестрант и палбоциклиб уже вошли в обновленные рекомендации ASCO-2016 г. по ЭТ в качестве предпочтительных вариантов первой линии. Однако в свете отсутствия зрелых данных об увеличении ОВ нам кажется, что для каждого из них существует свое место, обусловленное прежде всего переносимостью препаратов.
С нашей точки зрения, объект для применения фулвестранта в первой линии – это пациентки с ГР+ HER2-негативным мРМЖ с благоприятным прогнозом заболевания, определяемым отсутствием висцерального поражения. При сопоставимой с ингибиторами ароматазы токсичностью фулвестрант значимо увеличивает ВБП.
Объект же для комбинации палбоциклиба, а в скором времени и других ингибиторов циклин-зависимых киназ и ингибитора ароматазы – больные, для которых ранее в качестве альтернативы рассматривалась химиотерапия (т.е. больные со значительным, граничащим с висцеральным кризом распространением болезни). Обусловлен такой выбор тем, что в этой группе больных, несмотря на большую по сравнению с «чистой» ЭТ и меньшую или по крайней мере сопоставимую с химиотерапией токсичность, ингибиторы циклин-зависимых киназ могут обеспечить ВБП, безусловно, значимо превосходящую таковую при использовании химиотерапии.


