Рак молочной железы (РМЖ) на настоящий момент рассматривается как гетерогенное заболевание, имеющее различные биологические характеристики и подразделяющееся на пять основных молекулярных подтипов (табл. 1). Каждый подтип требует специфического подхода к выбору лекарственной терапии.
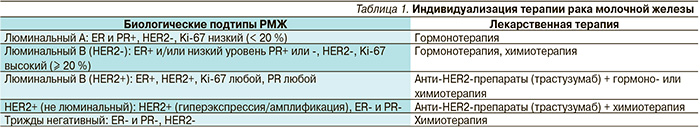
Алгоритм лечения метастатического РМЖ (мРМЖ) с положительными гормональными рецепторами показан на рис. 1.
Нелюминальный HER2+ РМЖ лечится анти-HER2-препаратами в сочетании с химиотерапией. В качестве первой линии специфической терапии используется комбинация таксанов и трастузумаба (Герцептин®). Назначение трастузумаба является стандартом и для адъювантной терапии больных HER2+ РМЖ, которая проводится в течение года, при этом длительность адъювантной терапии трастузумабом составляет 1 год.
Фактором, в какой-то мере осложняющим длительное лечение трастузумабом в качестве как неоадъювантного, так и адъювантного показания, считается способ его введения, а именно внутривенный. В связи с этим представляются чрезвычайно важными недавно опубликованные данные открытого рандомизированного мультицентрового исследования III фазы HannaH, сравнивавшего трастузумаб для подкожного (трастузумаб ПК) и внутривенного введения в неоадъювантном и затем адъювантном режимах лечения и показавшего равнозначные результаты в отношении эффективности, безопасности и фармакокинетических показателей [1]. С октября 2009 по декабрь 2010 г. в исследование были включены 596 больных из 81 центра. Основные характеристики в группах были хорошо сбалансированы. Химиотерапия включила 4 введения доцетаксела по 75 мг/м2 каждые 3 недели, затем 4 цикла FEC: 5-фторурацил 500 мг/м2, эпирубицин 75 мг/м2 и циклофосфамид 500 мг/м2 каждые 3 недели. Одновременное введение трастузумаба и эпирубицина сочли допустимым для больных ранним РМЖ, опираясь на низкий показатель кардиотоксичности подобной терапии при низких дозах антрациклинов в данной комбинации – доксорубицин 60 или эпирубицин 90 мг/м2 [2–5]. Внутривенно трастузумаб вводили каждые 3 недели в стандартном режиме: первая доза – 8 мг/кг (доза насыщения), затем по 6 мг/кг (поддерживающая доза). Трастузумаб ПК применялся в фиксированной дозе 600 мг (5 мл), введение препарата занимало не более 5 минут. В качестве вспомогательного вещества трастузумаб ПК содержит человеческую рекомбинантную гиалуронидазу, обеспечивающую возможность подкожного введения препарата.
После операции больные продолжали получать трастузумаб до окончания года с момента первого введения; лучевая и гормонотерапия назначались в соответствии с локальными стандартами. К моменту первоначального анализа 116 больных каждой группы закончили лечение, но никто не завершил фазу наблюдения: медиана времени наблюдения составила 12,2 месяца в группе внутривенного введения и 12,4 – в группе подкожного. Медиана интенсивности дозы трастузумаба составила 135,9 мг/нед в группе трастузумаба для внутривенного введения и 195,9 мг/нед – в группе трастузумаба ПК. В фармакокинетический анализ были включены 235 больных группы внутривенного введения и 234 – группы трастузумаба ПК.
При использовании трастузумаба ПК перед хирургическим этапом лечения создавалась концентрация не ниже, чем при внутривенном способе введения. Сравнительные фармакокинетические данные сопоставимы: средняя концентрация перед 8-м циклом (последний цикл перед оперативным вмешательством) составила 57,8 мг/мл (в группе трастузумаба для внутривенного введения) и 78,7 мг/мл (в группе трастузумаба ПК); средняя AUC0-21 дни (мг/мл × день) – 2056 (для внутривенного введения) и 2268 (для подкожного введения). Адъювантное лечение, включившее лучевую и гормонотерапию, оказалось идентичным.
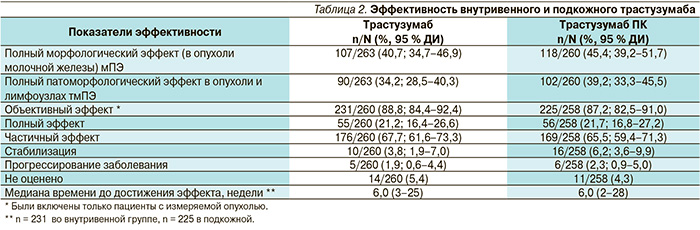
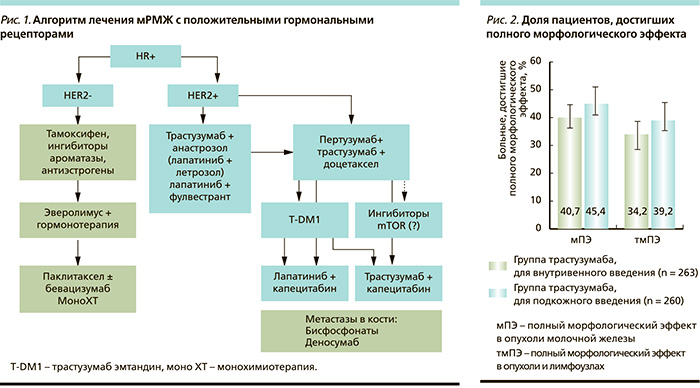
Оценка частоты патоморфологического эффекта представлялась наиболее важной как отражающая прогноз течения заболевания (данные представлены в табл. 2).
Трастузумаб ПК характеризовался сопоставимой эффективностью, полный морфологический эффект (мПЭ) достигнут 118 (45,4 %) из 260 больных группы трастузумаба ПК и 107 (40,7 %) из 263 больных группы внутривенного введения (рис. 2). Схожие результаты получены и при оценке мПЭ с учетом аксиллярных лимфоузлов: в группе подкожного введения – 39,2 %, в группе внутривенного введения – 34,2 %. Другие показатели эффективности, такие как объективный эффект, время до достижения объективного эффекта, также были приблизительно одинаковыми. Зависимости эффекта от веса больных при мультифакторном регрессионном анализе мПЭ отмечено не было.
Что касается побочных эффектов, то они также оказались сопоставимыми в обеих группах больных (табл. 3).
Наиболее часто наблюдались алопеция, тошнота, нейтропения, диарея, астения и усталость. В исследовании было зарегистрировано четыре смерти: в группе внутривенного введения трастузумаба – одна (< 1 %) от фатальной острой пневмонии; в группе подкожного введения трастузумаба – 3 (1 %): одна – от инфаркта миокарда, одна внезапная смерть 71-летней больной ожирением и диабетом и одна смерть 77-летней больной с предшествующей анемией 2–3-й степеней с последующей фебрильной нейтропенией 4-й степени и септическим шоком. Авторы сделали следующий вывод: данное исследование продемонстрировало удобную альтернативу внутривенному введению трастузумаба. Используя трастузумаб ПК, можно добиться аналогичной эффективности при сохранении безопасности проводимого лечения.
В другом открытом международном рандомизированном исследовании изучено предпочтение больных в отношении подкожного либо внутривенного метода введения трастузумаба. Больные в возрасте 18 лет и старше с HER2+ аденокарциномой молочной железы после завершения оперативного лечения и неоадъювантной и/или адъювантной химиотерапии (после рандомизации) получали трастузумаб в течение четырех циклов подкожно или внутривенно с последующим переходом на противоположный метод введения. Основной целью исследования являлось установление предпочтений больных в отношении трастузумаба ПК или трастузумаба для внутривенного введения.
Подкожно начали получать трастузумаб 124 пациентки, далее они были переведены на внутривенный способ введения, и у 124 больных путь введения препарата менялся в обратной последовательности. В оценку результатов были включены 117 больных первой группы и 119 – второй. Большая часть больных – 216 (91,5 %; 95 % ДИ – 87,2–94,7; р < 0,0001) – отдали предпочтение трастузумабу ПК, введение которого осуществлялось с помощью одноразового устройства для инъекций. Только 16 (6,8 %; 95 % ДИ – 3,9–10,8) больных предпочли внутривенную форму введения препарата и 4 пациентки не имели предпочтений (1,7 %; 95 % ДИ – 0,5–4,3).
Нежелательные явления наблюдались среди 141 (58 %) из 242 пациенток во время получения трастузумаба подкожно и среди 105 (44 %) из 241 – при внутривенном способе введения. Авторы сделали следующий вывод: подкожный способ введения трастузумаба в виде фиксированной дозы 600 мг каждые 3 недели хорошо переносится и является предпочтительным вариантом лечения при HER2+ РМЖ [6].
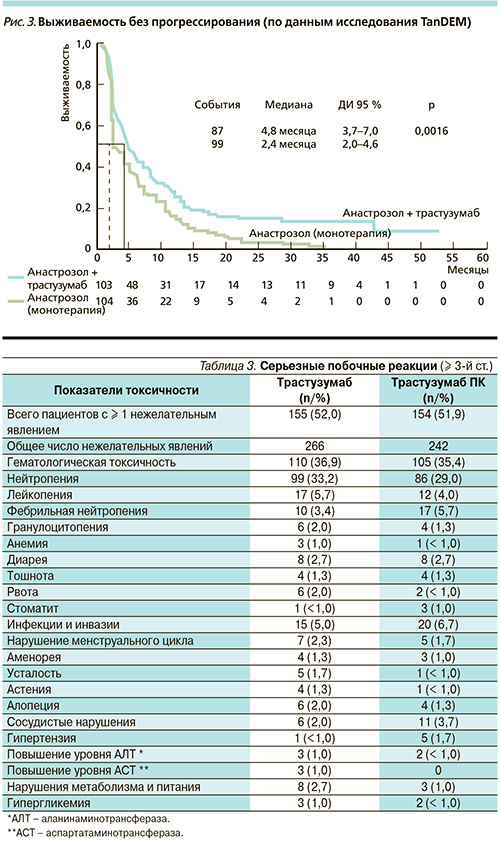
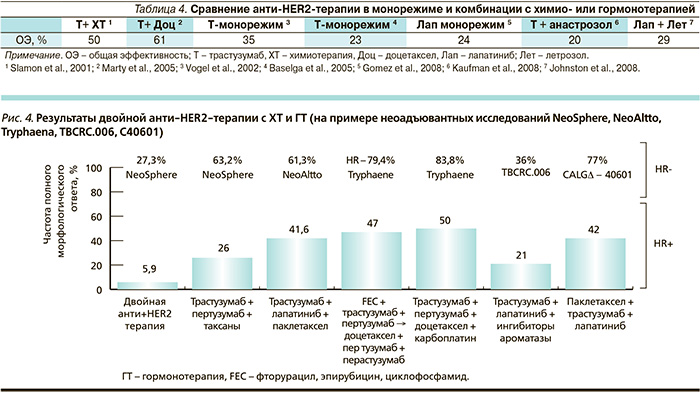
Однако необходимость в повышении эффективности терапии ставит новые задачи перед научными исследованиями. Некоторые из последних достижений уже внедрены в клиническую практику: так, в исследовании EGF-100151 было доказано преимущество комбинации лапатиниба с капецитабином по сравнению с монотерапией капецитабином. В исследовании BIG03-06 капецитабин с трастузумабом оказался эффективнее монотерапии капецитабином при прогрессировании РМЖ на фоне трастузумаб-содержащей терапии как при адъювантном применении, так и в лечебном варианте. В исследовании TanDEM комбинация анастрозола и трастузумаба была эффективнее монотерапии анастрозолом. Выживаемость без прогрессирования как конечная цель в исследовании TanDEM представлена на рис. 3. В исследовании CALGB-40302 было показано, что фулвестрант оказался более эффективным в комбинации с анти-HER-терапией, а именно с лапатинибом при HER2+ гормон-рецептор-позитивном мРМЖ. Рандомизированных исследований по сравнению гормонотерапии с химиотерапией нет, однако при наличии висцеральных метастазов, высоком Ki-67 и других показателях высокой агрессивности опухоли более целесообразно начинать лечение с комбинации анти-HER-препаратов с цитотоксическими агентами с учетом большей непосредственной эффективности данной схемы терапии (табл. 4).
На примере неоадъювантных исследований показано преимущество двойной анти-HER2-терапии в сочетании с химио- и гормонотерапией (рис. 4). Для больных мРМЖ также недавно показано такое преимущество. Комбинированная анти-HER2-терапия (пертузумаб + трастузумаб) + химиотерапия изучена в рандомизированном мультицентровом исследовании III фазы CLEOPATRA [7, 8].
Пертузумаб представляет собой рекомбинантные гуманизированные моноклональные антитела, которые избирательно взаимодействуют с отвечающим за димеризацию внеклеточным субдоменом II HER2-рецептора (рецептора эпидермального фактора роста человека 2-го типа). Связывание пертузумаба с субдоменом II блокирует процесс лиганд-зависимой гетеродимеризации HER2 с другими белками семейства HER, включая EGFR (рецептор эпидермального фактора роста человека), HER3 (рецептор эпидермального фактора роста человека 3-го типа) и HER4 (рецептор эпидермального фактора роста человека 4-го типа). Таким образом, пертузумаб ингибирует лиганд-инициированную передачу внутриклеточных сигналов по двум основным сигнальным путям: путь митоген-активированной протеинкиназы (МАР) и путь фосфоинозитид-3-киназы (PI3K). Угнетение данных сигнальных путей приводит к остановке роста опухолевых клеток и апоптозу соответственно. Кроме того, пертузумаб способствует активации антителозависимой клеточной цитотоксичности. Вместе пертузумаб и трастузумаб обеспечивают комплексную блокаду HER2-рецепторов.
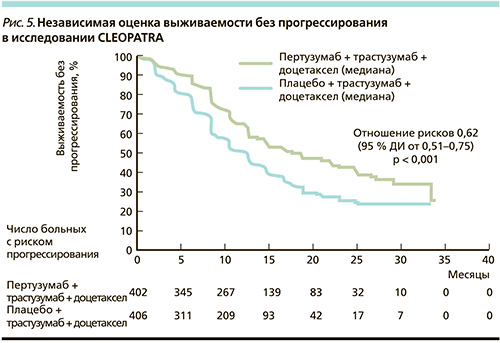
В исследование CLEOPATRA включены больные HER2-позитивным мРМЖ. Исследуемая группа получала пертузумаб + трастузумаб + доцетаксел в качестве 1-й линии лечения до прогрессирования или развития неприемлемой токсичности. Контрольная группа получала плацебо + трастузумаб + доцетаксел. Первичной целью исследования стала оценка выживаемости без прогрессирования (ВБП). Трастузумаб назначался в стандартной дозе: 1-е введение – 8 мг/кг, последующие введения – 6 мг/кг каждые 3 недели до прогрессирования заболевания или развития неприемлемой токсичности не менее 6 курсов. Доцетакасел назначался в дозе 75 мг/м2 (по решению исследователя доза могла быть увеличена до 100 мг/м2 при хорошей переносимости терапии). Пертузумаб/плацебо вводили в нагрузочной дозе 840 мг с последующей поддерживающей дозой 420 мг каждые 3 недели до появления признаков прогрессирования заболевания или неприемлемой токсичности. С февраля 2008 по июль 2010 г. были включены в исследование 808 больных из 204 центров 25 стран: 406 – в группу плацебо + трастузумаб + доцетаксел; 402 – пертузумаб + трастузумаб + доцетаксел.
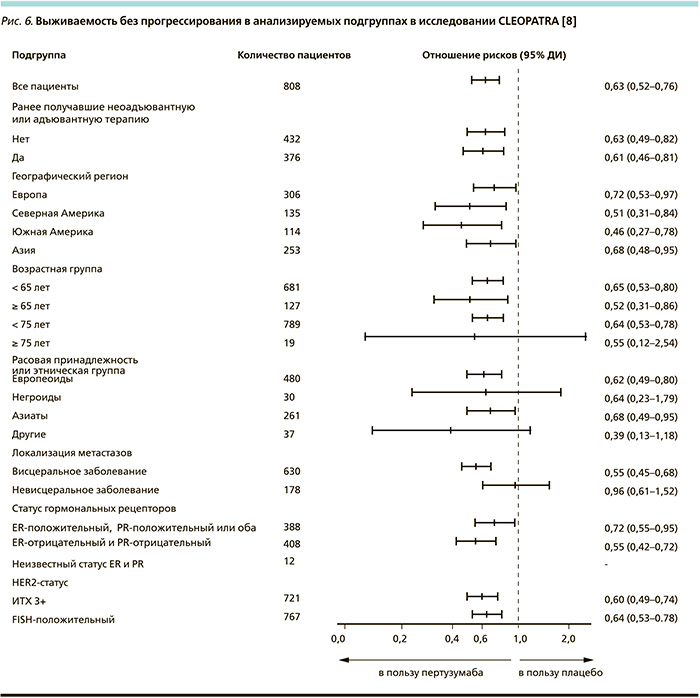
Лечение комбинацией пертузумаб + трастузумаб + доцетаксел увеличило медиану ВБП на 6,1 месяца: с 12,4 – в группе плацебо до 18,5 – в группе пертузумаба (р < 0,001, относительный риск [OP] – 0,62; рис. 5). Включение пертузумаба в схему лекарственной терапии привело к снижению риска прогрессирования заболевания на 38 %, смерти – на 34 %. Преимущество терапии с пертузумабом было очевидным почти для всех подгрупп пациенток (рис. 6).
В рамках субанализа анализировались группы пациенток в зависимости от предшествующей терапии (получавшие и не получавшие трастузумаб в качестве неоадъювантной и адъювантной терапии).
В группе из 88 больных, получавших трастузумаб адъювантно или неоадъювантно, медиана ВБП составила 10,4 месяца в контрольной группе и 16,9 – в группе пертузумаба (ОР – 0,62; 95 % ДИ – 0,35–1,07). Среди 288 больных, не получавших ранее трастузумаб, медиана ВБП составила 12,6 месяца в контрольной группе и 21,6 – в группе пертузумаба [8].
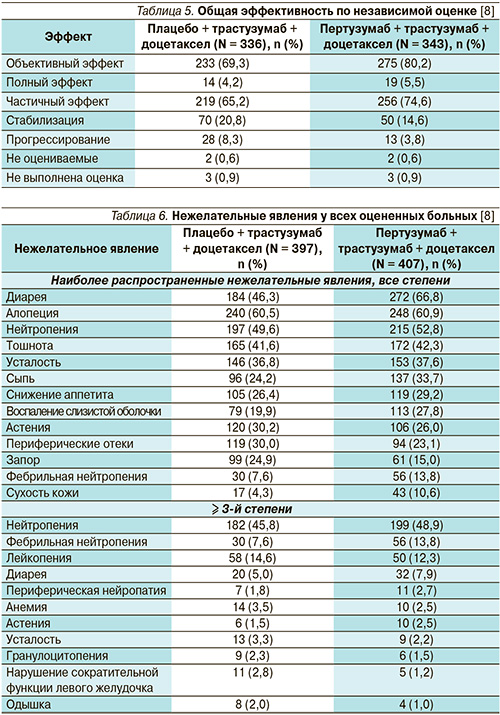
Объективный эффект в группе пертузумаба зарегистрирован в 80,2 % случаев, в контрольной – в 69, 3 % (табл. 5) [8].
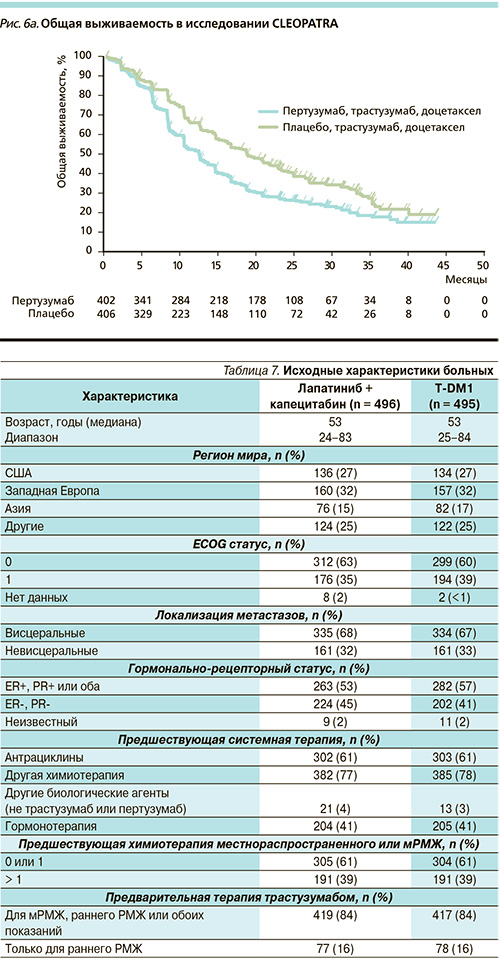
Анализ результатов исследования (срез данных – май 2011 г.) показал тенденцию к увеличению общей выживаемости в группе, получавшей пертузумаб, но без статистической значимости по условиям оценки (рис. 6а) [8]. Оценка общей выживаемости в мае 2012 г., когда было зарегистрировано 267 смертельных исходов (154 – 38 % из 406 группы плацебо и 113 – 28 % из 402 группы пертузумаба), показала значительное преимущество в группе пертузумаба [7]. Медиана общей выживаемости составила 37,6 месяца в группе плацебо (95 % ДИ 34,3 – не установлен) и не была достигнута в группе пертузумаба (95 % ДИ 42,4 – не установлен) [7]. Таким образом, данный анализ подтвердил, что добавление пертузумаба к комбинации трастузумаб + доцетаксел существенно увеличивает 1-, 2- и 3-летнюю выживаемости и снижает ОР смерти, демонстрируя значимое клиническое превосходство схемы терапии с включением пертузумаба [7].
При оценке профиля нежелательных явлений выявлено, что частота диареи, сыпи, повреждения слизистых оболочек, фебрильной нейтропении и сухости кожи была выше по меньшей мере на 5 % в группе пертузумаба [8]. Третья степень фебрильной нейтропении и диареи также чаще встречалась в группе пертузумаба. Частота фебрильной нейтропении 3-й степени и выше составила 12 % в контрольной группе и 26 % в группе пертузумаба среди пациенток из Азии; в других популяциях частота была 10 % или ниже. Комбинированная терапия с пертузумабом не увеличила вероятность симптоматического и/или бессимптомного нарушения сократительной функции левого желудочка (табл. 6).
Таким образом, исследование продемонстрировало перспективы комбинированной таргетной терапии – в данном случае без заметного увеличения частоты побочных явлений, т.е. без ухудшения переносимости, что крайне интересно для теоретических интерпретаций и важно практически. Комплексная блокада HER2+-опухолей с использованием двух таргетных препаратов (пертузумаба и трастузумаба) ведет к заметному увеличению клинической эффективности терапии в случае как трастузумабнаивных, так и предлеченных трастузумабом больных. Применение комбинации пертузумаб + трастузумаб + доцетаксел служит существенным улучшением стандарта лечения больных HER2+ мРМЖ.
Изучаются комбинации и других таргетных препаратов для лечения HER2+ РМЖ. Опубликованы результаты исследования BOLERO-3, в котором для преодоления возникшей резистентности к трастузумабу больными HER2+ мРМЖ был использован ингибитор m-TOR-сигнального пути эверолимус в комбинации с трастузумабом и винорелбином. Результаты тройной комбинации – эверолимус + винорелбин + трастузумаб, оказались статистически превосходящими комбинацию винорелбина и трастузумаба [8]. Добавление эверолимуса привело к увеличению медианы ВБП на 1,22 месяца (ОР – 0,78; 95 % ДИ – 0,65; 0,95, p = 0,0067).
С учетом наибольшей эффективности анти-HER2-препаратов с цитотоксическими агентами наиболее перспективным представляется один из новых препаратов, сочетающих оба подхода. Это конъюгат антитела и цитотоксического препарата – трастузумаб эмтанзин (T-DM1). Трастузумаб и DM1 в составе конъюгата связаны стабильным агентом – линкером, который обеспечивает стабильность конъюгата в системном кровотоке. Благодаря трастузумабу осуществляется таргетная доставка высокоэффективного цитотоксического препарата DM1 внутрь экспрессирующей HER2-рецепторы опухолевой клетки. Кроме того, трастузумаб проявляет свою противоопухолевую активность. Конъюгат T-DM1 внутри опухолевой клетки под воздействием лизосомальных ферментов распадается с высвобождением DM1, который вызывает нарушение полимеризации микротрубочек и гибель клетки. Подобный механизм действия T-DM1 позволяет добиваться увеличения эффективности противоопухолевой терапии и снижать число связанных с химиотерапией нежелательных явлений.
Наиболее интересным из недавно законченных исследований представляется изучение T-DM1 в сравнении с комбинацией капецитабина и лапатиниба во второй линии терапии HER2+ местнораспространенного или метастатического РМЖ – исследование EMILIA.
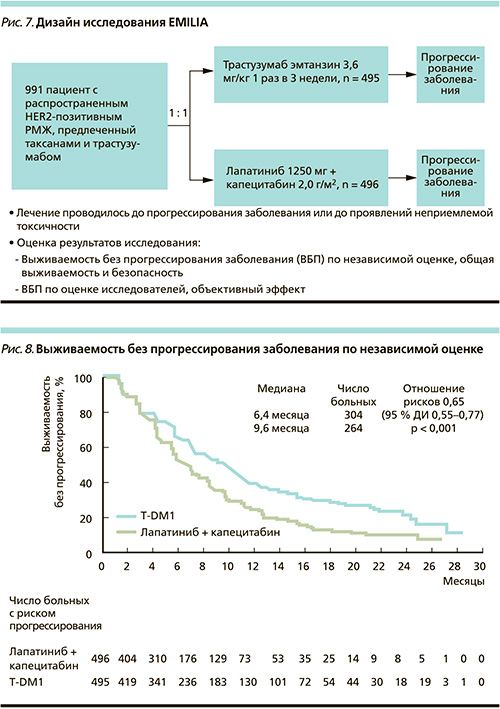
EMILIA – рандомизированное открытое международное исследование, включившее больных, которые уже получали ранее трастузумаб и таксаны. Больные были рандомизированы в соотношении 1 : 1 в 2 группы: группу монотерапии T-DM1 и группу пациенток, получавших комбинацию лапатиниба с капецитабином. Первичными целями исследования служили ВБП по оценке независимых экспертов, общая выживаемость и безопасность. ВБП оценивалась как время от рандомизации до прогрессирования или смерти от причины, не связанной с прогрессированием заболевания. Общую выживаемость оценивали как время от рандомизации до смерти от любой причины, время до симптоматического прогрессирования – как время от рандомизации до первого снижения пяти или более значений из шкалы функциональной оценки (FACT-B), по которой оценивалось качество жизни. Дизайн исследования представлен на рис. 7.
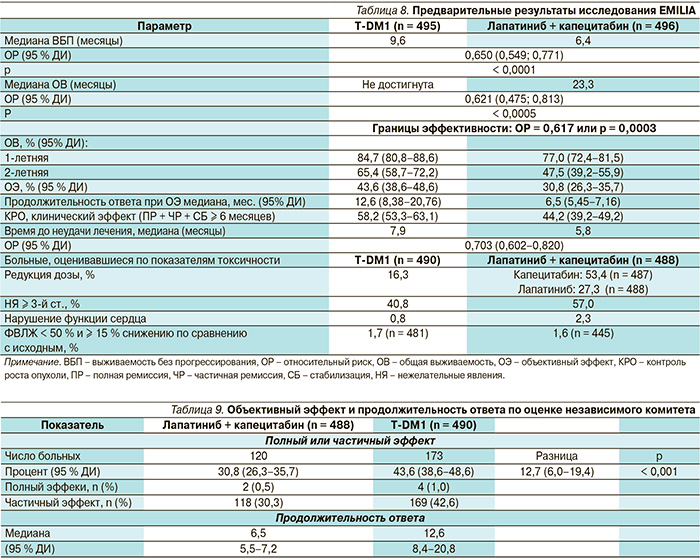
С февраля 2009 по октябрь 2011 г. в исследование EMILIA была включена 991 больная. Пациентки были рандомизированы в две группы. Одна из групп (495 больных) получала T-DM1 в дозе 3,6 мг/кг внутривенно каждые 3 недели, другая (496 больных) – капецитабин по 1000 мг/м2 дважды в день перорально с 1-го по 14-й день каждые 3 недели и лапатиниб 1250 мг/сут также перорально с 1-го по 21-й день. Исследование проведено в 213 центрах 26 стран. Все демографические характеристики были одинаковыми в обеих группах больных (табл. 7).
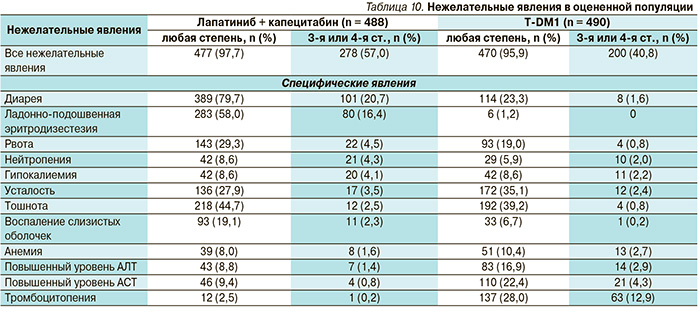
Результаты исследования EMILIA убедительно продемонстрировали преимущество лечения T-DM1 по сравнению с комбинацией лапатиниб + капецитабин (табл. 8) [10–12].
Медиана ВБП для получавшей T-DM1 группы составила 9,6 месяца, для группы лапатиниб + капецитабин – 6,4 (р < 0,001; рис. 8). Оценка независимым комитетом продемонстрировала достоверные значимые различия в частоте объективных эффектов (табл. 9), которые составили для T-DM1 43,6 %, для группы лапатиниб + капецитабин – 30,8 % (р < 0,001). Медианы продолжительности ОЭ составили 12,6 и 6,5 месяцев соответственно.
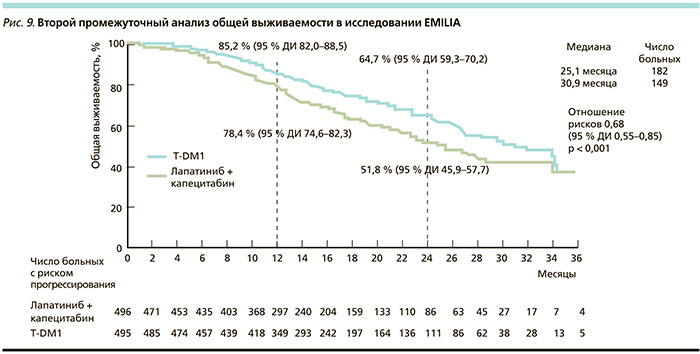
Второй промежуточный анализ показал улучшение общей выживаемости в группе T-DM1: 30,9 месяца по сравнению с 25,1 в группе лечения комбинацией лапатиниба и капецитабина: ОР – 0,68 (95 % ДИ – 0,55–0,85, р < 0,001; рис. 9) [10].
Нежелательные явления 3–4-й ст. чаще наблюдались в группе лапатиниба с капецитабином – 57 % по сравнению с получавшей T-DM1 группой (40,8 %). В первой группе (лапатиниб + капецитабин) наиболее часто отмечались диарея (20,7 %) и ладонно-подошвенная эритродизестезия (16,4 %) 3–4-й ст.
В группе T-DM1 чаще отмечались тромбоцитопения 3–4-й ст. (12,9 %), повышение уровней АСТ (4,3 %) и АЛТ (2,9 %). В большинстве случаев начальные проявления тромбоцитопении возникли во время первых двух циклов применения T-DM1, что требовало модификации дозы, но не отмены терапии. Только в 2 % (10 больных) случаев потребовалась отмена T-DM1 в связи с тромбоцитопенией. В группе с T-DM1 было больше больных с эпизодами кровотечений всех степеней по сравнению с группой лапатиниб + капецитабин – 29,8 и 15,8 % соответственно. Однако процент случаев с 3–4-й ст. данного осложнения оказался низким в обеих группах – 1,4 и 0,8 % соответственно. Случаи гипербилирубинемии были более частыми в группе лапатиниб + капецитабин – 8,2 по сравнению с 1,2 %. Профиль безопасности представлен в табл. 10.
На протяжении исследования проводился контроль за фракцией выброса левого желудочка (ФВЛЖ) сердца. У большинства больных ФВЛЖ ≥ 45 % поддерживалась на этом уровне на протяжении всего периода лечения (97,1 % – в группе T-DM1 и 93 % – в группе лапатиниб + капецитабин). Третья степень левожелудочковой недостаточности развилась лишь у одной больной группы T-DM1. За период наблюдения большинство смертей было связано с прогрессированием процесса: 123 (96,1 %) – в группе лапатиниб + капецитабин, и 91 (96,8 %) – в группе T-DM1. К причинам 5 связанных с нежелательными явлениями смертельных случаев в группе лапатиниб + капецитабин, которые произошли в течение 30 дней после последней дозы изучаемого препарата, отнесены коронарная недостаточность, мультиорганные поражения, кома, гидроцефалия. В группе T-DM1 одна смерть была обусловлена метаболической энцефалопатией после прогрессирования болезни в ЦНС.
Таким образом, T-DM1 представляет собой более эффективный и менее токсичный по сравнению с комбинацией капецитабина и лапатиниба вариант второй линии терапии HER2+ мРМЖ. Препарат Т-DМ1 уже зарегистрирован в США и странах Европейского Союза для второй линии терапии больных метастатическим HER2+ РМЖ, которые ранее уже получали трастузумаб и таксаны по отдельности или в комбинации. Также назначение T-DM1 эффективно для больных с прогрессированием заболевания на фоне или в течение 6 месяцев после окончания предшествующей терапии трастузумабом и таксанами в качестве адъювантного или неоадъювантного лечения.
В заключение следует отметить, что представленные в этой статье новые достижения лекарственного лечения HER2+ РМЖ являются чрезвычайно важным очередным этапом лекарственной терапии злокачественных новообразований.
Настоящая статья подготовлена при информационной поддержке компании «Ф. Хоффманн-Ля Рош Лтд.» (Швейца-рия).


