Вклинической практике для лечения системного остеопороза (ОП) и профилактики переломов широко используются бисфосфонаты (БФ). Обладая высоким сродством к гидроксиапатиту, БФ фиксируются на поверхности костной ткани в участках с высокой степенью ремоделирования [1] и оказывают прямое воздействие на остеокласты, нарушая их метаболизм и функциональную активность [2, 3]. Однако способность БФ связывать ионы двухвалентного металла, в данном случае ионизированный кальций [4], может приводить к снижению уровня сывороточного кальция даже при кратковременной циркуляции в кровяном русле, что проявляется гипокальциемей [5], которая в свою очередь способствует развитию вторичного гиперпаратиреоза [6]. Это явление снижает эффективность применения БФ и может стать причиной нежелательных осложнений. Поэтому обязательным условием терапии БФ для коррекции гомеостаза кальция и уровня паратгормона является дополнительное назначение витамина D и препаратов кальция. В повседневной клинической практике в комбинации с БФ чаще всего назначается колекальциферол, но оправданно ли это? Известно, что основные биологические эффекты витамина D определяются действием его активной формы – кальцитриола (является D-гормоном), окончательное превращение в которую из неактивных форм происходит в почечной ткани [7]. У части пациентов, особенно старшей возрастной группы, гидроксилирование 25(ОН)D3 и превращение его в 1,25(ОН)2D3 (кальцитриол) по ряду причин может быть нарушено [8]. По мнению некоторых исследователей [9], возможность такого нарушения требует использования в комбинации с БФ альфакальцидола, преимущество которого перед нативным витамином D при лечении ОП показано в экспериментах на крысах [10–12]. Однако до настоящего времени целесообразность его применения в комбинации с БФ остается дискутабельной [13,14]. Неоднозначное отношение к использованию альфакальцидола с БФ и стало основанием для выполнения данной работы.
Целью исследования являлась оценка влияния комбинации БФ (золедроновая или ибандроновая кислота) с альфакальцидолом и карбонатом кальция на минеральную плотность костной ткани (МПК) и гомеостаз кальция у пациенток с постменопаузальной и сенильной формами системного ОП.
Материал и методы
В открытое проспективное исследование были включены 163 пациентки (медиана возраста – 65,4 года) с постменопаузальной и сенильной формами системного ОП, длительностью мено-паузы >1 года, уровнем 25(OH)D3<30 нг/мл, нормокальциемией и нормальным уровнем щелочной фосфатазы.
Критерием для назначения БФ были отсутствие выраженного нарушения функции почек (клиренс креатинина не менее 35 мл/мин) и высокие показатели интенсивности резорбции костной ткани: дезоксипиридинолин (ДПИД) на верхней границе нормы или выше. Всем пациенткам, кроме того, оценивали уровни паратиреоидного гормона, кальция в суточной моче, остеокальцина (маркер костеобразовании). Исследования остеокальцина (иммунотурбометрия на анализаторе ABBOTT Architect c8000), 25(ОН)D3 и паратгормона (хемилюминисцентный иммуноанализ на микрочастицах Architect i2000), ДПИД (хемилюминесцентный иммуноанализ на аппарате IMMULITE 2000, реактивы фирмы Simens) проводились в лаборатории «Инвитро»; уровни щелочной фосфатазы, кальция и фосфора в крови определялись в лаборатории ЦИТО. Кальций в крови и моче повторно исследовали через 1, 3, 12 месяцев, остеокальцин в крови и ДПИД в моче – спустя 1 год, паратгормон – через 6 и 12 месяцев от начала лечения. Ибандроновую кислоту (Бонвива 3 мг внутривенно 1 раз в 3 месяца) получала 51 пациентка, золедроновую кислоту (5 мг внутривенно 1 раз в год) – 112. Статистически достоверных различий между исходными показателями в группах (рост, вес, возраст, дефицит МПК, количество переломов, уровни маркеров резорбции и костеобразования) отмечено не было.
Перед началом лечения и спустя год всем больным выполнялись денситометрия (LUNAR Prodigy) и рентгенограммы позвоночника для выявления возможных бессимптомных переломов тел позвонков. Пациенткам на фоне терапии БФ рекомендовался обязательный ежедневный прием 1000–1200 мг карбоната кальция и альфакальцидола в суточной дозе 0,5–1,25 мкг. Доза альфакальцидола определялась исходным содержанием кальция в крови и его динамикой в течение первых 3 месяцев от начала лечения при мониторировании уровней общего и ионизированного кальция крови и кальция суточной мочи. Закончили исследование 49 пациенток группы, получавших ибандроновую кислоту, и 111 – лечившихся золедроновой кислотой. Трое больных (двое из группы ибандроновой кислоты и одна из группы золедроновой кислоты) прекратили лечение без объяснения причины.
Статистический анализ
При парных сравнениях средних величин использовали независимый t-критерий, в случае нормального распределения – критерий Колмогорова–Смирнова или U-критерий Манна–Уитни, при повторных измерениях – парный t-критерий (нормальное распределение) или критерий Уилкоксона. Использовались также таблицы сопряженности, χ2 Пирсона. Критическое значение оценивалось при уровне значимости 0,05 [15]. Расчеты выполнялись по программе SPSS-20.
Результаты лечения
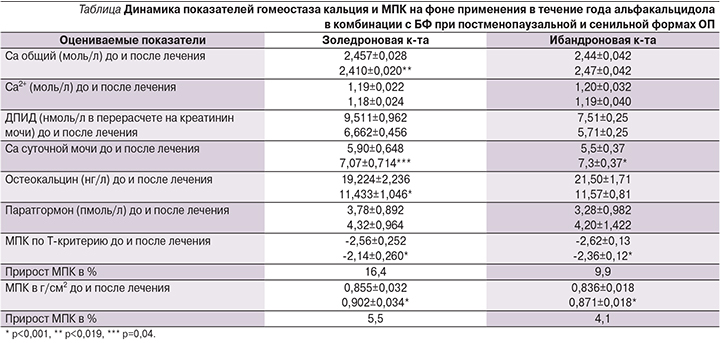
Анализ прироста МПК проводился раздельно для групп, получавших золедроновую и ибандроновую кислоты. Динамика МПК представлена в таблице.
Прирост МПК в L1-L4 в группе, получавшей золедроновую кислоту, составил 0,047±0,002, ибандроновую кислоту – 0,035±0,007 г/см2, различие между группами (критерий Манна–Уитни) оказалось недостоверным (р=0,127). В каждой из групп были выделены подгруппы в зависимости от величины прироста МПК или его отсутствия. При сравнении подгрупп с различным изменением МПК (таблица сопряженности, χ2 Пирсона) выявлено, что прирост МПК до 3% имел место у 17,6% больных при назначении золедроновой кислоты и у 16,1% – при использовании ибандроната; прирост МПК, превысивший 3%, был отмечен соответственно у 66,6 и 62,5% пациенток, различия между группами также оказались недостоверными. Не ответили на лечение 15,8% пациенток, получавших золедроновую кислоту, и 21,4% – лечившихся ибандроновой кислотой. Несмотря на то что абсолютное число «неответчиков» на лечение было больше в группе, получавшей ибандронат, различия между группами оказались недостоверными. Как и следовало ожидать, на фоне проведенной терапии в обеих группах спустя год от начала лечения наблюдалось снижение уровней маркеров резорбции и костеобразования (см. таблицу). В группе пациенток, принимавших золедроновую кислоту, ДПИД снизился относительно исходной величины на 30,0% (р=0,04), в группе, получавшей ибандроновую кислоту, – на 24% (р<0,001), снижение уровня остеокальцина также было достоверным (р<0,001) в обеих группах и составило соответственно 40,7 и 44,2%.
При сравнении в том же временном интервале динамики уровней кальция крови и паратиреоидного гормона в обеих группах достоверных различий не отмечено, в то время как выделение кальция с мочой на фоне лечения достоверно увеличилось при использовании как золедроновой (р=0,04), так и ибандроновой кислот (p<0,001). Следует подчеркнуть, что в большинстве случаев этот показатель оставался в пределах верхней границы нормы или превышал ее не более чем на 15%.
Обсуждение
Широкому внедрению в клиническую практику БФ, особенно азотсодержащих, способствуют их высокая комплаентность, особенно золедроновой кислоты, известные данные о способности этих препаратов увеличивать МПК и снижать риск переломов [16, 17]. Достоверное увеличение массы костной ткани спустя год от начала лечения было отмечено и в нашем исследовании, причем у большей части больных прирост МПК превышал 3% (ошибку метода измерения). Таких пациентов среди принимавших золедроновую кислоту было 66,6%, а ибандроновую – 62,5%. Не ответивших на лечение больных оказалось 15,85% при использовании золедроновой кислоты и 21,4% – среди пациенток, получавших ибандронат, различия между группами были недостоверными. О возможных причинах отсутствия эффекта при использовании БФ сообщалось ранее [18].
Показатели гомеостаза кальция и, что особенно важно, уровня паратгормона у всех больных на протяжении всего периода наблюдения независимо от величины прироста МПК оставались в пределах нормы, хотя, как известно [19], 85% пациенток с постменопаузальной и сенильной формами ОП имеют дефицит D-гормона.
В таких случаях назначение БФ увеличивает вероятность гипокальциемии, следствием которой является развитие вторичного гиперпаратиреоза, не только нивелирующего эффект БФ, но и усугубляющего дефицит МПК. Поскольку у наблюдавшихся нами пациенток не выявлено ни одного случая гипокальциемии, полагаем, что это стало возможным благодаря мониторированию уровня кальция крови и мочи в течение первых 6 месяцев с момента назначения БФ и персонализации дозы альфакальцидола. Сохранение гомеостаза кальция в пределах нормы – в свою очередь свидетельство адекватного поступления кальция, что является необходимой составляющей лечения БФ.
Существует еще один аргумент в пользу назначения альфакальцидола в комбинации с БФ. Известно, что при угнетении костной резорбции под влиянием БФ из-за тесной взаимосвязи функций остеокластов и остеобластов, лежащей в основе физиологии костной ткани, неизбежно снижается и интенсивность костеобразования [20]. В нашем исследовании под влиянием БФ также наблюдалось уменьшение не только интенсивности резорбции, но и костеобразования: достоверное снижение уровня остеокальцина было отмечено при назначении как золедроновой, так и ибандроновой кислот. При системном ОП, особенно у лиц пожилого возраста, это снижение может приводить к чрезмерному угнетению ремоделирования костной ткани, тем более что БФ замедляют созревание коллагена, нарушают его поперечные связи и гетерогенность минерализации [21]. Последнее обстоятельство приводит к накоплению микроповреждений [22], что рассматривается как причина т.н. атипичных переломов на фоне приема БФ [23–25]. Назначение альфакальцидола в этих случаях снижает негативное влияние БФ на процесс костеобразования, т.к. происходит нормализация уровня кальцитриола, который, как известно [26], активно участвует в регуляции процесса костеобразования.
Таким образом, хотя угнетение костеобразования отстает по времени от угнетения резорбции, для сохранения положительного костного баланса имеет значение сохранение в пределах нормы гомеостаза кальция, а это возможно только при одновременном с БФ назначении препаратов кальция и альфакальцидола.
Почему альфакальцидола, а не нативного витамина D? Есть доказательства, что недостаточность D-гормона может быть связана с нарушением его синтеза в почках и костях, уменьшением плотности рецепторов D-гормона (VDR) и/или снижением аффинности этих рецепторов к D-гормону в органах-мишенях [11]. Эти негативные явления, как полагают исследователи, можно преодолеть только с помощью аналогов D-гормона, которые в отличие от нативного витамина D способны модулировать процессы экспрессии и активации VDR [27]. Целесообразность назначения в этих случаях альфакальцидола подтверждается и клиническими исследованиями [9]. Так, показано, что масса костной ткани пациенток, обладающих аллелью bb гена VDR, не меняется при назначении витамина D3 и достоверно возрастает только в ответ на прием активных его метаболитов [28]. Преимущество альфакальцидола перед колекальциферолом при лечении ОП, в т.ч. и при комбинации с ибандроновой кислотой, было подтвержено рядом исследователей [11, 12, 29]. Есть также свидетельства, что D-гормон ускоряет синтез коллагена I типа и таких белков костного матрикса, как остеокальцин и остеопонтин [27]. Полагают [29], что комбинированное использование альфакальцидола и азотсодержащих БФ благодаря их разнонаправленному действию на механизмы метаболизма костной ткани способствует формированию баланса между процессами резорбции и костеобразования, что не всегда удается при комбинации БФ с колекальциферолом, тем более что у части больных наличие низкооборотного ОП может не подтверждаться отклонениями биохимических маркеров ремоделирования костной ткани [30]. В таких случаях альфакальцидол за счет усиления почечной реабсорбции и всасывания в кишечнике позволяет сохранять уровень кальция в норме. В определенной степени это подтверждается и в нашем исследовании: при сохранении в пределах нормы уровней кальция крови и паратгормона и достоверном приросте МПК у большей части пациенток повышается выделение кальция с мочой. Аргументом в пользу преимущества альфакальцидола могут быть сведения, согласно которым у пациентов с системным ОП отсутствие эффекта от приема витамина D в виде пищевой добавки может быть спровоцировано нарушением функции почек, нефропатией, артериальной гипертензией, ревматоидным артритом, хроническим бронхитом, болезнью Крона, сахарным диабетом, атеросклерозом и сердечной недостаточностью [31].
Еще один аспект целесообразности назначения альфакальцидола заключается в следующем: при резком угнетении резорбции под воздействием БФ этот препарат, превращаясь в кальцитриол, уменьшает синтез остеопротегерина, блокирующего взаимодействие системы RАNKL/RАNK. В этом случае происходит активация образования остеокластов и их предшественников, что повышает резорбцию [32], т.е. альфакальцидол препятствует чрезмерному снижению интенсивности ремоделирования.
Более высокая эффективность альфакальцидола может быть связана с его влиянием не только на количество, но и на качество костной ткани, что ранее отмечено в обзоре по оценке сравнительной эффективности альфакальцидола и витамина D, проведенного в 2005 г. [32].
Таким образом, отмеченное у пациенток с постменопаузальной и сенильной формами системного ОП на фоне приема БФ в комбинации с альфакальцидолом сохранение в пределах нормы показателей гомеостаза кальция подтверждает, что альфакальцидол, являясь синтетическим аналогом D-гормона, при персонализации дозы оказывает положительное влияние на большинство процессов, негативно изменяемых при использовании БФ.


