Кафедра пульмонологии, Северо-Западный государственный медицинский университет им. И.И. Мечникова, Санкт-Петербург, Россия
Хроническая обструктивная болезнь легких (ХОБЛ) – распространенное заболевание, характеризующееся персистирующей бронхиальной обструкцией. Важное значение в ее развитии и прогрессировании имеет хроническое воспаление дыхательных путей, возникающее под влиянием табачного дыма и поллютантов. Одним из наиболее дискутабельных вопросов в последние годы является место ингаляционных глюкокортикостероидов (ИГКС) в лечении ХОБЛ. В настоящей статье обсуждается роль ИГКС в комплексной терапии ХОБЛ. Имеющиеся результаты клинических исследований позволяют рекомендовать эти препараты при сочетании бронхиальной астмы и ХОБЛ. Они также показаны пациентам с частыми обострениями ХОБЛ, несмотря на терапию длительно действующими бронхолитиками и их комбинациями. Наиболее вероятным предиктором эффективности ИГКС в составе двойной (ИГКС/длительно действующие β2-агонисты [ДДБА]) и тройной терапии (ИГКС/ДДБА/длительно действующие антихолинергические препараты [ДДАХ]) является частота обострений и уровень эозинофилов крови. При назначении этих препаратов необходимо учитывать соотношение их эффективности и безопасности.
Для цитирования: Емельянов А.В., Лешенкова Е.В., Сергеева Г.Р. Ингаляционные глюкокортикостероиды в лечении хронической обструктивной болезни легких: дискуссия продолжается. Фарматека. 2019;26(5):10–16. DOI: https://dx.doi.org/10.18565/pharmateca.2019.5.10-16
хроническая обструктивная болезнь легких
ингаляционные глюкокортикостероиды
β2-адреномиметики длительного действия
длительно действующие антихолинергические препараты
Введение
Хроническая обструктивная болезнь легких (ХОБЛ) – распространенное заболевание, характеризующееся персистирующей бронхиальной обструкцией. Важную роль в его развитии и прогрессировании играет хроническое воспаление дыхательных путей, возникающее под влиянием табачного дыма и поллютантов. К основным симптомам ХОБЛ относятся одышка и кашель с выделением мокроты [1].
Исследования, показавшие связь локального и системного воспаления с обострениями, скоростью снижения функции легких, потерей массы тела и кардиоваскулярным риском [2–5], а также результаты лечения бронхиальной астмы (БА) стали предпосылкой для использования ингаляционных глюкокортикостероидов (ИГКС) больными ХОБЛ. Стероидная резистентность хронического воспаления дыхательных путей у пациентов с ХОБЛ [6] послужила на определенном этапе причиной использования при этом заболевании более высоких доз ИГКС, чем при БА.
Монотерапия ИГКС при ХОБЛ
История применения ИГКС при ХОБЛ начинается с 1980-х гг., когда группа экспертов Американского торакального общества в документе «Стандарты диагностики и лечения пациентов с ХОБЛ и астмой» [7] упомянула о возможности использования ИГКС для лечения некоторых больных с ХОБЛ.
Эффективность и безопасность монотерапии ИГКС при ХОБЛ изучались в четырех длительных (≥3 года) многоцентровых двойных слепых плацебо-контролируемых клинических исследованиях: European Respiratory Society study in chronic obstructive pulmonary disease (EUROSCOP) и Copenhagen study (будесонид 800–1200 мкг/cут), Inhaled steroids in obstructive lung disease in Europe study (ISOLDE study, флутиказона пропионат 1000 мкг/cут) и Lung Health Study (триамцинолона ацетонид, 1200 мкг/сут), включивших более 3400 пациентов.
В них показано, что 3-летнее назначение ИГКС не оказывает достоверного влияния на величину ежегодного снижения объема форсированного выдоха за 1 секунду (OФВ1) [8–12]. В группе больных c тяжелым течением заболевания, получавших флутиказона пропионат (ФП) и будесонид (БУД), отмечено достоверное снижение уровня маркеров системного воспаления, эпизодов ишемии миокарда, частоты обострений (на 25%) ХОБЛ и улучшение качества жизни пациентов [8, 9]. Полученные результаты были подтверждены при мета-анализе рандомизированных исследований продолжительностью ≥6 месяцев [13]. Таким образом, результаты приведенных выше исследований продемонстрировали отсутствие влияния ИГКС на скорость снижения бронхиальной проходимости у больных ХОБЛ. Для достижения относительно небольшого терапевтического эффекта требовалось применение высоких доз этих препаратов, что увеличивало вероятность развития их нежелательных эффектов и стоимость лечения.
Среди нежелательных эффектов у пациентов отмечены достоверное снижение концентрации эндогенного кортизола (ФП), появление кровоточивости кожи (ФП, БУД), снижение плотности костной ткани позвоночника и бедра (триамцинолона ацетонид – ТА), назофарингит (БУД).
Комбинация ИГКС и длительно действующих β2-адреномиметиков (ИГКС/ДДБА) при ХОБЛ
Неполная удовлетворенность результатами монотерапии ИГКС, многокомпонентная патофизиология, а также положительные эффекты, наблюдаемые при БА, стали предпосылкой к назначению пациентам ХОБЛ комбинации ИГКС и ДДБА.
Показано, что комбинация ФП/сальметерол (ФП/САЛМ) в дозе 500/50 мкг 2 раза в день в течение 12 недель снижает процент нейтрофилов, абсолютное число эозинофилов, Т-лимфоцитов и тучных клеток в биоптатах слизистой оболочки бронхов и в индуцированной мокроте у больных ХОБЛ средней тяжести и тяжелого течения [14]. Аналогичные результаты получены при исследовании бронхоальвеолярного лаважа [15]. Эти данные стали прямым подтверждением противовоспалительной активности комбинации ИГКС/ДДБА, которая может, вероятно, лежать в основе ее клинической эффективности.
Характеристика основных клинических исследований комбинаций ИГКС/ДДБА при ХОБЛ представлена в табл. 1. Показано, что длительное (12–36 месяцев) назначение этих препаратов больным ХОБЛ тяжелого и крайне тяжелого течения снижает выраженность симптомов, потребность в бронхолитиках, частоту среднетяжелых и тяжелых обострений улучшает бронхиальную проходимость и качество жизни пациентов по сравнению с терапией монокомпонентами и плацебо [16–25]. В двух масштабных клинических исследованиях (TORCH и SUMMIT) не удалось доказать влияния ФП/САЛМ и флутиказона фоурата/вилантерола (ФФ/ВИЛ) на выживаемость пациентов [19, 24].
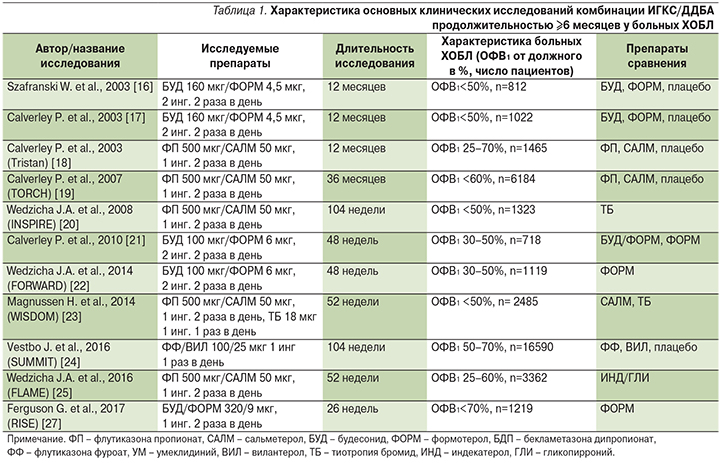
Мета-анализ семи клинических исследований показал, что комбинация ИГКС/ДДБА превосходит ИГКС по влиянию на число обострений ХОБЛ [26]. Это одно из объяснений того, почему монотерапия ИГКС не рекомендуется для лечения этого заболевания [1].
Частота обострений как наиболее важный, определяющий качество жизни и прогноз заболевания фактор анализировался практически во всех исследованиях, касающихся терапии ХОБЛ. Так, в исследовании RISE (2017) [27] показано, что БУД/формотерол (БУД/ФОРМ) по сравнению с одним ФОРМ достоверно снижает количество обострений ХОБЛ в год без значимого нарастания частоты побочных эффектов. Наибольшая эффективность наблюдалась у больных ХОБЛ с частыми обострениями до включения в исследование.
Эффективность приема двойной терапии (ультрамелкодисперстного бекламетазона дипропионата/ФОРМ) была также подтверждена в отношении пациентов с ХОБЛ без частых обострений в post-hoc-анализе исследования FORWARD [28].
Особым показанием к назначением ИГКС/ДДБА служит сочетание БА и ХОБЛ, при котором эти препараты должны назначаться в соответствии с общепринятыми международными рекомендациями [26].
Развернувшаяся в последние годы дискуссия о роли ИГКС/ДДБА в терапии ХОБЛ была инициирована результатами исследований их эффективности по сравнению с бронхолитиками длительного действия, влиянию отмены ИГКС на течение заболевания и данными о возможных побочных эффектах.
В исследовании INSPIRE показано, что общая частота обострений ХОБЛ у пациентов, получавших ИГКС/ДДБА и длительно действующий антихолинергический препарат (ДДАХ) тиотропия бромид (ТБ), была сопоставимой. В первой группе чаще встречались обострения, требовавшие применения антибиотиков, во второй – системных глюкокортикоидов [20].
Эффективность и безопасность ИГКС/ДДБА и комбинаций двух длительно действующих бронхолитиков (ДДБА/ДДАХ) для больных ХОБЛ сравнивались в нескольких исследованиях, продолжавшихся от 12 до 52 недель [25, 29–32]. В трех из них использовалась комбинация индакатерол/гликопирроний (ИНД/ГЛИ), в остальных – вилантерол/умеклидиний. В качестве препарата сравнения применялся ФП/САЛМ.
Наиболее продолжительным из них стало исследование FLAME, которое продолжалось 52 недели и предусматривало назначение больным ХОБЛ с ОФВ1 25–60%, имевших одно и более обострений в год, ИНД/ГЛИ или ФП/САЛМ (табл. 1). Было показано, что частота обострений в первой группе на 11% ниже, чем во второй (3,59 против 4,03; p<0,003). Бронхолитические препараты в большей степени, чем ИГКС/ДДБА, увеличивали время до первого обострения различной тяжести [25]. Полученные результаты стали одним из обоснований для отнесения бронхолитиков длительного действия или их комбинаций к препаратам первого ряда при лечения ХОБЛ [1].
Тем не менее цитируемое выше исследование не дает окончательного ответа на вопрос о месте ИГКС в лечении ХОБЛ. В группе получавших комбинацию ДДБА/ДДАХ частота обострений в среднем составила 3,59 в год, что обосновывает необходимость назначения им тройной терапии (ИГКС/ДДБА/ДДАХ). Частота тяжелых обострений в исследуемых группах была сопоставимой. Различия между группами уменьшалась у больных, имевших ≥2 обострений ХОБЛ в предшествовавший год [25].
Комбинация ИГКС/ДДБА/ДДАХ
В последние годы опубликовано несколько исследований по использованию тройной терапии (ИГКС/ДДБА/ДДАХ) при ХОБЛ (табл. 2). Мета-анализ 21 исследования по применению при ХОБЛ комбинации ИГКС/ДДБА/ДДАХ показал значительное снижение частоты среднетяжелых и тяжелых обострений заболевания, количества госпитализаций; увеличение ОФВ1 по сравнению с двойной терапией (ИГКС/ДДБА, ДДБА/ДДАХ) или монотерапией ДДАХ [33]. Полученные результаты свидетельствуют о том, что ИГКС усиливают терапевтические эффекты длительно действующих бронхолитиков. Использование тройной терапии рекомендуется пациентам с тяжелым течением ХОБЛ, выраженными симптомами и высокой частотой обострений, несмотря на использование бронхолитиков или комбинации ИГКС/ДДБА.

Предикторы эффективности ИГКС
К возможным предикторам эффективности ИГКС при ХОБЛ с частыми обострениями относятся положительный тест на обратимость обструкции (прирост ОФВ1 на ≥12% и ≥400 мл), наличие гиперреактивности бронхов, высокий уровень оксида азота в выдыхаемом воздухе и эозинофилия мокроты (>3%) и крови [34].
Одна из попыток выделить целевую группу больных ХОБЛ, которым показаны ИГКС, связана с использованием эозинофилов периферической крови как одного из наиболее доступных маркеров эозинофильного воспаления дыхательных путей. По данным изучения биопсий слизистой оболочки бронхов и мокроты, последнее имеется примерно у 10–40% пациентов при стабильном течении ХОБЛ и мало зависит от выраженности бронхиальной обструкции [35, 36]. При ретроспективном анализе нескольких исследований показано, что эффективность ИГКС/ДДБА выше при уровне эозинофилов крови >2% [37–39].
Опубликованный недавно мета-анализа нескольких клинических исследований показал, что предиктором эффективности стартовой комбинированной терапии ИГКС пациентов с ХОБЛ является уровень эозинофилов периферической крови ≥300 клеток/мкл [40]. При ретроспективном анализе трех клинических исследований установлено, что комбинация БУД/ФОРМ снижает частоту обострений ХОБЛ по сравнению с монотерапией ФОРМ при уровне эозинофилов крови ≥100 клеток в 1 мкл [41].
Полученные результаты послужили основанием для рекомендаций по назначению больных ХОБЛ комбинированной терапии ИГКС/длительно действующие бронхолитики (табл. 3).

Влияние отмены ИГКС на течение ХОБЛ
Данные о влиянии отмены ИГКС на легочную функцию, симптомы болезни, частоту обострений противоречивы.
В некоторых исследованиях показано увеличение числа обострений и ухудшение симптомов при отмене ИГКС, особенно у пациентов с признаками эозинофильного воспаления. [42, 43]. Интересно, что хотя снижение ИГКС происходило ступенчато, значимое ухудшение ОФВ1 наблюдалось у пациентов после полной отмены препаратов [44]. Эти наблюдения позволяют предположить, что использование низких доз ИГКС в ряде случаев предпочтительнее, чем их полная отмена.
В других исследованиях установлено, что отмена ИГКС у больных ХОБЛ не приводит к увеличению числа обострений в течение 1–5 лет, но сопровождается достоверным снижением показателей легочной функции и качества жизни пациентов [23, 45]. Эти данные свидетельствуют о возможности отмены ИГКС больным ХОБЛ, особенно тем, кому эти препараты были назначены необоснованно или у кого отсутствуют четкие клинические доказательства их эффективности.
В ту же группу, вероятно, можно отнести пациентов, имеющих побочные эффекты при их назначении. Вместе с тем пока недостаточно данных о методике снижения дозы или отмены ИГКС.
В недавнем исследовании SUNSET (2018) указывается на отсутствие увеличения числа обострений при отмене ИГКС у пациентов, получавших тройную терапию, не имевших в анамнезе частых обострений [46]. Тем не менее у больных ХОБЛ с уровнем эозинофилов крови ≥300 клеток/мкл отмечено увеличение числа обострений. Аналогичные данные были получены при ретроспективном анализе исследований WISDOM [47]. Таким образом, у пациентов с высокой частотой обострений ХОБЛ, уровнем эозинофилов крови ≥300 кл/мкл крови, с сочетанием БА и ХОБЛ отмена ИГКС может приводить к ухудшению течения заболевания.
Полученные данные о возможности отмены ИГКС пациентам с ХОБЛ особенно актуальны для стран Западной Европы, в которых более 70% лиц, страдающих этим заболеванием, получают высокие дозы ИГКС [48], при этом число больных с частыми обострениями не превышает 40% [49]. Недавно выполненное в реальной клинической практике в 23 городах России исследование, включившее 1111 больных ХОБЛ, показало иную картину. Фенотип с частыми обострениями имели 51% пациентов, из которых лишь менее половины (44,7%) получали комбинацию ИГКС/ДДБА или ИГКС/ДДБА/ДДАХ [50]. Из 222 больных ХОБЛ, присланных к нам на консультацию врачами первичного звена, частые обострения имели 48% пациентов, из которых лишь 35% получали комбинированную терапию с ИГКС. Причиной нерационального использования этих препаратов стали особенности системы льготного лекарственного обеспечения больных ХОБЛ, недостаточное знакомство врачей с национальными и международными рекомендациями.
Безопасность ИГКС
В клинических исследованиях показано, что использование высоких доз различных ИГКС ассоциировано с повышенной частотой развития кандидоза полости рта, осиплости голоса, кровоточивости кожи, пневмонии [1]. Пневмонии чаще встречались у больных пожилого и старческого возраста с низкими уровнями ОФВ1 (<50% от должного), низким индексом массы тела, выраженной одышкой и уровнем эозинофилов периферической крови менее 2% [19, 51–53]. Лечение ИГКС не сопровождалось увеличением числа летальных пневмоний. Механизмы развития этого нежелательного явления изучены недостаточно.
Полученные данные свидетельствуют о том, что при появлении признаков обострения ХОБЛ на фоне лечения ИГКС/ДДБА и ИГКС/ДДБА/ДДХЛ следует обязательно выполнять рентгенографию органов дыхания в двух проекциях с целью исключения легочной инфильтрации и назначения антибактериальной терапии в случае ее развития.
Применение ИГКС может приводить к увеличению микробной колонизации дыхательных путей и увеличению риска респираторных инфекционных заболеваний [54]. Причем такая закономерность также выявлена только у пациентов, получавших ИГКС и имевших низкий (<2%) уровень эозинофилов крови.
Связь между приемом ИГКС, снижением плотности костной ткани, развитием катаракты, сахарного диабета и ухудшением его течения, стероидной трахеобронхопатии, стероидной миопатии, нетуберкулезной микобактериальной инфекции и туберкулеза, отмеченная в некоторых наблюдательных исследованиях, изучена пока недостаточно [1, 55–57].
Дозозависимость обсуждаемых выше побочных эффектов ИГКС привела к обсуждению целесообразности использования высоких доз этих препаратов пациентами с ХОБЛ. Как правило, в странах Северной Америки зарегистрированные дозы ИГКС примерно в 2 раза ниже, чем в странах Европы и России. При исследовании новой комбинации ФФ/ВИЛ показано, что повышение дозы ФФ до 200 мкг/сут не приводит к улучшению функции легких и снижению частоты обострений по сравнению с дозой 100 мкг. Частота пневмонии была одинаковой в группах, получавших в течение 1 года ФП/САЛМ (500/50 мкг 2 раза в сутки) и ФФ/ВИЛ (100/25 мкг 1 раз в сутки) [58, 59].
Проведенные к настоящему времени клинические исследования и мета-анализы эффективности и безопасности применения ИГКС при ХОБЛ показывают, что повышение доз ИГКС выше средних приводит к небольшому положительному эффекту, но в то же время значимо повышает риск побочных эффектов [60].
Заключение
Таким образом, ИГКС в составе комбинированной терапии сохраняют свое место в лечении ХОБЛ, что подтверждено в опубликованных недавно международных рекомендациях [1]. Имеющиеся данные позволяют рекомендовать эти препараты при лечении пациентов с сочетанием БА и ХОБЛ, а также при ХОБЛ с частыми обострениями (≥2 в год или 1 госпитализация в год), несмотря на терапию длительно действующими бронходилататорами (ДДАХ или ДДБА/ДДАХ). Предиктором эффективности ИГКС может быть абсолютный уровень эозинофилов периферической крови, превышающий пороговые значения. Не исключено, что при лечении пациентов с ХОБЛ возможно использовать минимальные эффективные дозы ИГКС, которые ниже официально зарегистрированных. Вместе с тем для окончательного ответа на этот вопрос необходимы дополнительные клинические исследования.
1. Global Initiative for Chronic Obstructive Lung Disease. Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease. NHLBI/WHO workshop report. National Heart, Lung, and Blood Institute, update 2019. www.goldcopd.com (access date 18.03.19).
2. Stănescu D., Sanna A., Veriter C., et al. Airways obstruction, chronic expectoration, and rapid decline of FEV1 in smokers are associated with increased levels of sputum neutrophils. Thorax. 1996;51:267–71.
3. Cao C., Wang R., Wang J., et al. Body Mass Index and Mortality in Chronic Obstructive Pulmonary Disease: A Meta-Analysis. PLoS One. 2012;7(8):e4389. Doi:10.1371/journal.pone.0043892.
4. King P. Inflammation in chronic obstructive pulmonary disease and its role in cardiovascular disease and lung cancer Clin Transl Med. 2015;4:26. Doi: 10.1186/s40169-015-0068-z.
5. Agustı A., Edwards L.D., Rennard S.I., et al. Persistent Systemic Inflammation is Associated with Poor Clinical Outcomes in COPD: A Novel Phenotype. PLoS ONE. 2012;7(5):e37483. Doi:10.1371/journal.pone.0037483.
6. Barnes P. Corticosteroid resistance in patients with asthma and chronic obstructive pulmonary disease. J Allergy Clin Immunol. 2013;131:636–45.
7. Standards for the diagnosis and care of patients with chronic obstructive pulmonary disease (COPD) and asthma. This official statement of the American Thoracic Society was adopted by the ATS Board of Directors, November 1986. Am Rev Respir Dis. 1987;136(1):225–44.
8. Burge P.S. EUROSCOP, ISOLDE and the Copenhagen City Lung Study. Thorax. 1999;54(4):287–88.
9. Burge P.S., Calverley P.M.A., Jones P.W., et al. Randomised, double blind, placebo controlled study of fluticasone propionate in patients with moderate to severe chronic obstructive pulmonary disease: the ISOLDE trial BMJ. 2000;320(7245):1297–303.
10. Pauwels R.A., Lofdahl C.-G., Laitinen L.A., et al. Long-term treatment with inhaled budesonide in persons with mild chronic obstructive pulmonary disease who continue smoking. N Engl J Med. 1999;340(25):1948–53.
11. The Lung Health Study Research Group. Effect of inhaled triamcinolone on the decline in pulmonary function in chronic obstructive pulmonary disease. N Eng J Med. 2000;343(26):1902–909.
12. Vestbo J., Sorensen T., Lange P., et al. Long-term effect of inhaled budesonide in mild and moderate chronic obstructive pulmonary disease. Lancet. 1999;353(9167):1819–23.
13. Alsaeedi A., Sin D.D., McAlister F.A. The effect of inhaled corticosteroids in chronic obstructive pulmonary disease: a systematic review of randomized placebo-controlled trials. Am J Med. 2002;113(1):56–65.
14. Barnes N.C., Qiu Y.S., Pavord I.D., et al. Antiinflammatory effects of salmeterol/fluticasone propionate in chronic obstructive lung disease. Am J Respir Crit Care Med. 2006;173:736–43.
15. Jen R., Rennard S.I., Sin D.D. Effects of inhaled corticosteroids on airway inflammation in chronic obstructive pulmonary disease: a systematic review and meta-analysis. Int J COPD. 2012;7:587–95.
16. Szafranski W., Cukier A., Ramiez A., et al. Efficacy and safety of budesonide/formoterol in the management of chronic obstructive pulmonary disease. Eur Respir J. 2003;21(1):74–81.
17. Сalverley P., Pauwels R., Vestbo J., et al. Combined salmeterol and fluticason in the treatment of chronic obstructive pulmonary disease: a randomized controlled trial. Lancet. 2003;361(9356):449–56.
18. Calverley P., Boonswat W., Cseke Z., et al. Maintenance therapy with budesonide and formoterol in chronic obstructive pulmonary disease. Eur Respir J. 2003;22(6):912–19.
19. Calverley P.M.A., Anderson J.A., Celli B., et al. Salmeterol and fluticasone propionate and survival in chronic obstructive pulmonary disease. N Engl J Med. 2007;356:775–89. Doi: 10.1056/NEJMoa1516385.
20. Wedzicha J.A., Calverley P.M.A., Seemungal T., et al. The Prevention of chronic obstructive pulmonary disease exacerbations by salmeterol/fluticasone propionate or tiotropium bromide. Am J Respir Crit Care Med. 2008;177:19–26. Doi:10.1164/rccm.200707-973OC.
21. Calverley P.M., Kuna P., Monso E., et al. Beclomethasone/formoterol in the management of COPD: a randomised controlled trial. Respir. Med. 2010;104:1858–68. Doi:10.1016/j.rmed.2010.09.008.
22. Wedzicha J.A., Singh D., Vestbo J., et al. Extrafine beclomethasone/ formoterol in severe COPD patients with history of exacerbations. Respir. Med. 2014;108:1153–62.
23. Magnussen H., Disse B., Rodriguez-Roisin R., et al. Withdrawal of Inhaled Glucocorticoids and Exacerbations of COPD. N Engl J Med. 2014;371:1285–94. Doi:10.1056/NEJMoa1407154.
24. Vestbo J., Anderson J.A., Brook R.D. Fluticasone furoate and vilanterol and survival in chronic obstructive pulmonary disease with heightened cardiovascular risk (SUMMIT): a double-blind randomized controlled trial. Lancet. 2016;387:1817–26. Doi:10.1016/S0140-6736(16)30069-1.
25. Wedzicha J.A., Banerji D., Chapman K.R. Indacaterol–Glycopyrronium versus Salmeterol–Fluticasone for COPD. N Engl J Med. 2016;374: 2222–34.
26. Nannini L.J., Cates C.J., Lasserson T.J., Poole P. Combined corticosteroid and long-acting beta-agonist in one inhaler versus inhaled steroids for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2014;4:CD006826. Doi:10.1002/14651858.CD006826.
27. Ferguson G.T., Tashkin D.P., Skärby T., et al. Effect of budesonide/formoterol pressurized metered-dose inhaler on exacerbations versus formoterol in chronic obstructive pulmonary disease: The 6-month, randomized RISE (Revealing the Impact of Symbicort in reducing Exacerbations in COPD) study. Respir Med. 2017;132:31–41. Doi:10.1016/j.rmed.2017.09.002.
28. Singh D., Vezzoli S., Petruzzelli S., Papi A. The efficacy of extrafine beclomethasone dipropionate–formoterol fumarate in COPD patients who are not «frequent exacerbators»: a post hoc analysis of the FORWARD study. Int J COPD. 2017;12:3263–71. Doi:10.2147/COPD.S141416.
29. Vogelmeier C.F., Bateman E.D., Pallante J., et al. Efficacy and safety of once-daily QVA149 compared with twice-daily salmeterol-fluticasone in patients with chronic obstructive pulmonary disease (ILLUMINATE): a randomised, double-blind, parallel group study. Lancet Respir Med. 2013;1:51–60. Doi: 10.1016/S2213-2600(12)70052-8.
30. Zhong N., Wang C., Zhou X., et al. LANTERN: a randomized study of QVA149 versus salmeterol/fluticasone combination in patients with COPD. Int J COPD. 2015;10:1015–26. Doi:10.2147/COPD.S84436.
31. Donohue J., Worsley S., Zhu C.-Q., et al. Improvements in lung function with umeclidinium/vilanterol versus fluticasone propionate/salmeterol in patients with moderate-to-severe COPD and infrequent exacerbations. Respir Med. 2015;109:870–81.
32. Singh D., Worsley S., Zhu C.-Q., et al. Umeclidinium/vilanterol versus fluticasone propionate/salmeterol in COPD: a randomised trial. BMC Pulm Med. 2015;15:91. Doi:10.1186/s12890-015-0092-1.
33. Vanfleteren L., Fabbri L.M., Papi A., et al. Triple therapy (ICS/LABA/LAMA) in COPD: Time for a reappraisal. Int J COPD. 2018;13:3971–81. Doi: 10.2147/COPD.S185975.
34. D’Urzo A., Donohue J.F., Kardos P., et al. A re-evaluation of the role of inhaled corticosteroids in the management of patients with chronic obstructive pulmonary disease. Expert Opin. Pharmacother. 2015;16 (12):1845–60. Doi:10.1517/14656566.2015.1067682.
35. Hogg J., Chu F., Utokaparch S., et al. The nature of small-Airway obstruction in chronic obstructive pulmonary disease. N Engl J Med. 2004;350:2645–53.
36. George L., Brightling C.E. Eosinophilic airway inflammation: role in asthma and chronic obstructive pulmonary disease. Ther Adv Chronic Dis. 2016;7(1):34–51. Doi:10.1177/2040622315609251.
37. Siddiqui S.H., Guasconi A., Vestbo J., et al. Blood eosinophils: a biomarker of response to extrafine beclomethasone/formoterol in chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2015;192(4):523–25. Doi:10.1164/rccm.201502-0235LE.
38. Cazzola M., Rogliani P., Calzetta L., et al. Triple therapy versus single and dual long- acting bronchodilator therapy in COPD: a systematic review and meta-analysis. Eur Respir. 2018;52:1801586. Doi: 10.1183/13993003.01586-2018.
39. Bafadel M., Peterson S., De Blas M., et al. Predictors of exacerbation risk and response to budesonide in patients with chronic obstructive pulmonary diseases: a post-hoc analysis of the randomized trials. Lancet. Respir Med. 2018;6:117–26.
40. Suissa S., Rossi A. Weaning from inhaled corticosteroids in COPD: the evidence. Eur Respir J. 2015;46(5):1232–35. Doi:10.1183/13993003.00282-2015.
41. Watz H., Tetzlaff K., Wouters E.F.M., at al. Blood eosinophil count and exacerbations in severe chronic obstructive pulmonary disease after withdrawal of inhaled corticosteroids: a post-hoc analysis of the WISDOM trial. Lancet. Respir Med. 2016;4(5):390–98. Doi:10.1016/S2213-2600(16)00100-4.
42. Cosio M., Baraldo S., Saetta M. Inhaled glucocorticoids and COPD exacerbations. N Engl J Med. 2015;372(1):92.
43. Kunz L.I.Z., Postma D.S., Klooster K., et al. Relapse In FEV1 decline after steroid withdrawal in COPD. Chest. 2015;148(2):389–96. Doi: 10.1378/chest.14-3091.
44. Chapman K.R., Hurst J.R., Frent S.M., et al. Long-term triple therapy de-escalation to indacaterol/glycopyrronium in patients with chronic obstructive pulmonary disease (SUNSET): A randomized, double-blind, triple-dummy clinical trial. Am J Respir Crit Care Med. 2018;198(3):329–39. Doi:10.1164/rccm.201803-0405OC.
45. Watz H., Tetzlaff K., Wouters E.F., et al. Blood eosinophil count and exacerbations in severe chronic obstructive pulmonary disease after withdrawal of inhaled corticosteroids: a post-hoc analysis of the WISDOM trial. Lancet. Respir Medicine. 2016;4(5):390–98. Doi:10.1016/S2213-2600(16)00100-4.
46. Izquierdo J.L., Rodrı´guez Glez-Moro J.M. The excessive use of inhaled corticosteroids in chronic obstructive pulmonary disease. Arch Bronconeumol. 2012;48:207–12. Doi:10.1016/j.arbres.2012.01.002.
47. Miravittles M., Barrecheguren M., Román-Rodríguez M. Frequency and characteristics of different clinical phenotypes of chronic obstructive pulmonary diseases Int J Tub Lung Dis. 2015;19(8):992–98.
48. Архипов В.В., Архипова Д.Е., Стукалина Е.Ю., Лазарев А.В. Частота встречаемости отдельных фенотипов хронической обструктивной болезни легких в Российской Федерации, их характеристики и подходы к лечению. Практическая пульмонология. 2016;3:1–7.
49. Lipson D.J., Martinez F.J., Criner G.J., et al. Once-Daily Single-Inhaler Triple versus Dual Therapy in Patients with COPD. N Engl J Med. 2018;378(18):1671–80. Doi:10.1056/NEJMoa1713901.
50. Pavord I.D., Lettis S., Anzueto A., Barnes N. Blood eosinophil count and pneumonia risk in patients with chronic obstructive pulmonary disease: a patient-level meta-analysis. Lancet Respiartory Medicine. 2015;4(9):731–41. Doi:10.1016/S2213-2600(16)30148-5. E
51. Crim C., Dransfield M.T., Bourbeau J., et al. Pneumonia risk with inhaled fluticasone furoate and vilanterol compared with vilanterol alone in patients with COPD. Ann Am Thorac Soc. 2015;12(1):27–34. Doi: 10.1513/AnnalsATS.201409-413OC.
52. Contoli M., Pauletti A., Rossi M.R., et al. Long-term effects of inhaled corticosteroids on sputum bacterial and viral loads in COPD. Eur Respir J. 2017;50:1700451. Doi:10.1183/13993003.00451-2017.
53. Kim, J.-H., Park, J.-S., Kim, K.-H., et al. Inhaled Corticosteroid Is Associated With an Increased Risk of TB in Patients With COPD. Chest. 2013;143(4):1018–24. Doi:10.1378/chest.12-1225.
54. Brode, S.K., Campitelli, M.A., Kwong, J.C., et al. The risk of mycobacterial infections associated with inhaled corticosteroid use. Eur Respir J. 2017;50(3):1700037. Doi:10.1183/13993003.00037-2017.
55. Husta, B.C., Raoof S., Erzurum S., Mehta A.C. Tracheobronchopathy From Inhaled Corticosteroids. Chest. 2017;152(6):1296–305. Doi:10.1016/j.chest.2017.08.013.
56. Dransfield M.T., Bourbeau J., Jones P.W., et al. Once-daily inhaled fluticasonefuroate and vilanterol versus vilanterol only for prevention of exacerbations of COPD: two replicate double-blind, parallel group, randomized controlled trials. Lancet. Respir Med. 2013;1:21–3. Doi:10.1016/S2213-2600(13)70040-7.
57. Kardos P., Wencker M., Glaab T., et al. Impact of salmeterol/fluticasone propionate versus salmeterol on exacerbations in severe chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2007;175:144–49.
58. Izquierdo J.L., Cosio B.G. The dose of inhaled corticosteroids in patients with COPD: when less is better. International Journal of Chronic Obstructive Pulmonary Disease. 2018;13:3539–47. Doi:10.2147/COPD.S175047.
59. Papi A., Vestbo J., Fabbri L., et al. Extrafine inhaled triple therapy versus dual bronchodilator therapy in chronic obstructive pulmonary disease (TRIBUTE): a double-blind, parallel group, randomised controlled trial. Lancet. 2018;391(10125):1076-84. Doi:10.1016/S0140-6736(18)30206-X.
60. Ferguson G.T., Rabe K.F., Martinez F.J., et al. Triple therapy with budesonide/glycopyrrolate/formoterol fumarate with co-suspension delivery technology versus dual therapies in chronic obstructive pulmonary disease (KRONOS): a double-blind, parallel-group, multicentre, phase 3 randomised controlled trial. Lancet. Respir Med. 2018;6(10):747–58. Doi:10.1016/S2213-2600(18)30327-8.
61. Singh D., Papi A, Corradi M. Single inhaler triple therapy versus inhaled corticosteroid plus long-acting β2-agonist therapy for chronic obstructive pulmonary disease (TRILOGY): a double-blind, parallel group, randomised controlled trial. Lancet. 2016;388(10048):963–73. Doi:10.1016/S0140-6736(16)31354-X.
62. Agusti A., Fabbri L.M., Singh D. et al. Inhaled corticosteroids in COPD: friends or foe? Eur Respir J. 2018;52:1801219.
Автор для связи: А.В. Емельянов, д.м.н., профессор, зав. кафедрой пульмонологии СЗГМУ им. И.И. Мечникова, Санкт-Петербург, Россия; тел. +7 (812) 970-71-88, e-mail: aleksandr.emelyanov@szgmu.ru; Адрес: 191015, Россия, Санкт-Петербург, ул. Кирочная, 41
Scopus Author ID:
А.В. Емельянов https://www.scopus.com/authid/detail.uri?authorId=20234021200
Е.В. Лешенкова https://www.scopus.com/authid/detail.uri?authorId=6506343228
Г.Р. Сергеева https://www.scopus.com/authid/detail.uri?authorId=7003711035






