БА – довольно распространенное хроническое заболевание, диагностированное у 5% населения в мире [1]. В основе БА лежит аллергическое воспаление бронхов, сопровождаемое их гиперреактивностью, эпизодами обратимой бронхиальной обструкции, сопровождаемой приступами затрудненного дыхания или удушья, высокочастотными свистящими хрипами, особенно на выдохе, гиперсекрецией слизи, отеком стенки бронхов. БА – социальная и экономическая проблема, вызывает снижение качества жизни, приводит к развитию инвалидности, влияет на формирование здорового поколения. IgE-(иммуноглобулин Е)-опосредованные аллергические реакции немедленного типа в ответ на воздействие аллергенов приводят к формированию воспаления, гиперреактивности бронхов. Ig-опосредованная реакция может развиться не только на классические, но и на промышленные аллергены, металлы (никель, хром, формальдегид и др.). Неаллергические механизмы развития воспаления изучаются. Хроническое воспаление приводит к изменениям стенки бронхов – ремоделированию. У детей при развитии БА наиболее значимы ранняя сенсибилизация к ингаляционным аллергенам и вирусные инфекции респираторного тракта, особенно нижних дыхательных путей. Инициирующими воспаление сигналами при вирусных инфекциях является Th2-опосредованный локальный «цитокиновый шторм» (синтез интерлейкина-4 – ИЛ-4, -5, -13, фактора некроза опухоли α – ФНО-α, IgE, повышение экспрессии Fcε рецепторов 1-го, 2-го типов), провоцирующий распространение «от ткани к ткани» сенсибилизации к аллергенам и формирование аллергического воспаления [1]. Изучается роль вирусных инфекций как тригерного механизма в развитии БА [2, 3]; 95% острых респираторных инфекций (ОРЗ) вызываются вирусами, при этом полиморфизм вирусов достаточно выражен, включая адено-, коронавирусы, вирусы простого герпеса (ВПГ-1), вирус Эпштейна–Барр, ортомиксовирусы (грипп), парамиксовирусы (парагрипп), респираторно-синцитиальные (РС), энтеро-, риновирусы. Более 200 вирусов могут вызывать острые респираторные вирусные инфекции (ОРВИ), ОРЗ.
В России ежегодно регистрируют от 27 до 41 млн больных ОРЗ.
За последние годы расширились возможности диагностики вирусных инфекций (корона-, бока-, метапневмовирусы), вирусно-бактериальных и вирусно-вирусных ассоциаций [4–6]. Показана активация герпесвирусных инфекций у часто болеющих детей [7, 8]. Исследования микробиологов показывают, что в течение часа организм человека могут покидать до миллиона биологических частиц, которые рассеиваются в окружающем воздухе и во время вспышек инфекций вызывают их распространение. Вокруг человека может существовать «уникальный шлейф» из микроорганизмов, он может сохраняться несколько часов после его ухода [9]. Вирусы могут приводить к персистенции инфекции, это известно в отношении вирусов герпеса (ВПГ-1,2), цитомегаловируса, вируса Эпштейна–Барр и др. Показано, что вирусы гриппа, парагриппа, аденовирусы, РС-вирусы могут персистировать в организме после окончания острого периода заболевания [10, 11]. Необходимо помнить о респираторных инфекциях Mycoplasma pneumoniae и Chlamydia pneumoniae, которые также могут вызывать обострение БА, усиливать синтез IgE и гиперреактивность бронхов [12]. Вирусные инфекции при БА снижают мукоцилиарный клиренс, тонус гладкой мускулатуры бронхов, повреждают слизистые оболочки и повышают их проницаемость для инфекций и аллергенов, усиливают синтез IgE и гиперреактивность бронхов [13]. Аллергический и неаллергический ринит относят к факторам риска при БА. Хронический риносинусит и полипоз носа могут быть сопутствующими заболеваниями при БА. При проведении эндоскопии у больных хроническим риносинуситом и полипозом носа, аллергическим ринитом находят признаки бронхоспазма, при биопсии – эозинофильную инфильтрацию слизистых оболочек, повышение синтеза цитокинов ИЛ-3, -5, -4, гранулоцитарно-макрофагального колониестимулирующего фактора (ГМ-КСФ), энтеротоксина В Staphylococcus aureus. В опытах in vitro на мышах введение энтеротоксина В в нос усиливало эозинофильную инфильтрацию слизистых оболочек [14–16]. Эозинофилы определяют при БА в бронхо-альвеолярной лаважной жидкости, в слизистых оболочках при проведении биопсии в период обострения и ремиссии. Повышение уровней ИЛ-5 и эотаксина в очаге воспаления приводит в миграции эозинофилов и созреванию в костном мозге. ИЛ-4, -13, PAF (platelet activating factor), LTB4 (leukotriene B4) обеспечивают хемотаксис эозинофилов в очаг воспаления, а ГМ-КСФ необходим для поддержания жизни этих клеток. Активированные эозинофилы синтезируют главный основной белок (MBP – major basic protein) и эозинофильный катионный протеин (ECP – eosinophil cationic protein), который является маркером аллергического воспаления. Активность эозинофилов регулируется цитокинами, синтезируемыми Т-лимфоцитами (ИЛ-5, -3, ГМ-КСФ) и тучными клетками. Имеет значение синтез ИЛ-8, усиливающего хемотаксис нейтрофилов. Сами эозинофилы могут способствовать активации тучных клеток и фибробластов. Механизмы активации эозинофилов не совсем понятны, большое значение имеют Th2-цитокины ИЛ-3, -5, ГM-КСФ, хемокины и PAF [1, 2, 14–16].
Лечение и профилактика респираторных инфекций, вызывающих обострение БА, имеют большое значение для повышения качества жизни пациентов и профилактики прогрессирования заболевания. Имеющиеся вакцины против вируса гриппа, Streptococcus pneumoniae, Hаemophilus influenzae не могут обеспечить профилактику всех респираторных заболеваний и вирусных инфекций. Противовирусные препараты также не позволяют проводить эффективное лечение широкого спектра респираторных инфекций. Перспективны препараты, обладающие противовирусным и иммуномодулирующим действиями, например инозин пранобекс, Арбидол и др.
Целью данного исследования было изучение эффективности применения препарата инозин пранобекс (Изопринозин) в комплексной терапии детей со смешанной формой БА интермиттирующей, легкого течения у детей в острый период ОРЗ.
Материал и методы
Всего обследованы 60 детей (25 мальчиков и 35 девочек) со смешанной формой БА легкого течения, длительность заболевания составила не менее года. Возраст детей колебался от 6 до 15 лет (средний возраст – 8,2±2,7 года). Пациенты наблюдались в течение 6 месяцев до начала и в течение 6 месяцев после проведения исследования. Дети получали терапию при обострении БА (салметерол+флутиказон, мометазон, монтелукаст) курсами, в возрастных дозировках. Обострения БА наблюдались во время перенесенной ОРЗ и в период цветения при поллинозах. У 40 детей был диагностирован поллиноз. Диагноз БА был подтвержден, всем детям исследовали функцию внешнего дыхания (ФВД), делали кожные пробы, определяли уровень общего IgE. Результаты ФВД были изменены у 30 детей (снижение скорости воздушного потока по бронхам мелкого калибра). Уровень общего IgE колебался от 100 до 250 МЕ/мл, была выявлена сенсибилизация: у 30 детей – к пыльце деревьев, у 10 – к пыльце сорных трав, у 50 детей – к бытовым аллергенам. У всех детей наблюдались повторные ОРЗ (более 6 раз в год). Дети осмотрены педиатром, ЛОР-врачом, аллергологом-иммунологом. У 25 (41,6%) детей диагностирован хронический фарингит, у 10 (16,6%) – хронический риносинусит, у 30 (50%) – хронический тонзиллит, у 25 (41,6%) детей – аденоиды. До приема инозина пранобекс и развития ОРЗ детям исследовали показатели биохимии крови (уровни общего билирубина, аланинаминотрансферазы – АЛТ, аспартатаминотрансферазы – АСТ), общий анализ мочи.

Всем детям по месту жительства проведена санация очагов инфекции по показаниям, включая промывание лакун небных миндалин с применением растворов перманганата калия 1:5000, фурациллина, водных растворов хлорфиллипта, йодида калия. Для орошения слизистой оболочки небных миндалин и глотки применены препараты с антибактериальной активностью Гексорал или Стопангин, которые использовали в виде полосканий или вбрызгивания в глотку 2 раза в сутки на протяжении 10 дней. При диагностике хронического синусита и риносинусита катаральной формы в комплекс лечения добавлены назальные деконгестанты по возрастным показаниям и в возрастных дозировках (оксиметазолин, тетризолин) и муколитики с мукорегуляторным эффектом (ацетилцистеин+туаминогептан, карбоцистеин, ацетилцистеин), элиминационную терапию (Аква Марис, Физиомер и т.д.). Антибиотики с учетом чувствительности назначали в период обострения очагов инфекции при высевании из зева, носа или миндалин Streptococcus haemoliticus, S. pneumoniae, Klebsiella pneumoniae, Haemophilus influenzae при хроническом синусите и риносинусите. Инозин пранобекс (Изопринозин) назначали в острый период ОРЗ и обострения БА 30 детям по 50 мг/кг массы тела за 3–4 приема в сутки в течение 10 дней, 3 курса с интервалом 8 дней. Такую схему приема Изопринозина применяли у детей с повторными ОРЗ и хроническими заболеваниями носо- и ротоглотки [7]. Отбор детей проведен рандомизированно методом конвертов. В контрольной группе 30 детей не получали Изопринозин. Группы были сходными по полу, возрасту, сопутствующим заболеваниям. Субпопуляционный состав лимфоцитов периферической крови исследован стандартным методом с помощью моноклональных антител (МАТ) фирмы «Becton-Culter», включая определение относительного и абсолютного числа CD3+-, CD4+- , CD8+-, CD16+-, CD19+-, HLA-DR+-клеток. Кроме того, использован МАТ с двойной меткой фирмы «Becton-Culter»: CD3-HLA-DR+-, CD3+HLA-DR+-, CD3-CD16+-, CD3+CD16+-клетки методом прямой иммунофлуоресценции [17]. Пробы проанализированы на проточном цитометре Epics PROFILE-II (Cultronics). Для оценки иммунограммы использованы нормы, разработанные в ФГБУ ГНЦ «Институт иммунологии» ФМБА [17].
Концентрация сывороточных иммуноглобулинов (А, М, G) определена методом радиальной иммунодиффузии в геле по Манчини [17]. Исследование хемилюминесценции (спонтанная, индуцированная, индекс стимуляции) проведено по методике Porter [18]. Интерфероновый статус определен по стандартной методике методом иммуноферментного анализа (ООО «Цитокин», Россия).
Результаты исследования
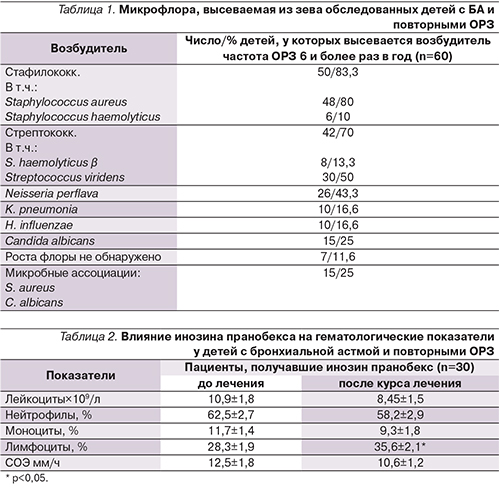
Результаты исследования микробиоты у детей представлены в табл. 1.
Дети обследованы до острого периода ОРЗ. S. haemoliticus, S. pneumonia, K. pneumoniae, H. influenzae не являются преобладающей бактериальной флорой для детей с БА смешанной формы, им была проведена антибактериальная терапия с учетом чувствительности до начала исследования.
У 50% детей инфекция была смешанной, высевалось несколько возбудителей. Полученные данные указывают на персистенцию бактериальной инфекции в ротоглотке. Были обследованы гематологические показатели детей с БА до и после приема препарата инозин пранобекс в течение 10 дней (табл. 2).
Динамика показателей не была достоверной, кроме повышения относительного числа лимфоцитов (р<0,05). Инозин пранобекс не оказал отрицательного воздействия на гематологические показатели в острый период ОРЗ. В общем анализе мочи и биохимии крови (общий билирубин, АЛТ, АСТ) на начало наблюдения и после приема инозина пранобекс в течение 10 дней выраженных изменений не наблюдали.
Были обследованы показатели иммунного статуса до начала приема инозина пранобекс и острого периода ОРЗ, а также после приема препарата (3 раза по 10 дней с интервалом 8 дней). У детей, получавших препарат, отмечено повышение иммунорегуляторного индекса – ИРИ (табл. 3).
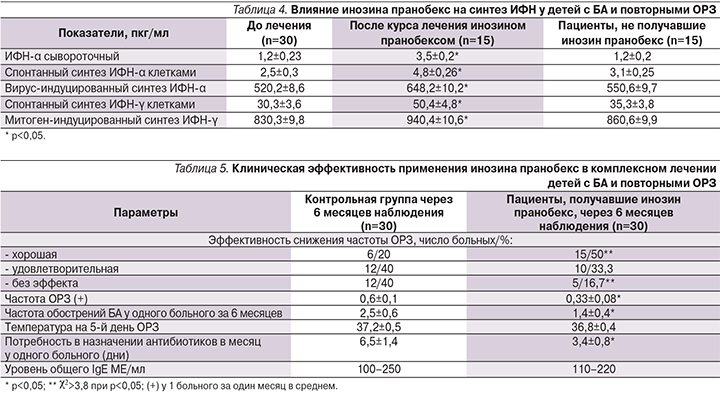
Показано влияние препарата на синтез интерферона (ИФН) у детей с БА. Дети были обследованы до начала приема препарата инозин пранобекс и острого периода ОРЗ, а также после приема инозина пранобекс (3 раза по 10 дней с интервалом 8 дней) по сравнению с контрольной группой (табл. 4). Показатели до лечения были объединены в одну колонку, т.к. были сходными. После курса лечения инозином пранобексом достоверно повышался сывороточный спонтанный синтез клетками вирус-индуцированного ИФН-α, а также спонтанный синтез митоген-индуцированного ИФН-γ (р<0,05). Все показатели были выше, чем в контрольной группе, не получавшей инозин пранобекс (р<0,05).
Была исследована клиническая эффективность инозина пранобекс у детей с БА и повторными ОРЗ за 6 месяцев наблюдения (табл. 5). Отмечено снижение частоты ОРЗ у детей, получавших инозин пранобекс. Разница достоверна при сравнении детей контрольной группы с хорошей эффективностью лечения и без эффекта с детьми, получавшими инозин пранобекс (χ2>3,8; р<0,05). Оценивали количество эпизодов ОРЗ за 6 месяцев наблюдения: отрицательный эффект (увеличение числа ОРЗ и обострений сопутствующих заболеваний более чем на 25%); без эффекта (изменение числа случаев ОРЗ и обострений сопутствующих заболеваний на 0–25%); удовлетворительный (снижение числа случаев ОРЗ и обострений сопутствующих заболеваний на 25–50%); хороший (снижение числа случаев ОРЗ и обострений сопутствующих заболеваний более чем на 50%). За 6 месяцев наблюдения до приема инозина пранобекс ОРЗ наблюдали у всех 60 пациентов и ОРЗ способствовало обострению БА. Снижена частота случаев ОРЗ в среднем на одного больного в месяц и потребность в назначении антибиотиков (р<0,05). На 5-й день острого периода ОРЗ температура у пациентов, получавших инозин пранобекс, была ниже (разница недостоверна). Прием инозина пранобекс не приводил к учащению обострений БА и повышению дозы ингаляционных кортикостероидов или антилейкотриеновых препаратов. Наблюдали снижение частоты обострений БА (р<0,05 по критерию Уитни–Вилкоксона–Манна). Через 6 месяцев наблюдения не наблюдалось повышения уровня общего IgE в обеих группах.
В последние годы уделяется большое внимание достижению контроля лечения БА, особенно у детей, что снижает смертность, инвалидизацию и повышает качество жизни пациентов, включая снижение ограничения физической активности. Современная терапия БА направлена также на уменьшение выраженности аллергического воспаления и развития ремоделирования бронхов. Широко изучаются триггерные факторы, среди которых далеко не последнее место занимают вирусные инфекции. В 2008 г. экспертами Европейской академии аллергологии и клинической иммунологии у детей старше 2 лет была выделена аллерген-, вирусиндуцированная астма, астма физического напряжения и неопределенная астма. Симптомы обструкции могут вызывать РС-вирус, риновирусы, вирусы гриппа А и В, парагриппа, адено-, корона-, энтеровирусы. Как правило, у детей доказаны проявления аллергии, сенсибилизация к аллергенам, сопутствующий аллергический ринит или атопический дерматит. Есть данные, согласно которым РС-вирус может вызывать обструкцию без наличия атопии [19]. Снижение мукоциллиарного клиренса, нарушение регуляции тонуса гладкой мускулатуры, повреждение эпителия слизистых оболочек, индукция гиперреактивности бронхов при вирусных инфекциях способствуют прогрессированию БА. При острых респираторных инфекциях (ОРИ) происходят ИЛ-4-индуцированное переключение CD8+-клеток на синтез ИЛ-5, снижение синтеза ИФН-γ и замедление выведения вируса из организма [13, 20]. Вакцинация детей с БА против гриппа в сочетании с вакциной Инфлювак и Рибомунилом позволила снизить частоту ОРИ за год и их длительность, число обострений БА, снизился синтез ИЛ-4 и повысился уровень ИФН-γ. У 68,4% детей улучшился контроль течения заболевания, что позволило снизить объем базисной терапии [21]. К сожалению, большой спектр возбудителей респираторных инфекций и отсутствие соответствующих вакцин не позволяют проводить вакцинацию.
В нашем исследовании был выбран инозин пранобекс, обладающий противовирусным и иммуномодулирующим действиями. Показана эффективность применения инозина пранобекс при БА у взрослых и ОРИ. Авторы отметили снижение частоты ОРИ, повышение объема форсированного выдоха за 1-ю секунду на 7-й день приема препарата, снижение выраженности сухих свистящих хрипов по сравнению с таковой в группе, не получавшей инозин пранобекс [22].
По данным M. Golebiowska-Wawrzyniak, Изопринозин снижает частоту рецидивирующих инфекций у детей с иммунодефицитами, при этом повышается число CD3+-, CD4+-клеток, функциональная активность Т-клеток в реакции бласттрансформации [23]. A. Jankowski и соавт. показали эффективность Изопринозина и климатотерапии детей с повторными респираторными инфекциями [24]. Л.В. Осидак и соавт. в исследованиях, проведенных на животных in vitro и in vivo в группе часто болеющих детей, показали чувствительность к Изопринозину вирусов гриппа типа В и птиц подтипа H5N2, РС-вируса (штамм Long), вирусов парагриппа.
В исследовании принимали участие 2503 часто болеющих ребенка. Применение Изопринозина во время ОРВИ снижало длительность лихорадочного периода, выраженность интоксикации и катаральных явлений, а также число эпизодов ОРВИ в течение 4 месяцев после курса [25]. По нашим данным, применение инозина пранобекс в острый период ОРЗ у детей с БА легкого течения смешанной формы улучшает показатели иммунного статуса, не приводит к повышению числа CD8+-клеток, но способствует повышению ИРИ, абсолютного числа CD4+-, CD3+CD16+-, CD3+HLA-DR+-клеток, уровня сывороточного IgA, IgM, показателей спонтанной и индуцированной хемилюминесценции, индекса стимуляции, повышает уровни ИФН-γ и ИФН-α (р<0,05). Прием инозина пранобекс не повышает уровень общего IgE, облегчает течение острого периода ОРЗ, снижает частоту и тяжесть ОРЗ, потребность в назначении антибиотиков, что в совокупности снижало частоту обострений БА за 6 месяцев наблюдения.


