Актуальность проблемы
Центральная роль печени в поддержании углеводного гомеостаза определяет ее ключевое участие в развитии глюкозотолерантности. Это объясняет взаимосвязь развития хронических заболеваний печени (ХЗП) при сахарном диабете 2 типа (СД2) и наоборот – развития СД2 при некоторых ХЗП. Сахарный диабет является одним из предикторов развития неалкогольного стеатогепатита (НАСГ) и фиброза печени у пациентов с НАЖБП, а также основным фактором риска развития цирроза печени (ЦП) на поздних стадиях заболевания [1–5]. Среди факторов риска развития НАЖБП сахарный диабет стоит на втором месте после ожирения. Несмотря на то что точная распространенность НАЖБП у пациентов с СД2 не известна, имеющиеся исследования показывают, что она колеблется между 49,6 и 74% [6, 7]. Распространенность НАЖБП у больных ожирением и СД2 достигает почти 100% [8, 9]. Последние исследования показали, что около 70%, или 2/3, больных СД2 при первичном обследовании имеют доказательства НАЖБП (по данным магнитно-резонансной томографии) и около 7% из них – выраженный фиброз печени (по данным магнитно-резонансной эластографии) [10–12]. Ранее считалось, что прогрессирование фиброза у пациентов с НАЖБП в стадии стеатоза наблюдается редко и до 90% пациентов с НАЖБП имеют доброкачественный прогноз, что не приводит к общему увеличению смертности [13–16]. В настоящее время восприятие НАЖБП в качестве заурядного и относительно доброкачественного состояния быстро меняется. Научные изыскания последних десятилетий показали, что НАЖБП представляет широкий спектр патологических изменений печени – от простого макровезикулярного стеатоза до ЦП в исходе прогрессирующего НАСГ и гепатоцеллюлярной карциномы (ГЦК). Около 50% пациентов с НАЖБП на момент постановки диагноза имеют НАСГ и до 19% – ЦП [17].
НАЖБП является частью синдрома инсулинорезистентности (ИР), одним из патогенетических звеньев развития метаболического синдрома. Ряд исследований четко демонстрирует, что распространенность НАЖБП у пациентов с СД2 увеличивается по сравнению с теми, у кого диабет отсутствует [18–20]. Около 30% пациентов имеют потенциально прогрессирующую форму НАЖБП – НАСГ. Примерно у 25–40% пациентов с НАСГ развивается прогрессирующий фиброз печени и в конечном счете – ЦП в 20–30% случаев из них [21–23]. Развитие ЦП за счет НАСГ связано с плохим долгосрочным прогнозом; так, десятилетняя смертность среди пациентов с ЦП, класс А по Child–Pugh, прослеживается в 20% случаев, в 45% развивается декомпенсация ЦП в течение 10 лет после постановки диагноза [24]. Пациенты с ЦП в исходе НАЖБП подвергаются значительному риску развития ГЦК (2,6% случаев в год) [25]. СД2 также ассоциируется с 2,9-кратным увеличением риска развития ГЦК [26].
Хорошо известное Веронское популяционное исследование причин смертности среди больных СД2, в котором оценивался стандартизированный коэффициент смертности, выявило наличие ЦП как одной из значимых причин смерти для данной категории больных (2,52 при ЦП по сравнению с 1,34 при сердечно-сосудистых заболеваниях) [27]. Несмотря на факт связи СД2 с патофизиологическими нарушениями в печени, включая повышение активности печеночных ферментов, наличие хронического заболевания печени (если только оно не находится в стадии декомпенсации) имеет незначительное влияние на терапию СД2.
В свою очередь наличие СД2 имеет малое воздействие на терапию хронического заболевания печени. Пациенты в стадии декомпенсации печени более восприимчивы к гипогликемии и требуют тщательного мониторинга. Однако остается необходимость в долгосрочных плацебо-контролируемых исследованиях терапии пациентов с НАЖБП и лечения СД2 у пациентов с хроническими заболеваниями печени.
При проведении масштабных научных исследований, которые позволяют определять роль НАЖБ в развитии СД2, трудности заключаются в выборе критериев диагностики НАЖБ, используемых при скрининге. Скрининг НАЖБП у пациентов с СД2 обычно включает определение стандартных функциональных печеночных проб. Ранее специалистами рассматривалось повышение уровня аминотрансфераз в качестве индикатора повреждения гепатоцитов. Однако детальные исследования выявили, что функциональные печеночные тесты слабо чувствительны к дифференциации пациентов с простым стеатозом и НАЖБП с нормальным уровнем печеночных ферментов [28]. Кроме того, известно, что НАЖБП может прогрессировать до фиброза без значительного повышения печеночных ферментов [29, 30]. Поэтому, вполне вероятно, что многие случаи НАЖБП у лиц с СД2 не определяются и прогрессирование заболевания печени часто упускается. СД2, резистентность к инсулину, ожирение, метаболический синдром и НАЖБП особенно тесно связаны. Ведение пациентов с СД2 требует мультидисциплинарного подхода, включающего не только участия эндокринологов, но и терапевтов, кардиологов, гепатологов.
В широкой клинической практике среди визуализирующих методик наиболее широко применяемо ультразвуковое исследование в силу свой доступности, низкой стоимости, неинвазивности и удобства в использовании. Значительное число исследований, подтвержденных гистологическим анализом, указывает на относительно высокую специфичность ультразвукового исследования, например почти 100%-ную специфичность при маковезикулярном стеатозе. К ограничениям метода следует отнести указания на недостаточную чувствительность и низкую специфичность при легкой степени стеатоза (при содержании жира в ткани печени менее 20%), невозможность количественной оценки стеатоза, вариабельность в показателях в зависимости от подготовки специалиста и различий в аппаратуре, а также невозможность определения стадии фиброза [31–33].
Относительно недавно предложены к применению прогностические индексы активности НАЖБП. Клинические проспективные наблюдения, проведенные во Франции в течение 9 лет с применением этих индексов в качестве предикторов НАЖБП, указывают на их высокую клиническую значимость для скрининга пациентов с высоким риском прогрессирования диабета [34, 35]. Однако в рутинной клинической практике данные прогностические индексы не рекомендованы.
Новые современные методы магнитно-резонансного исследования, такие как магнитно-резонансная спектроскопия, магнитно-резонансная эластография, приобрели достаточно высокую точность, однако их применение в клинической практике пока ограничено научными центрами. По-прежнему единственным точным методом диагностики НАЖБП до сегодняшнего дня остается пункционная биопсия печени (ПБП), которая позволяет оценивать индекс активности НАЖБП с учетом индекса стеатоза по системе, предложенной Brunt, индекс гистологической активности и фиброз печени по шкале METAVIR [36–39]. Группа американских исследователей с целью оценки эффективности применения современных диагностических моделей для НАЖБП провели опрос среди гастроэнтерологов и гепатологов США. Было обнаружено, что, несмотря на то что ПБП остается «золотым» стандартом диагностики, она выполняется менее чем в 25% случаев [40].
Имеющиеся потенциальные ограничения и осложнения ПБП (инвазивность, высокая стоимость, неудовлетворительная воспроизводимость, возможные ошибки при недостаточном количестве материала, потенциальный риск осложнений; отсутствие мотивации у пациентов с НАЖБП для проведения исследования, в т.ч. в динамике) привели к активному интересу клиницистов к неинвазивным методам диагностики. Таким примером является оценка фиброза с помощью транзиентной фиброэластометрии печени (ФЭ) и фибротестов. Согласно Практическим рекомендациям Европейской ассоциации по изучению заболеваний печени (European Association for the Study of the Liver, EASL, (2015), ФЭ может считаться стандартом неинвазивного теста для измерения эластичности печени (уровень доказательности A1), высокодостоверна при вирусных гепатитах (A1), чуть менее достоверна при НАЖБП и других ХЗП (A1), обладает большей эффективностью для обнаружения ЦП, чем при обнаружении стадий фиброза (A1). Алгоритм сочетания ФЭ и серологических биомаркеров представляется наиболее привлекательным и достоверным (A2). Однако данная стратегия требует дополнительной доказательной базы для пациентов с НАЖБП (A1). Рекомендуется проведение скрининга фиброза печени всем пациентам с НАЖБП, особенно при метаболическом синдроме и/или СД2, когда риск фиброза повышен (A1) [41]. В основе ФЭ печени лежит физический метод, позволяющий определять эластичность печени и проводить корреляцию со степенью фиброза при ХЗП, в т.ч. и НАЖБП [42–44].
Существуют ограничения применения ФЭ пациентами с НАЖБП. Результаты могут быть недействительными для пациентов с выраженным ожирением (ИМТ >35 кг/м2) и СД2. Известно, что на точность метода влияет активность воспалительного процесса в ткани печени, а также, что эластометрия печени – оператор-зависимый метод исследования [45–47]. Фибротесты (ФТ) относятся к биологическому методу, при котором проводится количественная оценка сывороточных (серологических) маркеров. ФТ представляют несколько не специфичных для печени серологических и клинических параметров, ассоциирующихся с различными стадиями фиброза печени. ФТ являются коммерческой панелью биохимических маркеров фиброза, имеют хорошую межлабораторную воспроизводимость, потенциальную повсеместную доступность [48]. Ряд клинических исследований демонстрирует, что ФТ могут быть полезными для скрининга продвинутого фиброза у пациентов с СД2 старше 46 лет [49–52].
Несмотря на то что ФЭ и ФТ разрешены в качестве неинвазивных методов оценки фиброза печени при некоторых нозологических формах ХЗП, а также при скрининге фиброза печени у пациентов с СД2, одна из нерешенных проблем их использования данной категорией пациентов – выявление независимых факторов риска развития фиброза печени и определение стратегии скрининга в общей популяции.
Материал и методы
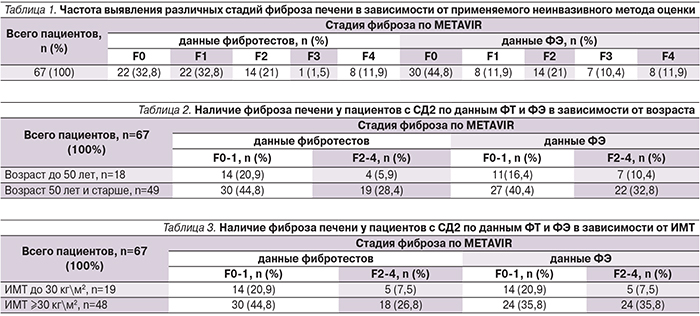
В условиях Московского клинического научно-практического центра (ГБУЗ МКНЦ ДЗМ) было проведено исследование по скрининговой оценке фиброза печени у пациентов с СД2 с помощью неинвазивных методов, с анализом возможных факторов риска, приводящих к развитию продвинутых стадий фиброза печени (≥F2) у данной категории больных. За период с марта по май 2015 г. комплексно обследованы 67 пациентов (37% мужчин и 63% женщин) в возрасте от 30 до 82 лет. Все пациенты находились на лечении в эндокринологическом отделении с диагнозом «сахарный диабет 2 типа». В исследование не включались пациенты с положительными маркерами HBsAg и/или a-HCV. Кроме рутинных методов исследования всем пациентам проведена оценка фиброза печени с помощью непрямой ультразвуковой ФЭ, а также исследование сывороточных маркеров с помощью ФТ. Стадии фиброза оценивались в соответствии с рекомендациями производителя: по данным ФЭ, значение 7,3 кПА расценивалось как стадия фиброза 2 по шкале METAVIR (≥F2), а 12,5 кПа и выше – как F4, стадия ЦП. Панель ФТ включает алгоритм определенных показателей сыворотки крови (AЛT, глюкоза, триглицериды, холестерин, общий билирубин, гаммаглутамилтранспептидаза, α2-макроглобулин, аполипопротеин A1, а также пол, возраст, ИМТ). Согласно рекомендациям разработчиков панели ФТ, мы расценивали значение ≥0,48 как ≥F2, ≥0,75 как F4 по шкале METAVIR, значение S >0,69 как стеатоз 2–3-й степеней (>32% гепатоцитов со стеатозом, согласно histological scoring system) [53–57].
Оценивались применимость и диагностическая эффективность ФЭ и ФТ без использования ПБП. Оценку их диагностической значимости проводили с помощью построения характеристических кривых (ROC-анализ), достоверность взаимосвязи оценивали по площади под характеристической кривой AUROC (площадь, ограниченная ROC-кривой: area under the receiver operating characteristic curve): от 0,9 до 1,0 – как отличную, от 0,8 до 0,9 – как очень хорошую, от 0,7 до 0,8 – как хорошую, ниже 0,7 – как удовлетворительную. Рассчитывали чувствительность и специфичность тестов для определения стадии фиброза (F). Проводили корреляционный анализ фиброза по ФТ и ФЭ с корреляционной оценкой различных факторов (ИМТ, возраст, пол, АЛТ и др.) на стадии фиброза печени с помощью однофакторного дисперсионного анализа и множественного логистического регресса.
Результаты исследования
Пациенты старше 50 лет составили 73%; не имевшие ожирения – 28%, лица с ожирением – 72%, из них 1-я, 2, 3-я степени ожирения были выявлены у 54, 29 и 17% соответственно. Оказалось, что пациенты, которые вообще не имели стеатоза печени (S–0), составили 4,4% (по данным ФТ), остальные имели преимущественно 2-ю и 3-ю степень стеатоза (27 и 61% соответственно).
У пациентов с СД2, по данным неинвазивных методов, ЦП был выявлен в 11,9% случаев. Из них в 9% ЦП диагностирован обоими методами. Расхождение в обнаружении ЦП отмечено у 2 человек: по ФТ определен F4, а по ФЭ – F3. Почти в 66% случаев фиброз печени отсутствовал по данным ФТ и в 57% по ФЭ. Значимый фиброз 2-й стадии по METAVIR (F2) был диагностирован в 21% случаев по данным как ФТ, так и ФЭ (табл. 1).
У пациентов до 50 лет (27%) ФП диагностирован в 6% случаев по ФТ и в 10% по ФЭ (табл. 2). У пациентов старше 50 лет (73%) значимый ФП выявлен в 28,4% случаев по ФТ и в 32,8% по ФЭ.
У пациентов без ожирения (ИМТ до 30 кг/м2) фиброз печени отсутствовал почти в 21% случаев по данным ФТ и ФЭ (табл. 3).
Значимый фиброз (F2-4) у пациентов с ожирением по ФТ был диагностирован в 26,8% случаев и в 35,8% – по ФЭ. У пациентов без ожирения фиброз печени не диагностировался у 7,5% пациентов по данным как ФЭ, так и ФТ. Качество и достоверность ФТ и ФЭ по данным ROC-анализа расценивается как хорошая: AUROC – 0,7 и AUROC – 0,8, соответственно. Достоверность ФТ и ФЭ для стадии F4 оценивается как очень хорошая (AUROC для F4 – 0,86).
С помощью однофакторного дисперсионного анализа получили, что на прогноз ФП, по данным ФТ, влияют: пол, AЛT, стеатоз, а по данным ФЭ – дополнительно еще и ИМТ.
Заключение и выводы
Пациенты с СД2 имеют высокий риск развития НАЖБП, заболевания с широким спектром клинических и морфологических признаков: от стеатоза и стеатогепатита с развитием фиброза с исходом в ЦП. Оценка фиброза печени у 67 пациентов с СД2 показала, что у 11,7% пациентов при случайной выборке выявлен ЦП. Полученные данные указывают на то, что наличие СД2 является фактором риска прогрессирования фиброза, что требует проведения скрининга на фиброз и стеатоз печени у пациентов данной категории. Неинвазивные тесты обладают хорошей диагностической точностью при определении ЦП. Необходимы дальнейшие исследования для выявления предикторов прогрессирования фиброза и стеатоза печени.



