Введение
Принятые в Европе четыре Маастрихтских консенсуса (1996, 2000, 2005, 2010) четко обосновали правомочность диагностики и лечения инфекции Helicobacter pylori [1]. За этот период опубликован ряд дискутабельных статей, посвященных разносторонним вопросам оптимизации эффективности эрадикационной терапии H. рylori [2–6]. Негативное и скептическое отношение некоторых врачей к необходимости проведения эрадикационной терапии служит одной из значимых причин снижения эффективности лечения H. рylori-инфекции. Подобное отношение врачей к необходимости проведения эрадикационной терапии, возможно, связано со скептицизмом ряда авторов по отношению к участию H. рylori в гастральных и внегастральных проявлениях инфекции с позиции доказательной медицины [7, 8]. Данный факт в действительности имеет место и подтверждается исследованиями J.P. Gisbert и соавт. (2009) [9], из которых делается следующий вывод: язвы, не ассоциированные с H. рylori, вызванные приемом нестероидных противовоспалительных средств и другими факторами, очевидно, должны по-настоящему рассматриваться как «идиопатические». В отношении пациентов с H. рylori и отрицательными результатами исследования следует более тщательно убедиться в оценке H. рylori-статуса, что в свою очередь вызывает необходимость выбора надежного метода диагностики или комплекса диагностических тестов. В другом исследовании (N. Kalach, S. Papadopoulos и соавт., 2009) [10] показано, что только 10,66 % французских детей с первичным гастритом были H. рylori-позитивные, при этом гистологические различия у H. рylori-позитивных и H. рylori-отрицательных детей носили умеренный однотипный характер.
В настоящее время появилась необходимость установления единого эффективного подхода к диагностике и терапии инфекции H. рylori, основанного на опыте лучших европейских и отечественных исследователей. В контексте диагностики инфекции Н. рylori приоритет должен отдаваться неинвазивным методикам – мочевинным дыхательным тестам (МДТ) [1], среди которых наиболее информативным остается 13С-МДТ по своей высокой специфичности, чувствительности и точности не уступающий гистологическому методу определения Н. рylori в желудке, что позволяет рекомендовать его как для первичной диагностики, так и для контроля эффективности эрадикации микроорганизма [1, 3, 5]. С целью диагностики Н. рylori 13С-МДТ рекомендован консенсусом Маастрихт-IV (2010) [1] и освещен в ряде публикаций отечественных авторов [11–13]. Что же касается лечения, то с учетом отсутствия принципиально новых препаратов для лечения инфекции H. рylori в арсенале клинициста особую актуальность приобретают аспекты оптимизации существующих эрадикационных схем. На сегодняшний день можно констатировать, что включение висмута трикалия дицитрата (ВТД) в состав схем эрадикационной терапии служит одним из наиболее эффективных и доступных способов оптимизации лечения инфекции H. рylori, что опосредовано его многокомпонентным механизмом действия на микроорганизм (см. рисунок). В среднем включение ВТД четвертым компонентом в схему стандартной тройной эрадикационной терапии способствует повышению ее эффективности на 15–20 % [4]. Однако в современной медицине помимо клинической эффективности целесообразно опираться и на экономические аспекты успешной терапии инфекции Н. рylori [14]. Рекомендуемые схемы лечения включают дорогостоящие антибиотики и антисекреторные препараты. В рассмотрении фармакоэкономических аспектов лечения необходимо учитывать потенциальную эффективность эрадикационных схем с учетом суммарных затрат на приобретение отдельных препаратов, а также стоимость других средств в случае неудачной эрадикации, частоту рецидивов, осложнений и расходы на их лечение.
 На текущий момент наиболее простым методом, позволяющим изучать данный аспект лекарственной терапии, является расчет стоимости применения одной или нескольких медицинских технологий (или лекарственных средств) и их прямое сравнение. Анализ «затраты–эффективность» выражается через затраты на единицу эффекта. Наиболее эффективно вмешательство с наименьшим коэффициентом затратной эффективности. Этот подход особенно полезен для принятия решений в условиях ограниченного бюджета и особенно применим к амбулаторным условиям [15]. Цель настоящего исследования составила оценка фармакоэкономической эффективности лечения пациентов с H. рylori-ассоциированными заболеваниями при использовании шести схем эрадикационной терапии.
На текущий момент наиболее простым методом, позволяющим изучать данный аспект лекарственной терапии, является расчет стоимости применения одной или нескольких медицинских технологий (или лекарственных средств) и их прямое сравнение. Анализ «затраты–эффективность» выражается через затраты на единицу эффекта. Наиболее эффективно вмешательство с наименьшим коэффициентом затратной эффективности. Этот подход особенно полезен для принятия решений в условиях ограниченного бюджета и особенно применим к амбулаторным условиям [15]. Цель настоящего исследования составила оценка фармакоэкономической эффективности лечения пациентов с H. рylori-ассоциированными заболеваниями при использовании шести схем эрадикационной терапии.
Материал и методы
Всего в исследование было включено 231 (ITT-intention-to-treat – пациенты, получающие антихеликобактерную терапию по протоколу) и 229 (PP per protocol – все пациенты, выполнившие требования протокола, т.е. закончившие назначенное лечение) больных, из них 106 с язвенной болезнью луковицы двенадцатиперстной кишки, 2 – с язвенной болезнью желудка, 90 – с эрозивным гастритом и 31 пациент – с неатрофическим гастритом. Все получившие различные схемы антихеликобактерной терапии больные проходили лечение в амбулаторных условиях, без отрыва от работы. Расчет стоимости лечения проведен только с учетом прямых затрат на медикаментозное обеспечение. При расчете прямых затрат на лечение учитывалась только стоимость лекарственных средств, поскольку очевидно, что в условиях российского здравоохранения именно разница в цене лекарств обусловит различия в общей стоимости лечения. Перед нами стояли две основные цели: уничтожение H. рylori и заживление эрозивно-язвенных изменений слизистой оболочки желудка и луковицы двенадцатиперстной кишки. Пациенты амбулаторно получали одну из шести схем эрадикационной терапии (О-омепразол, А-амоксициллин, К-кларитромицин, Д-ВТД, Р-рабепрозол, М-метронидазол, Э-эзомепразол): ОАК, РДМА, РДКА, ЭДКА, последовательная терапия ОАКМ, модифицированная последовательная терапия ОАКМД. Основной задачей текущего анализа стал выбор варианта эрадикационной терапии с наименьшим коэффициентом затратной эффективности (Cost-Effectiveness coefficient), по сути – удельной стоимости в расчете на единицу эффекта. Коэффициент затратной эффективности (Keff) нами рассчитывался для всех схем лечения путем отношения стоимости к эффективности лечения: Кeff = Cost/Eff, (где Cost – средние суммарные затраты, Eff – эффективность, %).
При поступлении к проведению анализа нами был проведен расчет стоимости одной таблетки (капсулы) лекарственного препарата, входящего в схему антихеликобактерной терапии (табл. 1).
Затем нами был проведен расчет стоимости каждой схемы антихеликобактерной терапии (табл. 2).
Завершающим этапом нашего анализа был проведен расчет эффективности каждой схемы антихеликобактерной терапии. Критерием эффективности была выбрана частота эрадикации H. рylori при применении рассматриваемых схем антихеликобактерной терапии (табл. 3).
Результаты и их обсуждение
Наименее эффективной схемой по частоте наступления эрадикации оказалась классическая тройная схема лечения (ОАК) – 71,8 %, что может быть связано с ростом резистентности H. рylori к кларитромицину. Вместе с тем использование препарата висмута в качестве четвертого компонента в других схемах лечения позволяет повышать эффективность эрадикации до допустимого уровня – 80 % – по-видимому, за счет эффекта висмута на преодоление резистентности H. рylori к кларитромицину и метронидазолу [16]. Для этого мы рассчитали коэффициент затратной эффективности и провели фармакоэкономический анализ методом «затраты–эффективность» для всех применяемых шести схем антихеликобактерной терапии.
Проведенный фармакоэкономический анализ по этому параметру показал, что модифицированная последовательная терапия ОАКМД была экономически более рентабельной по сравнению с другими схемами, т.к. имела меньший коэффициент затратной эффективности – 14. Вместе с тем общепризнанно, что в настоящее время в нашей стране использование метронидазола в тройных схемах эрадикации без препаратов висмута недопустимо из-за высокой резистентности H. рylori к данному компоненту эрадикационной терапии. В данном случае использование препарата висмута позволяет, по-видимому, преодолевать резистентность H. рylori к метронидазолу. При рассмотрении вопроса о возможном преодолении резистентности к метронидазолу за счет включения препарата висмута в другие схемы эрадикационой терапии было обнаружено, что данная ситуация действительно имеет место. Так, схема РДМА позволяет преодолевать 80 %-ный барьер эрадикационной терапии – 82,4 %, однако коэффициент затратной эффективности в данном случае составляет 21,5. Последовательная терапия ОАКМ также позволяет преодолевать 80 %-ный барьер эрадикационной терапии (84,8 %), коэффициент затратной эффективности – 10,8, но, как уже было сказано выше, включение препарата висмута способствует получению более значительного эффекта лечения и составляет 95,4 %. Расчет общей стоимости и экономической эффективности схем лечения представлен в табл. 4.
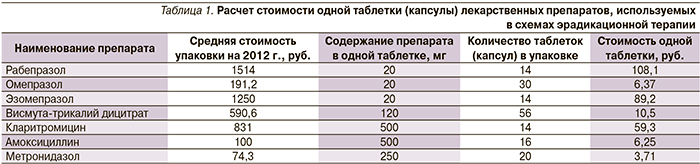
Наиболее дорогой оказалась схема лечения ЭДКА с самым высоким коэффициентом затратной эффективности – 36,9. Рассматривая все схемы, применяемые в наших исследованиях, хотелось бы отметить, что наиболее эффективной и с наименьшим коэффициентом затратной эффективности является схема РДКА, где Keff составляет 29,0, а эффект лечения – 96,7 %.
Для принятия решения о выборе терапии необходимо руководствоваться одним из двух подходов:
- наименьшей стоимостью, выбирается терапия ОАК – 10 (20 ЕД, 438,4 руб.);
- наибольшей эффективностью, выбирается терапия РДАК – (29 ЕД, 2812 руб.)
В нашем исследовании практикующему врачу предлагается выбор альтернативных схем лечения с точки зрения «затраты–эффективность» при сохранении трех основных тесно связанных между собой положений: клиническую эффективность, безопасность и экономическую эффективность лечения. Обычно при принятии решения о выборе терапии проведение анализа стоимость/эффективность целесообразно, если есть возможность и необходимость выбирать между стоимостью терапии и величиной ее эффективности. В некоторых случаях такая возможность может полностью отсутствовать или быть нецелесообразной. Подобная ситуация может сложиться в условиях сильно ограниченного бюджета, что случается очень часто, приводя к тому, что приходится использовать наиболее дешевую терапию, в то время как неограниченный бюджет позволяет выбирать лечение с наибольшей эффективностью. Сюда можно также отнести случаи, когда эффективность терапии не может быть ниже определенного значения (ниже 80 % эрадикации), поскольку это может приводить к осложнениям, неэффективной эрадикации и в последующем – назначению более дорогостоящего лечения. При проведении последующего анализа стоимость/эффективность обращает на себя внимание тот факт, что пять схем эрадикации содержат, на наш взгляд, наиболее важный компонент из предлагаемой нами терапии – препарат висмута. Препарат висмута не только уничтожает Н. pylori, но и восстанавливает нарушенные механизмы репаративной регенерации. Бактерицидное действие препарата висмута предотвращает первичную и развитие вторичной резистентности Н. рylori к антибиотикам. Бактерий, резистентных к препаратам висмута, не выявлено.
Причинами возникновения приобретенной резистентности у H. рylori служат:
- увеличение числа пациентов, принимающих неадекватную эрадикационную терапию;
- низкие дозы антибактериальных средств;
- короткие курсы лечения;
- неправильная комбинация препаратов в схеме;
- бесконтрольное использование антибактериальных средств в популяции по другим нозологиям.
К основным путям профилактики и преодоления резистентности H. рylori относится использование адекватной терапии больных, которые лечатся впервые «стандартными» схемами.
Применение препаратов висмута пациентами с резистентными штаммами (квадротерапия), семейная терапия (ликвидация взаимообмена резистентными штаммами), изменение стратегии лечения H. рylori-инфекции с использованием комбинации антибиотиков и антибактериальных препаратов – пути повышения эффективности эрадикационной терапии. Конечно, первым логическим шагом в случае неудачной первичной эрадикации было бы определение чувствительности H. рylori к антибиотикам. В соответствии с рекомендациями IV Маастрихтского соглашения выбор схемы эрадикационной терапии первой линии должен определяться по уровню резистентности H. рylori к кларитромицину. В регионах, где уровень резистентности к кларитромицину менее 15 %, может использоваться стандартная трехкомпонентная терапия с кларитромицином [1]. К сожалению, даже в США и других развитых странах это тестирование пока широко не применяют [17]. Если же такая возможность имеется, тестирование на чувствительность, безусловно, следует проводить. Возможной альтернативой сегодняшнего дня является классическая терапия: ингибиторы протонной помпы (ИПП) + амоксицилин + кларитромицин + препарат висмута, позволяющая модифицировать первую линию лечения и в последующем отказаться от проведения второй линии лечения. Результаты исследования свидетельствуют, что при применении квадротерапии у 21 % пациентов не было зарегистрировано побочных эффектов, у 51 % больных они были в легкой форме, у 4 % наблюдалось выраженное побочное действие, которое, тем не менее, не потребовало отмены лечения.

Не менее важен выбор ИПП, эффективное использование которых (выбор препарата, схема назначения) позволяет предотвращать деградацию антибиотиков в кислой среде желудка [18]. Одновременно в присутствии препарата висмута и антисекреторных препаратов замедляется всасывание антибиотиков, обеспечивая тем самым их депонирование в желудке и длительный антибактериальный эффект. В нашем случае рабепразол и эзомепразол являются оптимальными ИПП, позволяющими на достаточном уровне оказывать мощное ингибирующие действие на секрецию соляной кислоты. Таким образом, квадротерапию и модифицированную последовательную терапию препаратами висмута на сегодняшний день можно считать наиболее эффективным методом лечения хеликобактерной инфекции, вызванной различными штаммами Н. pylori, включая и экономический аспект. Пациент должен осознавать, что хеликобактерная инфекция повреждает слизистую оболочку желудка и/или двенадцатиперстной кишки. Эрадикация инфекции с использованием препарата висмута в схемах лечения ведет к заживлению эрозивно-язвенного дефекта и излечению от хеликобактериоза, как правило, за один курс терапии, экономя таким образом средства.
В России данная четырехкомпонентная схема в составе ВТД, ИПП, амоксициллина и кларитромицина уже рекомендована ведущими экспертами в качестве одного из вариантов терапии первой линии при лечении хеликобактериоза [19]. Стоит добавить, что благодаря выраженным цитопротективным и противовоспалительным свойствам висмута [20] она показана не только при эрозивно-язвенных поражениях желудка и двенадцатиперстной кишки, но и при хроническом хеликобактерном гастрите, для купирования явлений воспаления и предотвращения прогрессирования атрофии. Заменит ли четырехкомпонентная терапия тройную терапию на основе ИПП в качестве первичной схемы лечения, является предметом дискуссий, поскольку контролируемых исследований пока недостаточно.
Заключение
Резюмируя результаты исследования, можно сделать следующий вывод: четырехкомпонентная терапия с препаратами висмута на сегодняшний день считается наиболее эффективным методом лечения хеликобактерной инфекции, вызванной различными штаммами Н. pylori, включая резистентные к кларитромицину и метронидазолу.
К основным преимуществам следует отнести высокий процент эрадикации Н. pylori (до 98 %) независимо от чувствительности бактерий к антибиотикам. Использование стандартной классической тройной терапии (ОАК) сопровождается низкой эрадикационной эффективностью – 71,8 %. При лечении больных Н. pylori-ассоциированными заболеваниями включение препарата висмута повышает клинико-экономическую эффективность эрадикационной терапии. Модифицированная последовательная терапия с препаратом висмута позволяет добиваться преодоления резистентности к кларитромицину и метронидазолу с хорошим показателем «затраты–эффективность».



