Каждый год в мире диагностируется около 900 тыс. новых случаев рака желудка (РЖ), являющегося одной из ведущих причин смертности от онкологической патологии [1]. Значительные успехи в понимании канцерогенеза в желудке были достигнуты после предложения Р. Correa каскада, объясняющего патогенетическую цепочку этой патологии. [2]. Несмотря на тенденцию снижения заболеваемости РЖ в Западной Европе и Северной Америке, борьба с этой патологией продолжает оставаться одной из ведущих целей в гастроэнтерологии [3]. Следует подчеркнуть, что механизмы патогенеза РЖ до настоящего времени остаются недостаточно ясными. Нет очевидных объяснений выраженным этническим колебаниям заболеваемости РЖ [4]. Все это обусловливает актуальность новых исследований в рамках указанной проблемы.
Материал и методы
С целью скрининга терапевтических заболеваний был осуществлен клинический осмотр 328 жителей п. Матур и Анчуль Таштыпского района Республики Хакасия в возрасте от 30 до 49 лет (161 европеоида – 76 женщин, 85 мужчин; и 167 хакасов – 90 женщин, 77 мужчин) одномоментным (поперечным) методом. Средний возраст европеоидов был равен 39,6, монголоидов – 40,2 года. 259 пациентам (127 европеоидов – 60 женщин, 67 мужчин; и 132 хакасов – 71 женщина, 61 мужчина) была выполнена фиброгастродуоденоскопия с забором биопсий из антрального отдела, большой кривизны и малой кривизны тела желудка. Обследование пациентов осуществлено при подписании ими добровольных информированных согласий, согласно Хельсинкской декларации Всемирной медицинской ассоциации, регламентирующей проведение научных исследований.
Качественная световая микроскопия препаратов слизистой оболочки желудка (СОЖ) после окраски гематоксилином и эозином проведена 127 европеоидам и 132 хакасам с гастритом, а также 51 европеоиду и 32 хакасам с РЖ (забор биопсий проведен из зон, не пораженных опухолью), находившихся на лечении в онкологическом диспансере. Для оценки морфологических изменений СОЖ использовали разработанную на основе Сиднейской классификации хронического гастрита визуально-аналоговую шкалу для определения выраженности воспаления, активности процесса, наличия атрофии, кишечной метаплазии и степени обсемененности Helicobacter pylori [5]. H. рylori исследовали двумя методами – морфологическим и уреазным [6].
Статистическая обработка полученных результатов была осуществлена на персональном компьютере при помощи пакета SPSS, разработанного в Стэндфордском университете (США). Достоверность различий относительных показателей анализировали с помощью вычисления отношения шансов. Достоверным считался уровень значимости различий при р≤0,05.
Результаты и обсуждение
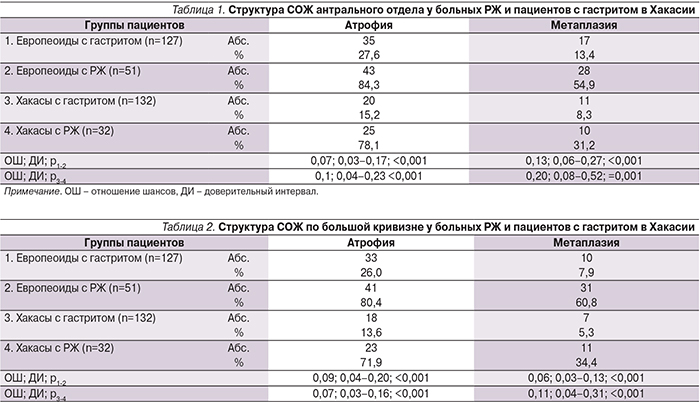
Мы изучали структуру СОЖ у больных РЖ и пациентов с гастритом.
В антральном отделе в обеих популяциях у больных РЖ частота атрофии и метаплазии значительно превышала таковую у пациентов с гастритом. Интерес представляет то обстоятельство, что частота метаплазии у европеоидов с РЖ была значительно более высокой, чем у хакасов (табл. 1).
В теле желудка наблюдались аналогичные закономерности (табл. 2). То есть у больных РЖ частота атрофии и метаплазии была значительно более высокой, чем в контрольной группе пациентов с гастритом. Сохранялись и различия при сравнении европеоидов и хакасов.
У пришлых жителей, страдавших РЖ, частота метаплазии была выше в 1,8 раза, чем у коренного населения. Таким образом, каскад Correa «работал» в обеих популяциях, но имел определенные этнические особенности.
Мы проанализировали частоту выявления H. pylori у больных РЖ. При этом выяснилось, что частота обнаружения H. pylori в слизистой оболочке антрального отдела желудка в обеих популяция была при дистальном РЖ выше, чем при проксимальной локализации опухоли. Так, H. pylori определены у 84,6% европеоидов с дистальным РЖ и у 56% европеоидов с проксимальным раком (ОШ=3,97; ДИ – 1,11–14,18; p=0,05). У хакасов эти показатели составили 88,9 и 50% соответственно (ОШ=5,80; ДИ – 1,12–30,04; p=0,05). Эта информация имеет большое научное и практическое значение, т.к. как создает базу для дальнейших научных исследований и реальной профилактики РЖ.
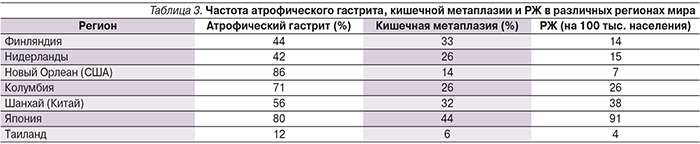
Для интерпретации и оценки степени новизны этих данных следует привести результаты работы Y. Liu и соавт. (2000). Данное исследование охватывало 1991 пациента с хеликобактерной инфекцией из 7 географических зон мира. Оценивались распространенность атрофического гастрита, кишечной метаплазии и РЖ (табл. 3) [7]. Авторы обнаружили, что в большинстве обследованных популяций каскад Correa эффективно описывал полученные результаты. Это относилось к Китаю, Японии, Колумбии, Таиланду и европейским странам. Однако результаты обследования чернокожего населения США не укладывались в рамки прямой связи между компонентами каскада Correa. Авторы логично сделали вывод о влиянии этнических факторов на функционирование каскада Correa.
Полученные результаты подтверждают идею справедливости представлений о H. pylori и каскаде Correa как о ведущих этиопатогенетических факторах развития РЖ. В связи с этим рекомендации современных руководств о необходимости своевременной диагностики атрофического гастрита и эрадикации H. pylori, обязательны для повсеместного исполнения в практическом здравоохранении [8, 9]. При этом необходимо учитывать современные тенденции в отношении методов эрадикации H. pylori, которые в России базируются на относительно низкой резистентности этого микроорганизма к кларитромицину и вытекающей из этого приоритетности тройной схемы терапии [10, 11]. Определенное влияние на методы эрадикации и понимание патогенеза гастродуоденальных заболеваний могут оказывать представления о взаимодействии H. pylori с другой микрофлорой желудочно-кишечного тракта [12].
Еще один важный вывод нашей работы заключается в подтверждении существования этнических особенностей в реализации каскада Correa, которые могут в некоторой степени объяснить региональные различия в заболеваемости РЖ. Несомненно, что очень перспективной проблемой является исследование генетических аспектов карциногенеза [13, 14].



