По данным экспертов Всемирной организации здравоохранения, в мире анемией страдают около 1,6 млрд человек, или 24,8% от общего населения [1]. Значительная доля случаев анемии связана с дефицитом железа [2], который может быть следствием недостаточного поступления его с пищей, в частности при хроническом алкоголизме, повышенной потребности (детский и подростковый возраст, беременность, послеродовый период), хронической кровопотере, нарушениях всасывания (например, при воспалительных заболеваниях кишечника) [3]. При функциональном дефиците железа, например при лечении стимуляторами эритропоэза, нормальное или даже повышенное общее содержание его в организме оказывается недостаточным на фоне увеличения потребности в железе костного мозга [4]. В регуляции обмена железа принимает участие гепсидин, который синтезируется в печени и подавляет всасывание железа в кишечнике и его высвобождение из депо и макрофагов [5]. Повышение концентрации гепсидина способствует развитию анемии при хронических заболеваниях, нефрогенной анемии с возможной резистентностью к стимуляторам эритропоэза [6].
 Анемия встречается у трети женщин репродуктивного возраста, а во время беременности ее частота достигает 23–52% [2]. У женщин железодефицитная анемия (ЖДА) чаще всего развивается при обильных и длительных менструациях (более 5 дней), дисфункциональных маточных кровотечениях, миоме матки [7]. При низком потреблении железа анемия может развиваться даже при относительной небольшой кровопотере [8]. Высокая встречаемость анемии во время беременности отражает значительное увеличение потребности в железе в связи с усилением эритропоэза у женщины и ростом плода [9].
Анемия встречается у трети женщин репродуктивного возраста, а во время беременности ее частота достигает 23–52% [2]. У женщин железодефицитная анемия (ЖДА) чаще всего развивается при обильных и длительных менструациях (более 5 дней), дисфункциональных маточных кровотечениях, миоме матки [7]. При низком потреблении железа анемия может развиваться даже при относительной небольшой кровопотере [8]. Высокая встречаемость анемии во время беременности отражает значительное увеличение потребности в железе в связи с усилением эритропоэза у женщины и ростом плода [9].
При ЖДА увеличение потребления железа с пищей не позволяет компенсировать его дефицит, т.к. предельное всасывание железа составляет всего 2,5–3 мг/сут [9]. В связи с этим основной метод лечения ЖДА – пероральное или внутривенное введение препаратов железа.
Внутривенные препараты железа и показания к их применению
Для внутривенного введения используют железоуглеводные соединения (карбоксимальтозат, сахарат, глюконат и декстран железа). Углеводная оболочка стабилизирует комплекс и замедляет высвобождение железа в крови. Комплексы с низкой молекулярной массой, такие как глюконат железа, менее стабильны и быстрее высвобождают в плазму железо, которое в свободном виде может катализировать образование реактивных форм кислорода, вызывающих перекисное окисление липидов и повреждение тканей [26]. Значительная часть дозы подобных препаратов выводится через почки в первые 4 часа после приема препарата и не используется для эритропоэза. Недостатком декстрана железа, который обладает высокими молекулярной массой и стабильностью, является повышенный риск аллергических реакций [26]. Карбоксимальтозат железа (Феринжект) представляет собой стабильный высокомолекулярной комплекс, который обеспечивает медленное и физиологичное высвобождение железа. Он обладает меньшим иммуногенным потенциалом и в отличие от сахарата и глюконата железа может вводиться в высокой дозе [10].
В рандомизированном контролируемом исследовании карбоксимальтозат железа сравнивали с декстраном железа у 160 больных ЖДА [11]. По эффективности два препарата существенно не различались, однако реакции гиперчувствительности не были зарегистрированы ни у одного из больных в группе карбоксимальтозата железа и отмечались среди 10,3% больных в группе сравнения (р=0,003). Частота кожных реакций также была достоверно ниже при лечении карбоксимальтозатом железа (7,3 и 24,4% соответственно; р=0,004).
При применении карбоксимальтозата железа 1000 мг железа можно ввести внутривенно капельно в течение 15 минут, в то время как максимальная доза железа в виде сахарата составляет 500 мг и вводится в течение 3,5 часа, а длительность инфузии декстрана железа достигает 6 часов, согласно инструкциям по медицинскому применению. Причем в двух последних случаях перед началом инфузии необходимо ввести пробную дозу. Максимальные рекомендуемые однократные дозы большинства препаратов железа для внутривенного введения ниже таковой карбоксимальтозата железа, поэтому для восполнения запасов железа необходимо многократное их введение, в то время как при применении карбоксимальтоза железа кратность инфузий, соответственно, меньше.
При легкой анемии препараты железа чаще всего назначают внутрь. Основное преимущество пероральных препаратов железа перед внутривенными – удобство применения, хотя оно нивелируется высокой частотой (10–40%) побочных эффектов со стороны желудочно-кишечного тракта (ЖКТ [10]) и необходимостью в длительном лечении. Внутривенное введение препаратов железа позволяет быстро восполнять его запасы в организме для восстановления концентрации гемоглобина (Hb). Данный эффект имеет особое значение при более тяжелой анемии, особенно для пациентов с сердечно-сосудистыми заболеваниями, а также при предоперационной анемии, когда оперативное вмешательство не может быть отложено [12]. Следует учитывать, что предоперационная анемия (в т.ч. легкая) не только часто встречается в клинической практике, но и ассоциируется с достоверным увеличением риска смерти и других осложнений в течение 30 дней после оперативного вмешательства [13]. По данным систематизированного обзора 24 рандомизированных и 15 нерандомизированных исследований [14], внутривенное введение препаратов железа при предоперационной анемии давало более быстрый и надежный эффект, чем их пероральный прием. Внутривенное введение железа используют пациенты, получающие лечение препаратами, стимулирующими эритропоэз, больные хронической болезнью почек, воспалительными заболеваниями кишечника, злокачественными опухолями [15]. Причиной дефицита железа у онкологических больных могут быть не только кровотечение или нарушение поступления железа при анорексии или после резекции опухолей ЖКТ, но и другие факторы, в частности увеличение секреции гепсидина, который подавляет всасывание железа в кишечнике и его высвобождение из депо и макрофагов [5, 15]. В нескольких рандомизированных клинических исследованиях внутривенное введение препаратов железа позволило увеличить частоту ответа на лечение эпоэтинами у онкологических больных с 25–70 до 68–93% [16], в то время как пероральные препараты для таких больных были малоэффективными или неэффективными. Переход на внутривенное введение препаратов железа показан также больным, для которых лечение пероральными препаратами оказывается малоэффективным или плохо переносится [17].
Сегодня мировым врачебным сообществом обсуждается также возможность применения препаратов железа и при его латентном дефиците, который не сопровождается анемией, но может быть причиной утомляемости. В многоцентровое рандомизированное плацебо-контролируемое исследование PREFER были включены 290 женщин с утомляемостью (индекс по шкале Piper Fatigue Scale [PFS] score ≥5), дефицитом железа (ферритин <50 мкг/л и степенью насыщения трансферрина <20% или ферритин <15 мкг/л) и нормальным или пограничным уровнем Hb (≥11,5 г/дл), которым однократно вводили карбоксимальтозат железа (1000 мг железа) или физиологический раствор [18]. Утомляемость уменьшилась у 65,3% женщин, получавших карбоксимальтозат железа, и у 52,7% пациенток группы плацебо (р=0,03), а индекс PFS снизился по крайней мере в два раза у 33,3 и 16,4% женщин соответственно (p<0,001). Введение карбоксимальтозата железа привело к более значительному улучшению индексов психического состояния и когнитивной функции. Таким образом, результаты данного исследования показали, что внутривенное введение препарата железа женщинам с дефицитом железа может приводить к уменьшению утомляемости и улучшению показателей качества жизни и когнитивной функции даже в отсутствие анемии. В России на сегодняшний день карбоксимальтозат железа применяется, согласно утвержденной инструкции, только при ЖДА.
Выбор дозы внутривенных препаратов железа
Перед началом лечения внутривенными препаратами железа следует определить оптимальную кумулятивную дозу препарата, которую не следует превышать. Кумулятивную дозу, необходимую для восстановления уровня Hb в крови и восполнения запасов железа в организме, традиционно вычисляют по формуле Ганзони: кумулятивный дефицит железа (мг)=масса тела [кг]×(15-фактический Hb) [г/дл]×2,4+500 [мг] [19]. Для перевода уровня Hb в ммоль/л показатель в г/дл следует умножить на 1,61145 [10]. В инструкциях по применению некоторых препаратов, например Феринжекта, Венофера и Космофера, приведены таблицы, которые позволяют рассчитывать требуемую дозу с учетом фактического содержания Hb и массы тела больного. На практике суммарная доза железа, вводимого внутривенно, обычно составляет около 1000 мг [19]. Фактически некоторым пациентам с ЖДА может потребоваться более высокая суммарная доза на весь курс.
Выраженность дефицита железа у пациентов с ЖДА, которым в клинических исследованиях вводили внутривенные препараты железа, и потенциальная польза увеличения их суммарной дозы были изучены в работе T. Koch и соавт. [19]. Далее мы рассмотрим результаты 7 исследований, в которые включены пациенты с ЖДА различного происхождения, включая женщин с послеродовой анемией или анемией, развившейся после тяжелого маточного кровотечения, пациенты с желудочно-кишечными заболеваниями и нефрогенной анемией [11, 20–25]. Во всех исследованиях применяли карбоксимальтозат железа, который сравнивали с пероральными или другими внутривенными препаратами железа. В двух исследованиях специально изучали эффективность и безопасность карбоксимальтозата железа в более высокой суммарной дозе – 1500 мг. В этих исследованиях пациенты групп сравнения получали стандартную терапию (пероральные или внутривенные препараты железа по выбору исследователей) [24] или внутривенно сахарат железа в дозе 1000 мг [25].
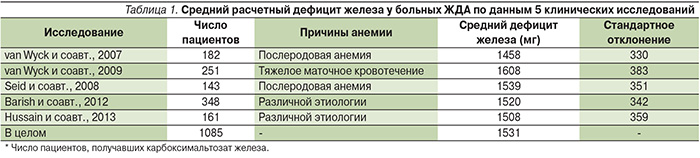
Степень дефицита железа рассчитывали по формуле Ганзони/модифицированной формуле Ганзони. У пациентов с исходной степенью насыщения трансферрина >20% и концентрацией ферритина >50 нг/мл при расчете дефицита железа не учитывали 500 мг, необходимых для восполнения запасов железа [19]. Средние кумулятивные дозы потребления железа в 5 клинических исследованиях потребление карбоксимальтозата железа представлено в табл. 1.
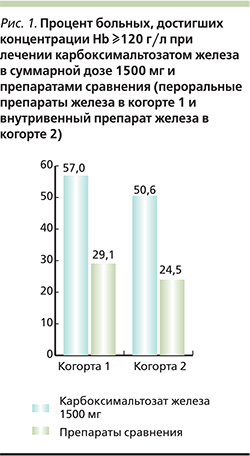
J. Onken и соавт. изучали эффективность и безопасность двух инфузий карбоксимальтозата железа по 750 мг с интервалом в неделю по сравнению с пероральным приемом препарата железа 1011 пациентами с ЖДА различного происхождения, которых разделили на две когорты [24]. Первую когорту составили 507 больных, для которых лечение пероральными препаратами железа в течение 14 дней не привело к существенному росту концентрации Hb (на величину до 10 г/л). В этой когорте сравнивали карбоксмальтозат железа в режиме двукратной инфузии (группа А) и пероральный препарат железа в дозе 325 мг/сут в течение 14 дней (группа В). Через 35 дней концентрация Hb в двух группах увеличилась в среднем на 15,7 и 8,0 г/л соответственно (p=0,001), а доля пациентов, у которых она достигла по крайней мере 120 г/л, составила 57,0 и 29,1% соответственно (р=0,001) (рис. 1). Во вторую когорту были включены 504 пациента, которые не переносили пероральные препараты железа. В этой когорте применяли карбоксимальтозат железа (группа С) или другие внутривенные препараты железа (группа D). Суммарная доза железа в двух группах составила в среднем 1432 и 813 мг соответственно. Средняя концентрация Hb через 35 дней после введения карбоксимальтозата железа в более высокой дозе увеличилась на 29,0 г/л, а при введении других препаратов железа – на 21,6 г/л (р=0,001). Преимущества более высокой дозы железа были показаны и при анализе числа пациентов, достигших концентрации Hb по крайней 120 г/л, их численность составила 50,6 и 24,5% в двух группах соответственно (р=0,001). Таким образом, в этом исследовании было показано, что две инфузии карбоксимальтозата железа по 750 мг с интервалом в одну неделю, – эффективные и безопасные методы лечения ЖДА при недостаточной эффективности или плохой переносимости пероральных препаратов железа.
В исследовании REPAIR-IDA сравнивали эффективность и безопасность внутривенного введения карбоксимальтозата железа (две инфузии по 750 мг с интервалом в неделю) и сахарата железа (до 5 инфузий по 200 мг в течение 14 дней) 2584 больным ЖДА и додиализными стадиями хронической болезни почек (ХБП) [25]. Первичным показателем эффективности было среднее изменение концентрации Hb через 56 дней по сравнению с исходным, а композитной первичной конечной точкой безопасности – частота смертей от любых причин, нефатальных инфаркта миокарда и инсульта, нестабильной стенокардии, хронической сердечной недостаточности, аритмий, эпизодов повышения давления и гипотонии. Суммарная доза железа составила 1464 мг в группе карбоксимальтозата железа и 963 мг в группе сравнения. Исходная концентрация Hb была сопоставимой в двух группах (103,1 и 103,2 г/л соответственно).
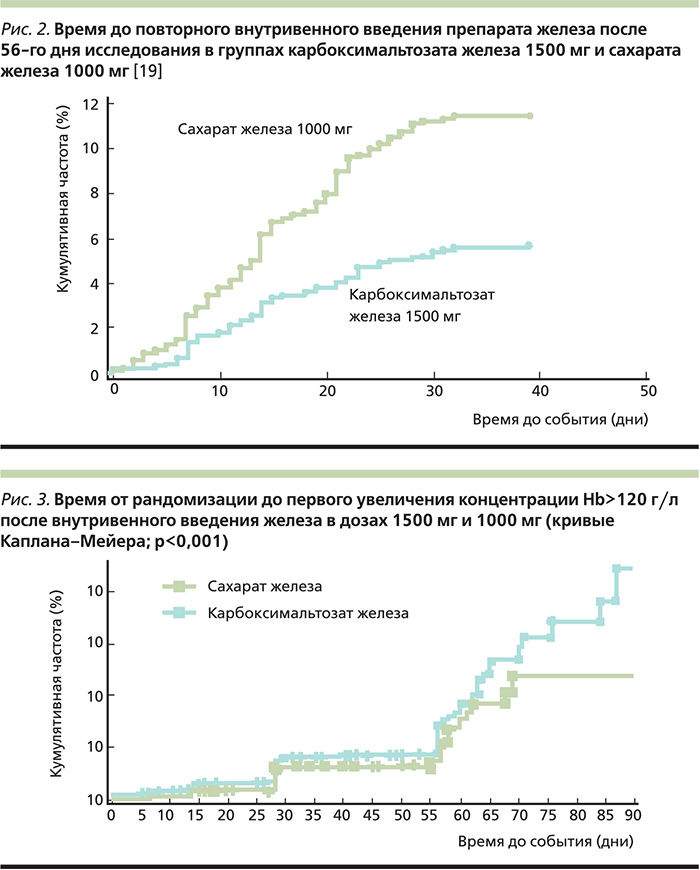
Содержание Hb увеличилось в среднем на 11,3 г/л при введении карбоксимальтозата железа в дозе 750 мг двукратно с интервалом в неделю и на 9,2 г/л при введении сахарата железа в суммарной дозе для 5 инъекций – 1000 мг. Доля пациентов, у которых через 56 дней концентрация Hb после введения карбоксимальтозата железа увеличилась более чем на 10 г/л, была выше, чем после введения сахарата железа (48,6 и 41,0%). При этом доля пациентов, которым потребовалось повторное внутривенное введение препарата железа через 56–90 дней, в основной группе была значительно ниже, чем в группе сравнения (5,6 и 11,1% соответственно; p<0,001; рис. 2) [19].
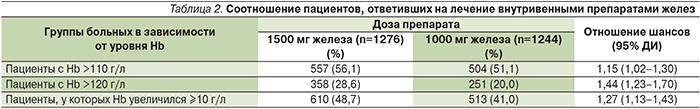
Достоверные преимущества внутривенного введения более высокой дозы препарата железа были выявлены и при анализе числа больных, у которых концентрация Hb в течение 56 дней увеличилась до 110 и 120 г/л или по крайней мере на 10 г/л (табл. 2) [19]. Время до указанных изменений концентрации Hb было короче в группе карбоксимальтозата железа (рис. 3) [19]. Безопасность двух режимов внутривенного введения железа существенно не различалась.
День 56-й был последним в исследовании. По решению исследователя допускалось повторное введение препарата железа с 56-го по 90-й день [19].
Заключение
В клинической практике врачи обычно обсуждают возможность внутривенного введения препаратов железа больным ЖДА при неэффективности или плохой переносимости пероральных препаратов железа, хотя во многих ситуациях внутривенное введение железа является методом выбора. Примером могут служить тяжелая или предоперационная анемии, когда необходимо добиваться прогрессивного увеличения концентрации Hb, чтобы избежать неблагоприятных исходов или не откладывать оперативное вмешательство.
Пероральные препараты железа могут быть недостаточно эффективными в лечении ЖДА у больных воспалительными заболеваниями кишечника, онкологическими заболеваниями и ХБП. Анализ расчетного дефицита железа в клинических исследованиях больных ЖДА показал, что в среднем он может составлять около 1500 мг. Таким образом, общая доза железа, которая нередко не превышает 1000 мг, может оказаться недостаточной для некоторых пациентов с ЖДА. Результаты рандомизированных клинических исследований свидетельствуют о том, что внутривенное введение препарата железа до кумулятивной дозы 1500 мг позволяет добиваться более быстрого значительного повышения концентрации Hb и увеличить срок до повторных инфузий препаратов железа по сравнению с таковыми при введении дозы 1000 мг.
Для введения высоких доз железа может быть использован карбоксимальтозат железа, однократная доза которого может составлять 1000 мг. Соответственно, бóльшую дозу можно вводить путем повторных инфузий препарата с интервалом в одну неделю, в то время как при применении сахарата железа для введения аналогичной дозы потребуется большее число инфузий.


