Введение
Большие ортопедические операции по замене крупных суставов связаны с возникновением пожизненного риска развития перипротезной инфекции (ППИ), поскольку поверхность искусственных имплантатов служит идеальным субстратом для бактериальной колонизации [1, 2]. Существенным фактором при этом является то, что очень низкой дозы микробного инокулюма достаточно для возникновения инфекции в присутствии искусственного протезного материала [3]. Поверхность имплантата аккумулирует белки сыворотки, которые способствуют бактериальной адгезии и колонизации и являются первой критической фазой в развитии ППИ. Адгезированные микроорганизмы синтезируют комплекс гликокаликс, который обволакивает бактерии и защищает их от макрофагов и антимикробных веществ. В настоящее время лечение ППИ требует удаления контаминированного имплантата в сочетании с обширной хирургической обработкой кости, иссечением инфицированных тканей и кости, а также длительной антимикробной терапией [1].
Антибактериальная терапия ППИ может быть этиотропной – при установленном возбудителе инфекционного процесса, и эмпирической, когда выбор препарата врачом основан на его знании эпидемиологической ситуации и вероятных потенциальных возбудителей. Наряду с этим на выбор антибиотика существенным образом влияют не только «проблемные» бактериальные возбудители (полирезистентные микроорганизмы, бактериальные биопленки, локализованные внутриклеточно бактерии, SCV – small colony variants), но и «проблемные» пациенты (со сниженным уровнем иммунного статуса, непереносимостью антимикробных препаратов, высоким уровнем коморбидности).
Цель исследования: определение спектра антимикробных препаратов для эмпирической и этиотропной терапии ППИ в стационаре травматолого-ортопедического профиля на основе данных локального мониторинга чувствительности ведущих возбудителей ППИ за 2010–2014 гг.
Материал и методы
Выполнен ретроспективный анализ этиологической структуры с определением спектра ведущих возбудителей ППИ после ортопедических операций у пациентов, лечившихся в отделении гнойной хирургии РНИИТО им. Р.Р. Вредена с января 2010 по декабрь 2014 г. Проанализированы антибиотикограммы 2429 штаммов бактерий – возбудителей ППИ, выделенных с удаленных ортопедических конструкций (эндопротезов, винтов, пластин, цементных спейсеров и др.), а также из образцов биологического материала (тканевых биоптатов и аспиратов из области установки эндопротеза). Идентификацию возбудителей и тестирование антибиотикочувствительности осуществляли в соответствии со стандартными методиками, принятыми в лаборатории [4].
Эпидемиологический анализ результатов исследования выполняли с применением программы «Система микробиологического мониторинга «Микроб-2»» (© 1999–2013 МедПроект-3); статистическую обработку – с помощью MS Office Excel, 2007 (Microsoft, США), для статистического анализа полученных данных был использован Z-критерий стандартного нормального распределения для оценки разности между долями [5].
Результаты исследования
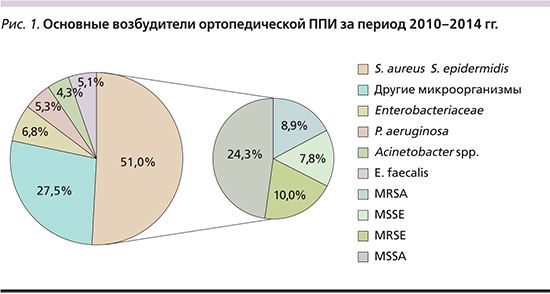
В видовом спектре возбудителей ППИ (рис. 1) ведущие позиции принадлежат двум видам стафилококков (Staphylococcus aureus и Staphylococcus epidermidis) – 51,0%, далее следуют представители неферментирующих грамотрицательных бактерий Acinetobacter spp. и Pseudomonas aeruginosa, составляющие в совокупности 9,6%; Enterococcus faecalis – 5,1% и представители семейства энтеробактерий – 6,8%. Последняя группа возбудителей – самая разнообразная по составу и включает представителей различных видов, из которых чаще других встречаются и являются наиболее этиологически важными Klebsiella pneumoniae, Enterobacter cloacae, Escherichia coli. Но наряду с указанными штаммы Proteus mirabilis, Citrobacter freundii, Serratia marcescens также заслуживают внимания, поскольку, как установлено в нашем исследовании, 25% штаммов всех перечисленных выше видов – это продуценты β-лактамаз расширенного спектра действия (БЛРС).
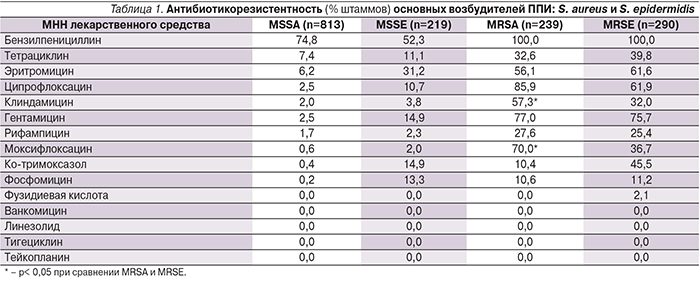
Лидеры этиологической структуры ортопедической ППИ, S. aureus и S. epidermidis, составляющие 51% (рис. 1), в высокой степени резистентны к наиболее широко используемым антибиотикам. Установлено, что штаммы S. epidermidis более устойчивы к метициллину по сравнению с S. aureus (56,6% против 23,9%; p<0,05).
Устойчивость метициллиночувствительных штаммов S. aureus (MSSA – Methicillin-sensitive Staphylococcus aureus) высока только к пенициллину (77%), а к прочим антибиотикам составляет 0,3–8,8%, вследствие чего вызванные такими штаммами инфекции не представляют особых проблем для лечения. Метициллиночувствительные штаммы S. epidermidis (MSSE – Methicillin-sensitive Staphylococcus epidermidis), напротив, менее устойчивы к бензилпенициллину (50,5%; p<0,05), а к другим антибиотикам резистентны в 1,5–35,5% случаев. Следовательно, препаратами выбора при ППИ, обусловленной метициллиночувствительными стафилококками, являются β-лактамные антибиотики с антистафилококковым эффектом: оксациллин, цефалоспорины I–II поколений, а при их непереносимости – клиндамицин или фторхинолоны, причем предпочтение следует отдавать моксифлоксацину, поскольку препарат обладает более высокой антистафилококковой активностью.
У метициллинорезистентных (MR – Methicillin-resistant) представителей исследуемых видов стафилококков (табл. 1) была высокой резистентность к гентамицину и ципрофлоксацину (62–86%). К моксифлоксацину и клиндамицину резистентность значимо выше у MRSA (p<0,05), а к ко-тримоксазолу — у MRSE (p<0,05). Таким образом, назначать указанные антибиотики необходимо только в случаях их подтвержденной активности в отношении конкретного штамма – возбудителя ППИ. Доля штаммов, резистентных к рифампицину, составила 25,4 и 27,6% для MRSE и MRSA соответственно. Максимальную антистафилококковую активность продемонстрировали гликопептиды (ванкомицин и тейкопланин), линезолид, тигециклин, фузидиевая кислота и фосфомицин (табл. 1).
При определении чувствительности к ванкомицину методом Е-тестов выявлена существенная гетерогенность этой группы изолятов по уровню минимальной подавляющей концентрации (МПК) ванкомицина (рис. 2). Удовлетворяли требованиям по чувствительности к ванкомицину с МПК≤1 мкг/мл соответственно 63,1 и 40,9% штаммов MRSA и MRSE. Значения МПК ванкомицина МПК≥2 мкг/мл выявлены у 17,4% изолятов MRSA и у 41,1% MRSE (p<0,05).
Другая группа грамположительных кокков в этиологической структуре возбудителей ППИ представлена штаммами E. faecalis, доля которых составила 5,1% (рис. 1). Надо отметить, что в 71,4% случаев штаммы E. faecalis были выделены в составе микробных ассоциаций. К ванкомицину, линезолиду, тигециклину сохраняется 100% чувствительность выделенных штаммов энтерококков. Только 15,9% штаммов были резистентны к ампициллину. Высокую активность сохраняют также ампициллин/сульбактам и имипенем. Наряду с этим только около половины штаммов E. faecalis чувствительны к фторхинолонам и гентамицину.
Среди грамотрицательных возбудителей в структуре ППИ лидируют неферментирующие бактерии P. aeruginosa и Acinetobacter spp. В нашем исследовании наиболее активными в отношении штаммов P. aeruginosa из β-лактамных антибиотиков были карбапенемы (71–75%), а в отношении изолятов Acinetobacter spp. – цефоперазон/сульбактам (56,1%) (рис. 3). К прочим β-лактамам штаммы P. aeruginosa высоко устойчивы. В других группах тестируемых препаратов активность в отношении синегнойной палочки сохранена на уровне 70–80% у азтреонама, левофлоксацина, гентамицина и амикацина. В то же время резистентность штаммов Acinetobacter spp. ко всем тестируемым антибиотикам, за исключением полимиксина и цефоперазона/сульбактама, существенно превышала таковую для P. aeruginosa и достигала 62–87%.
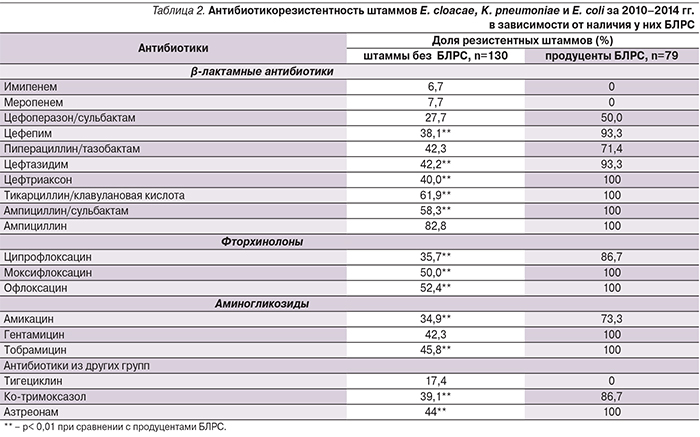
Доля энтеробактерий в спектре возбудителей ППИ составила 6,8%. Однако четверть изолятов семейства энтеробактерий являются продуцентами БЛРС, в отношении которых могут быть эффективными только карбапенемы и тигециклин, чья активность составила 83–100% тестированных штаммов (табл. 2), цефоперазон/сульбактам in vitro был эффективен в отношении 50% изолятов. Штаммы энтеробактерий, синтезирующие БЛРС, резистентны к антибиотикам других групп в 73,3–100%, в то время как более половины штаммов, не имеющих данного фермента, чувствительны к фторхинолонам, аминогликозидам, ко-тримоксазолу и азтреонаму.
Обсуждение
Полирезистентность инфекционных агентов представляет собой очень серьезную клиническую проблему, т.к. существенно затрудняет выбор препаратов для эффективной, безопасной и длительной антибактериальной терапии во всех областях медицины. Однако помимо проблемы выбора препарата, активного в отношении этиологического фактора, при лечении ортопедической инфекции имеется ряд дополнительных особенностей, усложняющих проблему еще больше. Речь идет о необходимости оказания бактерицидного действия в отношении возбудителей, в т.ч. локализованных в составе микробной биопленки или внутриклеточно, и о применении больших доз препаратов длительными курсами (от нескольких недель до пожизненного приема).
По нашим данным, основные возбудители ППИ — штаммы S. aureus и S. epidermidis, в значительной доле случаев резистентны к метициллину, вследствие чего обладают высокой перекрестной устойчивостью ко всем β-лактамам, а также ассоциированной устойчивостью к препаратам других групп антибиотиков [4]. На сегодняшний день общепризнанно, что ведущая роль S. aureus и S. epidermidis в этиологии ортопедической инфекции во многом обусловлена их способностью быстро формировать многоуровневые микробные биопленки на поверхности искусственных имплантатов [6]. Следуя инфекционной стратегии, генетически обусловленной локусом agr, стафилококки в первую очередь реализуют факторы вирулентности для адгезии к имплантату и перипротезным тканям, а после этого используют токсины и ферменты, повреждая костные ткани, перипротезные ткани, а также приводя к микробиологической коррозии и деструкции искусственные имплантаты [7]. Существование возбудителей в составе биопленок затрудняет диагностику имплантат-ассоциированных инфекций в целом и ППИ в частности и снижает эффективность антибактериальной терапии, в т.ч. препаратами, высокоактивными в отношении MR-стафилококков [8].

До настоящего времени во всем мире наиболее широко при инфекциях, вызванных метициллинорезистентными штаммами стафилококков, применяют гликопептиды, а в Российской Федерации – только ванкомицин, в силу того что тейкопланин на территории РФ не зарегистрирован. Все включенные в наше исследование стафилококки были чувствительны к ванкомицину. Однако в последние годы появляется все больше информации о существенном снижении эффективности ванкомицина при антибактериальной терапии инфекций, вызванных такими MR-стафилококками, которые in vitro чувствительны к ванкомицину [9]. Так, Р. Moise-Broder и соавт. (2004) показали, что при лечении тяжелых MRSA-инфекций эффективность ванкомицина напрямую зависит от МПК стафилококкового штамма-возбудителя: при возрастании значений МПК до 1–2 мкг/мл эффективность действия ванкомицина не превышает 8–29% соответственно [10].
По нашим данным (рис. 2), только в отношении 13,7% штаммов MSRA и 6,7% MRSE значения МПК ванкомицина не превышали 0,5 мкг/мл; в то же время в отношении 36,7% изолятов MRSA и 59% MRSE величина МПК ванкомицина составляла не менее 1,5 мкг/мл. Следовательно, можно предположить, что у значительной части пациентов с ППИ антимикробная монотерапия ванкомицином может оказаться неэффективной и не исключает возникновения рецидивов инфекции. Современные руководства по применению ванкомицина рекомендуют рассчитывать его дозу на массу тела (30–40 мг/кг/сут в 2 введения) с определением его остаточной концентрации в крови [11]. Однако только в 11,4% случаев целевой уровень остаточной концентрации ванкомицина был достигнут на третьи сутки терапии. Большинству (72,7%) пациентов потребовалось увеличение суточной дозы антибиотика и проведение повторного терапевтического лекарственного мониторинга [12]. Таким образом, даже четкое следование рекомендациям по применению ванкомицина не может гарантировать его эффективности при лечении ППИ.
Кроме того, бактериостатическое действие гликопептидных препаратов на стафилококки является существенным недостатком и при лечении инфекций, обусловленных MS-стафилококками. J. Edgeworth и соавт. показали, что в тех случаях, когда для лечения инфекций, вызванных метициллиночувствительными стафилококками, по различным причинам применялись гликопептиды, они уступали β-лактамам по клинической эффективности [13], что делает использование ванкомицина при инфекциях, вызванных метициллиночевствительными стафилококками неприемлемым.
К настоящему времени общепринятым методом, повышающим эффективность лечения стафилококковой ортопедической инфекции, признана комбинированная терапия, несмотря на данные научной литературы и согласующиеся с ними собственные результаты о высокой антистафилококковой активности in vitro линезолида, тигециклина и фузидиевой кислоты (табл. 1). Большинство зарубежных исследователей предлагают широко использовать рифампицин, в т.ч. в сочетании с гликопептидами, линезолидом или даптомицином в составе комбинированной терапии ППИ стафилококковой этиологии [14] для усиления бактерицидного эффекта, воздействия на микробные биопленки и на расположенные в макрофагах бактерии [15–20]. К примеру, на сегодняшний день накоплено много данных о клинической эффективности линезолида при лечении остеомиелитов и ППИ, однако в основном это касается случаев, когда линезолид выступает в качестве компонента комбинированной терапии [17, 21]. При этом надо учитывать, что продолжительность приема данного препарата не должна превышать 4 недель из-за его миело- и нейротоксичности. По-видимому, такие препараты, как даптомицин и цефтаролин, могут повысить эффективность терапии ППИ стафилококковой этиологии. Ранее нами было показано, что из 27 изолятов MRSA c МПК ванкомицина ≥1,5 мкг/мл все были чувствительны к даптомицину и только 3 штамма продемонстрировали резистентность к цефтаролину [22]. Однако у названных препаратов нет зарегистрированного показания к лечению костей и суставов и, кроме того, нет лекарственных форм для их перорального приема.
В нашем исследовании доля штаммов E. faecalis в этиологической структуре ППИ составила 5,1%, при этом в 71,4% случаев они были представлены в составе ассоциаций с другими бактериями. По данным научной медицинской литературы, при развитии клинически выраженной инфекции энтерококки могут участвовать в ее начальной стадии, индуцируя воспалительную реакцию при синергидных взаимодействиях с другими микроорганизмами, в дальнейшем не влияя на течение процесса [23]. Очевидно, нецелесообразно вести речь об эмпирической терапии энтерококковых инфекций, поскольку только менее 3% случаев ППИ в ортопедии имеют энтерококковую этиологию, а при установленном участии штаммов Enterococcus spp. антибактериальная терапия должна быть этиотропной. Установлено, что все штаммы E. faecalis были чувствительны к ванкомицину, линезолиду и тигециклину, а большинство из них также к ампициллину, ампициллину/сульбактаму и имипенему. Наряду с этим около половины штаммов E. faecalis чувствительны к фторхинолонам и гентамицину. Недостатком является тот факт, что перечисленные препараты, за исключением гентамицина, оказывают в отношении энтерококков лишь бактериостатическое действие. Наиболее выраженного бактерицидного эффекта удается достичь при комбинированной терапии β-лактамами или ванкомицином в сочетании с гентамицином, но при применении последней комбинации из-за крайне высокой нефротоксичности требуется проводить постоянный мониторинг клиренса креатинина для контроля функции почек у пациента.
Во всем мире большую проблему представляет лечение инфекций, вызванных нозокомиальными штаммами грамотрицательных бактерий. Повсеместно трудности в подборе терапии для лечения инфекций, обусловленных неферментирующими возбудителями, определяются тем, что большинство изолятов P. aeruginosa резистентны к антисинегнойным антибиотикам различных групп, а штаммы Acinetobacter spp. – к цефалоспоринам и фторхинолонам [24].
В нашем исследовании доля неферментирующих бактерий в этиологической структуре ППИ составила 9,6%, а препаратами, наиболее активными в отношении этих возбудителей, были полимиксин, карбапенемы и цефоперазон/сульбактам. При этом наибольшей резистентностью характеризовались изоляты Acinetobacter spp.
По нашим данным, энтеробактерии выступали возбудителями ППИ в 6,8% случаев после больших ортопедических операций, что согласуется с мировой научной литературой. Чаще всего эти возбудители выделяются в составе полимикробных ассоциаций. Особую важность представляет то, что 25% изолятов K. pneumoniae, E. cloacae, E. coli, P. mirabilis, C. freundii, S. marcescens в нашем исследовании являлись продуцентами БЛРС и устойчивость таких штаммов достигала 100% к большинству β-лактамных антибиотиков за исключением карбапенемов и тигециклина. При этом надо помнить о том, что тигециклин не только не имеет зарегистрированного показания к применению при лечении инфекции костей и суставов, но и характеризуется невысокой пенетрацией в костную ткань, что не позволяет рассматривать его как препарат выбора при лечении хронической ППИ с остеомиелитом, но позволяет применять данный антибиотик при остром течении инфекции протезированного сустава с вовлечением мягких тканей, окружающих эндопротез.
В 14–20% случаев причиной ППИ выступают ассоциации бактериальных возбудителей, причем в составе более половины микробных ассоциаций имеются грамотрицательные бактерии [25, 26]. Ревматоидный артрит, высокий индекс коморбидности, возраст от 65 лет, наличие хирургического дренажа, а также расхождение краев раны после операции являются более присущими для полимикробной, чем для мономикробной инфекции. Соответственно, в случае клинических проявлений инфекции в раннем послеоперационном периоде у пожилых пациентов с наличием расхождения краев хирургической раны следует ожидать полимикробной инфекции. Enterococcus spp., S. aureus, а также аэробные грамотрицательные палочки, включая P. aeruginosa, являются наиболее частыми изолятами, каждый из которых присутствует в исследуемом материале более чем в четверти случаев перипротезных полимикробных инфекций [3].
Заключение
Таким образом, наиболее трудными для лечения являются инфекции, вызванные полирезистентными возбудителями, к которым относят метициллинорезистентные S. aureus (MRSA) и S. epidermidis (MRSE), ампициллин-резистентные энтерококки, штаммы P. aeruginosa и Acinetobacter spp., устойчивые к фторхинолонам и цефалоспоринам III поколения, и бактерии семейства Enterobacteriacae, продуцирующие БЛРС.
В условиях драматического роста резистентности микроорганизмов к антибиотикам, часто используемым в клинической практике, наряду с малым количеством и высокой стоимостью препаратов, сохраняющих активность в отношении полирезистентных микроорганизмов, особую значимость приобретает выбор антибиотиков для рациональной терапии ортопедической ППИ. Во многом это определяется слабой эффективностью системной антибактериальной терапии, как правило, из-за низкого уровня пенетрации препаратов в костную ткань, антибиотикорезистентности возбудителей как в планктонной форме, так и в составе микробных биопленок, роль которых в патогенезе имплантат-ассоциированных инфекций в ортопедии в настоящее время неоспорима. Травматология и ортопедия являются обособленной областью медицины, в которой системная антибактериальная терапия, как правило, проводится длительно комбинацией препаратов в больших дозах. При этом антибактериальные препараты часто назначают off-label, т.е. применяют по показанию или в режиме дозирования, не упомянутом в утвержденной инструкции.
По совокупности свойств «идеальный» антибактериальный препарат для лечения ППИ должен быть эффективным в отношении возбудителя у конкретного пациента, обладать бактерицидным действием, создавать высокие концентрации в костях, суставах и мягких тканях при парентеральном и пероральном применении и иметь высокий профиль безопасности. Таким требованиям во многом отвечают комбинации антимикробных препаратов, которые могут служить своеобразным спасательным кругом в трудных случаях. Комбинационная антимикробная терапия способствует эрадикации возбудителя за счет сочетания бактерицидных и бактериостатических препаратов, сочетания различных механизмов антимикробного действия. Однако вопросы рационального применения антибактериальных препаратов при лечении инфекции костей и суставов до настоящего времени не имеют окончательных ответов. По нашему мнению, только создание регистров пациентов с ППИ с последующим анализом эффективности различных методов лечения ППИ, включающих и различные схемы антибактериальной терапии, на больших когортах пациентов может создать серьезную доказательную базу для выбора наиболее успешных методик лечения и внедрения их в широкую клиническую практику.


