Успех в лечении инфекционного процесса во многом зависит от адекватного выбора антибактериального препарата (АБП). Однако, как показывает практика, несмотря на наличие массы
рекомендаций и руководств, регламентирующих рациональную антибактериальную терапию (АБТ), она далеко не во всех случаях назначается грамотно.
Каковы же критерии оценки качества АБТ?
Прежде чем назначать АБП, врач должен ясно представлять себе ответы на следующие вопросы [1–4]:
• Есть ли показания к АБТ/антибиотикопрофилактике? (Оправданно ли вообще назначение АБП?)
• Адекватен ли выбор АБП?
• Есть ли альтернативные препараты с учетом эффективности (чувствительности, антимикробной активности), токсичности, аллергических реакций, стоимости препарата, спектра (слишком широкого)?
• Адекватна ли продолжительность лечения (слишком короткая, слишком большая)?
• Адекватны ли фармакокинетические характеристики препаратов с учетом дозы, кратности, пути введения?
Адекватны ли сроки назначения АБП?
Сложность проблемы АБТ больных с инфекционным процессом состоит в том, что она почти всегда начинается, когда возбудитель не известен или не определена его чувствительность к АБП. В этих условиях большое значение приобретает знание наиболее распространенных возбудителей респираторных инфекций, т. е. проведение микробиологического мониторинга [5].
Выбирая АБП для лечения конкретного больного, необходимо помнить о том, что при массовом применении эти препараты становятся значимыми экологическими факторами, способствующими селекции устойчивости среди микроорганизмов, циркулирующих в популяции человека.
Эффективность проводимой АБТ во многом зависит от дозы назначенного препарата. Доза АБП должна быть подобрана таким образом, чтобы его концентрация в плазме превышала минимальную подавляющую концентрацию (МПК) для предполагаемого возбудителя [6].
Однако само по себе значение концентрации в очаге инфекции не определяет полностью фармакологические эффекты препарата, т. к. in vivo бактерии подвергаются воздействию постоянно меняющейся концентрации АБП: после приеме она выше, а затем постепенно снижается. Поэтому более точными показателями, которые могут использоваться в качестве предикторов эффективности терапии фторхинолонами, является отношение максимальной концентрации препарата (Cmax) к МПК (Сmax/МПК) и отношение площади под фармакокинетической кривой в течение 24 часов (AUC0–24) к МПК (AUC0–24/МПК). Считается, что предиктором эффективности у фторхинолонов являются показатели AUC0–24/МПК более 125 и Сmax/МПК более 10 в плазме крови [7].
В соответствии с фармакодинамическими моделями, построенными на основе результатов исследования нозокомиальных пневмоний, формирование антибиотикорезистентности оказалось тесно связанным с субоптимальной экспозицией, определявшейся по соотношению AUC0–24/МПК менее
100 [8]. Из этого следует, что назначение низких доз АБП не только снижает эффективность лечения, но и способствует развитию резистентности.
Имеются сообщения о высокой вариабельности назначаемых доз и длительности курса лечения при одних и тех же состояниях [9]. По данным исследования, проведенного во Франции, низкие дозы и длительные курсы лечения детей β-лактамными антибиотиками оказались основным фактором риска
колонизации пенициллинорезистентными штаммами пневмококка [10]. Назначение необоснованно малых доз отмечено и при проведении аудитов в Великобритании [11] и Нидерландах [2].
Чрезвычайно важно учитывать при выборе АБП его качество. К сожалению, в последнее время достаточно часто в специальной литературе появляется информация о невысоком качестве воспроизведенных АБП, присутствующих на российском фармацевтическом рынке [12–16]. И в связи с этим чрезвычайно важным, на наш взгляд, являются поиск и разработка простых, объективных методов оценки свойств АБП in vitro, позволяющих на основании полученных данных спрогнозировать фармакокинетику лекарственного препарата в организме человека, а соответственно, и его клиническую эффективность.
Для твердых пероральных лекарственных форм (таблетки, драже, капсулы, гранулы) тест кинетики растворения (скорости и степени высвобождения in vitro активного компонента – биодоступности in vitro) является одним из важнейших критериев оценки качества. Фактически его использование при анализе лекарственного препарата и есть испытание, которое наряду с оценкой фармацевтической эквивалентности позволяло бы проводить предварительную оценку биоэквивалентности воспроизведенного лекарственного средства.
Простота этого теста способствует рассмотрению его как альтернативы сложным, дорогостоящим и не всегда этически безупречным исследованиям по изучению биодоступности препарата in vivo.
Не вызывает сомнений утверждение, что на сегодняшний день фторхинолоны – это уникальный класс АБП, нашедших свое применение при лечении как внебольничных, так и нозокомиальных инфекций вследствие уникального спектра активности, удобного режима применения и благоприятного профиля безопасности. Вот почему целью нашего исследования явилось изучение сопоставимости показателей теста растворимости оригинального левофлоксацина (Таваник, Санофи; Франция) и его генерического аналога (Г1) с целью прогнозирования сходства их клинических свойств.
Материал и методы
Исследование кинетики растворения двух перечисленных лекарственных препаратов левофлоксацина проведено при различных значениях рН-среды. Выбор значений рН-среды основывался на рекомендациях Американской фармакопеи. Согласно этим рекомендациям, используемые в таких исследованиях значения рН-сред составляют 1,2 и 6,8 для моделирования условий среды желудочного сока и 4,5 как промежуточное. Исследования проводились на тестере биодоступности “Biodis” фирмы
“Varian” модели VK750D.
В емкости тестера биодоступности заливали соответствующую среду с выбранным значением рН и термостатировали при 37 °С. В семь корзинок тестера помещали по одной таблетке каждого препарата и начинали растворение. При этом каждая корзинка совершала возвратно-поступательное
движения (т. н. циклы). Через заданные моменты времени (5, 10, 20, 30 минут) отбирали пипеткой по 1 мл пробы. Отобранные пробы центрифугировали при 5000 об/мин, затем пробу разбавляли в 200 раз и определяли оптическую плотность на спектрофотометре “Carry 100” в 10 мм кварцевой кювете в максимуме поглощения.
Предварительно для каждого значения рН-среды определяли максимум поглощения левофлоксацина. Для рН 1,2 максимум составил 293,0 нм, для рН 4,5 – 290,7 нм, для рН 6,8 – 288,0 нм. Продолжительность проведения теста кинетики растворения составила 30 минут.
Полученные результаты
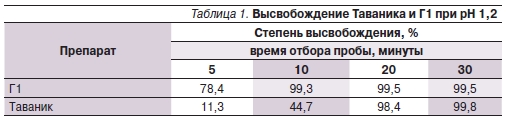
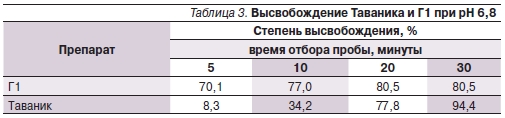
Результаты проведенных исследований представлены в табл. 1–3.

Обсуждение полученных результатов
Данные современной литературы свидетельствуют о том, что чрезвычайно важным фактором, влияющим на эффективность применения фторхинолонов, является показатель их биодоступности. Установлено, что для данного класса АБП отношение AUC/МПК при тяжелых инфекциях должно
превышать 125. Соответственно, даже незначительное снижение дозы активного вещества, попадающей в системный кровоток, неминуемо скажется на клинической эффективности применяемого препарата. Кроме того, снижение дозы АБП, попадающей в системный кровоток, способствует селекции устойчивости среди микроорганизмов [17].
В результате проведенного исследования установлено, что оригинальный левофлоксацин обладает стабильными параметрами биодоступности, существенно не меняющимися при различных условиях рН-среды. В то же время параметры биодоступности генерического аналога лево-
флоксацина существенно зависели от кислотности среды высвобождения, что свидетельствует о возможной вариабельности фармакокинетических параметров данных препаратов в организме человека. При рН 1,2 генерический аналог по параметрам биодоступности in vitro был сопоставим с оригинальным препаратом. Однако при рН 4,5 Г1 высвободил к 30-й минуте теста только 367 мг левофлоксацина (73,3 %). Похожие результаты были получены и при рН 6,8. Очевидно, что создание субтерапевтических концентраций АБП в организме человека вследствие низкой биодоступности используемого воспроизведенного аналога в конечном итоге приведет к необходимости смены
препарата из-за его неэффективности, а также риску селекции резистентных штаммов микроорганизмов.
При тех же условиях растворения из лекарственной формы оригинального препарата к окончанию теста высвободилось 491 и 474 мг для pH 4,5 и 6,8 соответственно. Таким образом, использование клиницистом оригинального препарата позволяет быть ему уверенным в предсказуемости фармакокинетических и фармакодинамических свойств назначенного лекарственного средства.
К сожалению, подобные проблемы, связанные с низкой биодоступностью генерических аналогов АБП, выявляются не впервые. Так, доказано, что низкой биодоступностью обладают генерики азитромицина [18], что в свою очередь приводит к снижению клинической эффективности их применения и росту затрат при использовании данных препаратов [19].
Таким образом, полученные результаты позволяют предположить, что применение генерического аналога Таваника может сопровождаться повышением риска клинических неудач и ростом резистентности микроорганизмов к этому препарату.



