Актуальность
По данным Национального института рака в США в 2015 г. ожидается 22 850 новых случаев и 15 320 смертей от первичных злокачественных опухолей центральной нервной системы – ЦНС [1]. Во всем мире ежегодно регистрируют 256 213 первичных больных и умирает 189 381 пациент [2]. Течение заболевания характеризуется быстрым и почти неизбежным рецидивированием после комплексного лечения. Лечение рецидивов в настоящее время по-прежнему нерешенная проблема. Использование бевацизумаба при рецидивах или прогрессировании глиобластомы (ГБМ) влияет на время до прогрессирования. Однако в настоящее время остается открытым вопрос о влиянии бевацизумаба на общую выживаемость (ОВ) больных. Этой проблеме и посвящено наше исследование.
Задачей исследования стала оценка влияния применения бевацизумаба при прогрессировании или рецидиве ГБМ на ОВ больных. Оценить безопасность и эффективность продолжения терапии бевацизумабом после прогрессирования в комбинации с еженедельным паклитакселом и повторной лучевой терапией.
Материал и методы
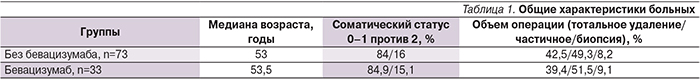
С 2006 по 2015 г. в исследование включены 106 пациентов, проходивших лечение в радиологическом центре ФГКУ ГВКГ им. Н.Н. Бурденко. В исследование включены пациенты с гистологически верифицированной первичной или вторичной ГБМ. Всем больным на первом этапе удалена опухоль, а при невозможности удаления проведена биопсия. В контрольную группу (n=73) вошли пациенты, набор которых осуществлен в период, когда отсутствовал доступ к бевацизумабу и во 2-й линии проведена химиотерапия по выбору врача. Основную группу составили больные (n=33), получавшие бевацизумаб при прогрессировании или рецидиве ГБМ. В обеих группах лучевая терапия осуществлена в разовой очаговой дозе 2 Гр., суммарная очаговая доза – 60 Гр. Лучевая терапия проведена одновременно с химиотерапией темозоломидом по 75 мг/м2 в дни лучевой терапии. Через 28 дней после завершения химиолучевой терапии (ХЛТ) начиналась монохимиотерапия темозоломидом по 150 м/м2 во время первого цикла и по 200 мг/м2 в последующие циклы. Химиотерапия проводилась в течение 5 дней, межкурсовой интервал – 28 дней. Лечение проходило до прогрессирования или завершения планируемого лечения, которое ограничивалось 6 курсами. При прогрессировании заболевания пациенты контрольной группы получали химиотерапию. Режим химиотерапии определен временем до прогрессирования, общесоматическим статусом, возрастом. Использованы комбинации темозоломида с препаратами платины, иринотеканом, пролонгированные режимы с темозоломидом, а также химио-терапия по схеме PCV (прокарба-зин+ломустин+винкристин). Больные основной группы во 2-й или 3-й линии терапии получали бевацизумаб в дозе 7,5 м/кг 1 раз в 21 день. Обе группы были сравнимыми по основным факторам прогноза (табл. 1).
Результаты исследования
Медиана ОВ в контрольной группе составила 23 месяца, в группе бевацизумаба – 32 (р=0,012). В группе монотерапии бевацизумабом частота объективных ответов в соответствии с критериями RANO (Response Assessment in Neuro-Oncology Criteria) составила 33%. Нежелательные явления 3-й степени и выше: гипертензия (3%), протеинурия (3%), венозный тромбоз (3%). Остальные нежелательные явления носили временный характер, не влияли на ход проводимого лечения и не требовали коррекции дозы или перерыва в лечении.
Таким образом, таргетная терапия бевацизумабом при рецидивах ГБМ статистически значимо увеличивает медиану ОВ с 23 до 32 месяцев по сравнению со стандартным лечением. Использование бевацизумаба по этим показаниям обладает хорошим профилем безопасности.
Обсуждение
До 1970-х гг. единственным методом лечения ГБМ считалось хирургическое удаление опухоли. Попытки расширения объема операции для достижения большей радикальности удаления опухоли не приводили к улучшению результатов лечения. В 1980-х гг. было опубликовано несколько рандомизированных исследований, продемонстрировавших эффективность использования лучевой терапии в качестве послеоперационного метода лечения, способного увеличить медиану выживаемости больных приблизительно в 2 раза – с 5,2 до 10,2 месяца [3]. Применение темозоломида в составе комплексной терапии ГБМ привело к увеличению медианы выживаемости еще в 1,5 раза – до 14,6 месяца. После этого открытия длительное время не удавалось улучшить результаты лечения [4].
Несмотря на успехи, достигнутые в лечения глиальных опухолей, большинство из них рецидивируют даже после проведения агрессивного химиолучевого лечения. По данным R. Stupp, медиана времени до прогрессирования заболевания на фоне комбинированного лечения темозоломидом и лучевой терапией составляет лишь 6,9 месяца [4]. Арсенал возможных методов лечения рецидивов злокачественных глиом в течение последнего десятилетия значительно расширился. Хирургическое лечение рассматривается в первую очередь в отношении больных с нарастающими неврологическим симптомами вследствие развития масс-эффекта. Роль хирургии недостаточно ясна, связано это в первую очередь с влиянием различных субъективных факторов на принятие решения о повторной операции и сложность организации контролируемых рандомизированных исследований этой популяции пациентов. Возможность выполнения «радикальной» резекции имеет решающее значение. В ряде хорошо организованных проспективных исследований демонстрируется увеличение 6-месячной выживаемости без прогрессирования при тотальном удалении опухоли по сравнению с меньшим объемом резекции [5]. Применение повторной лучевой терапии ограничено толерантностью тканей головного мозга. Опубликовано несколько исследований, в которых демонстрировалось безопасное использование фракционированной радиохирургии на больных ГБМ с ограниченным по объему рецидивом, но даже среди пациентов этой группы результаты в отношении эффективности лучевой терапии остаются противоречивыми. Было показано, что медиана выживаемости больных ГБМ, которым проводили повторную лучевую терапию (в любом варианте, за исключением стандартного), составляла 26–47 недель, а уровень радионекроза не превышал 6–8% [6]. Повторная лучевая терапия может быть предложена избранным пациентам в хорошем соматическом статусе, молодом возрасте и с увеличенным интервалом времени после предшествующей лучевой терапии (как правило, более года). Однако, как и в отношении повторных операций, недостаток данных проспективных исследований, а также высокая вероятность наличия систематической ошибки, обусловленной влиянием субъективных факторов при отборе больных, не позволяют сделать однозначный вывод в отношении преимуществ повторной лучевой терапии больных с рецидивами глиомы высокой степени злокачественности.

Роль химиотерапии в лечении рецидивов злокачественных глиом
Химиотерапия обладает ограниченной эффективностью при рецидивах ГБМ. Частота объективных ответов в клинических исследованиях редко достигала 30% [7]. Поскольку последующие варианты лечения могут существенно искажать результаты рандомизированных исследований, в настоящее время в нейроонкологии в качестве критерия эффективности лечения при рецидиве принято использовать время до прогрессирования (время от начала лечения по поводу рецидива до прогрессирования заболевания) и 6-месячную выживаемость без прогрессирования (PFS-6; число больных в процентах, свободных от прогрессирования в течение 6 месяцев). Не так давно K.V. Ballmann и соавт. подтвердили прогностическую роль PFS-6 у больных с рецидивом ГБМ, продемонстрировав корреляцию PFS-6 и 12-месячной ОВ [8].
Анализ 8 клинических исследований II фазы, в которые в общей сложности были включены 225 пациентов, установил некую границу, а именно 6-месячную выживаемость без прогрессирования 15% и медиану ОВ 9 месяцев, отделяющую эффективный препарат от неэффективного при рецидивах глиом. Достижение этого уровня выживаемости при использовании нового лекарственного средства во II фазе клинического исследования означает его потенциальную эффективность при ГБМ.
После внедрения в клиническую практику комбинированного режима темозоломид+лучевая терапия в 1-й линии поиск адекватных вариантов для рецидивов заболевания стал актуальным как никогда. До недавнего времени в отношении лекарственного лечения существовало две альтернативы: химиотерапия на основе препаратов нитрозомочевины или возвращение к темозоломиду для тех пациентов, у которых прогрессирование или рецидив возникли уже после прекращения приема темозоломида. В исследовании А.А. Brandes мюстофоран в качестве 2-й линии терапии больных, получивших в 1-й линии ХЛТ, приводил к частичным регрессам в 7,1%, стабилизации – в 34,9, PFS-6 – в 22,5%. Не выявлено достоверных различий в ОВ среди больных с метилированным и неметелированным геном MGMT (06 метилгуанин-ДНК-метилтрансфераза) [9]. J. Perry и соавт. предложили использовать постоянный ежедневный прием темозоломида в дозе 50 мг/м2 после прогрессирования заболевания у пациентов, ранее получивших ХЛТ. Результаты промежуточного анализа показали, что в группе пациентов, у которых прогрессирование наступило через 3–6 месяцев от начала адъювантной ХЛТ, применение темозоломида в дозе 50 мг/м2 ежедневно (28 из 28 дней) во 2-й линии привело 23% пациентов к достижению PFS-6. В то же время в группе, где прогрессирование заболевания было зарегистрировано более чем через 6 месяцев адъювантного лечения, PFS-6 наблюдался у 7% пациентов при применении темозоломида в той же дозе, а в группе, где прогрессирование наступало сразу после прекращения адъювантной терапии, PFS-6 составил 35% [10]. Как минимум еще два эскалированных режима приема темозоломида были предложены в качестве альтернативы после прогрессирования вслед за ХЛТ [11]. Эти режимы направлены на увеличение экспозиции и кумулятивной дозы темозоломида с целью преодоления резистентности. Альтернативные режимы дозирования демонстрируют возможность истощения MGMT в опухолевых клетках. К сожалению, до сих пор не существует режима, который обеспечивал бы наилучший баланс между эффективностью и безопасностью. Появление таргетных препаратов возродило надежду на то, что такие режимы будут созданы.
Антиангиогенная терапия при рецидивах ГБМ
Настоящая эра исследований в области антиангиогенной терапии началась с 1971 г. – после публикации J. Folkman своей гипотезы [12]. Но первый антиангиогенный препарат был зарегистрирован FDA (Food and Drug Administration) только спустя 33 года.
Бевацизумаб – гуманизированное иммуноглобулин-G1-моноклональное антитело, специфически ингибирующее VEGF (Vascular endothelial growth factor). В связи с тем что бевацизумаб блокирует циркулирующий в плазме VEGF, а не сам рецептор к VEGF, препарату нет необходимости проникать через гематоэнцефалический барьер для достижения антиангиогенного эффекта в головном мозге.
В доклинических моделях были получены данные о возможной эффективности бевацизумаба при глиальных опухолях [12, 13].
Первые данные о возможной эффективности подобного режима при глиомах высокой степени злокачественности (ВСЗ) опубликовал V. Stark-Vance в 2005 г. Частота объективных ответов в его исследовании составила 43% [14, 15]. W.B. Pope и соавт. сообщили о сходном высоком объективном ответе (50%) в ретроспективном исследовании при рецидивах глиом ВСЗ при использовании бевацизумаба в комбинации с иринотеканом, карбоплатином или этопозидом [16]. Первое же проспективное пилотное исследование II фазы подтвердило высокую непосредственную эффективность бевацизумаба при глиомах ВСЗ. Частичные и полные ответы были зарегистрированы у 57% больных, PFS-6 составила 46% [17].
Таким образом, уровень объективного ответа при использовании бевацизумаба в комбинации с иринотеканом в отношении ранее леченных больных ГБМ оказался чрезвычайно высок.
Следует уделить особое внимание результатам исследования BRAIN (AVF3708g), изучавшеего эффективность бевацизумаба в монотерапии или в комбинации с иринотеканом для больных с рецидивом ГБМ или прогрессированием на фоне предшествующей ХЛТ (рис. 1).
Согласно дизайну исследования, больные в обеих группах получали бевацизумаб в дозе 10 мг/кг каждые 2 недели. Иринотекан назначали в 1-й, 8, 22, 29-й дни 6-недельного цикла в дозе 125 мг/м2 для больных, не получавших и 340 мг/м2 для получавших противосудорожные препараты. Лечение продолжалось до прогрессирования заболевания или появления неприемлемой токсичности.
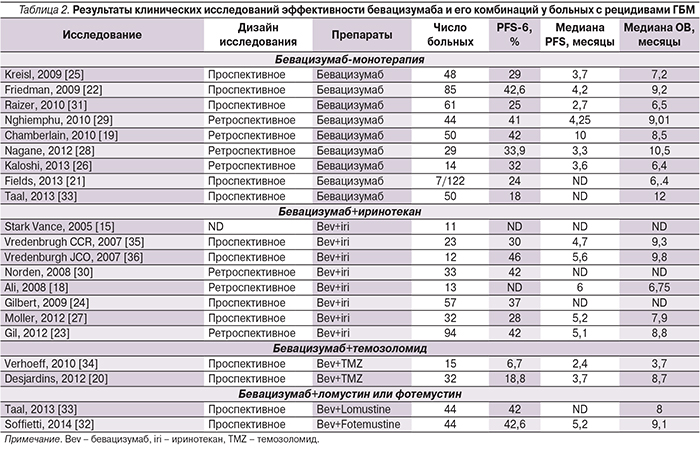
Исследование доказало высокую эффективность бевацизумаба как в монотерапии, так и в комбинации с иринотеканом. По данным исследования, почти половина больных достигли показателя выживаемости без прогрессирования 6 месяцев (50,3% больных, получавших комбинированную терапию, и 42,6% – монотерапию бевацизумабом), медиана ОВ составила 8,7 месяца в группе комбинированного лечения и 9,2 – на фоне монотерапии бевацизумабом. В ходе исследования у пациентов, ответивших на терапию бевацизумабом, наблюдались стабилизация или улучшение нейрокогнитивной функции, а также снижение принимаемой ими дозы стероидов [22]. Исходно более половины пациентов (50,6% пациентов, получавших бевацизумаб, и 52,4% пациентов, получавших бевацизумаб+иринотекан) систематически принимали кортикостероиды. Из них у пациентов с зарегистрированным полным или частичным ответом на терапию бевацизумабом наблюдалось долговременное снижение дозы стероидов (определяемое как способность снизить дозу стероидов по меньшей мере в два раза, как минимум – на половину срока лечения) – для 57% пациентов, получавших бевацизумаб, и 64 % – бевацизумаб+иринотекан. У больных, достигших показателя выживаемости без прогрессирования заболевания 6 месяцев, также наблюдалось долговременное снижение дозы стероидов: 58% – получавших бевацизумаб и 86% – бевацизумаб+иринотекан [37]. В целом терапия бевацизумабом обладала приемлемым профилем безопасности. Позднее было опубликовано множество исследований II фазы, изучавших эффективность бевацизумаба или его комбинаций для больных ГБМ (табл. 2). Во всех исследованиях результаты были весьма обнадеживающими, уровень 6-месячной выживаемости без прогрессирования колебался от 25 до 50%, а частота объективных ответов – от 20 до 61%. Подобные результаты дали основание FDA в ускоренном порядке зарегистрировать в США бевацизумаб для лечения злокачественных глиом.
Ускоренная регистрация FDA позволила множеству больных получить лечение бевацизумабом. С другой стороны, это исключило возможность проведения рандомизированного исследования, сравнивающего химотерапию больных с рецидивами ГБМ с или без бевацизумаба по этическим причинам. Во всех последующих рандомизированных исследованиях с бевацизумабом допускался перекрест. Соответственно, их результаты были скомпрометированы использованием бевацизумаба в контрольной группе. Следствием стало отсутствие данных о влиянии бевацизумаба на ОВ больных ГБМ с рецидивами. Наше исследование было задумано как проспективное с ретроспективным контролем. В качестве контроля выбрана когорта больных, получавших стандартную ХЛТ по поводу ГБМ в то время, когда использование бевацизумаба при рецидивах было невозможно. В когорту, набранную проспективно, включали больных, получавших в качестве 1-й линии ХЛТ с темозоломидом в режиме, аналогичном таковому в контрольной группе. Все больные получили полный курс лечения. После этапа ХЛТ осуществлена монохимиотерапия темозоломидом по 200 мг/м2 в сутки (5 дней). Лечение проводилось максимум до 6 циклов, если прогрессирование не наступало раньше. По основным характеристикам, включая возраст, пол, общесоматический статус, объем хирургического лечения, когорты не отличались друг от друга. Все пациенты в обеих когортах получали одинаковое наблюдение с выполнением контрольной магнитно-резонансной томографии с внутривенным контрастированием каждые 3 месяца, вплоть до прогрессирования заболевания. При рецидиве или прогрессировании в основной группе бевацизумаб применялся во 2-й или 3-й линии терапии в дозе 7,5 мг/кг каждые 3 недели в монотерапии. Медиана ОВ в контрольной группе составила 23 месяца, в группе с бевацизумабом – 32 месяца (р=0,012). Кривые выживаемости представлены на рис. 2.
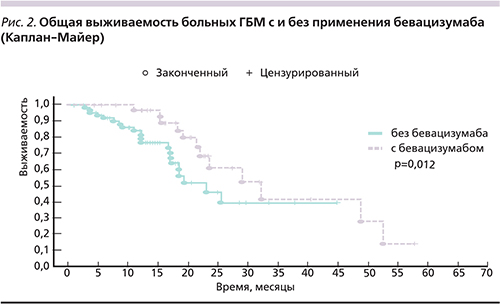
Монотерапия бевацизумабом привела к увеличению ОВ на 9 месяцев, что имеет существенное значение для этой категории больных, у которых еще 10 лет назад выживаемость редко превышала один год.
В группе монотерапии бевацизумабом частота объективных ответов в соответствии с критериями RANO составила 33%. Токсичность проводимой терапии бевацизумабом была низкой. Нежелательные явления 3-й степени и выше заключались в развитии гипертензии (3%), протеинурии (3%), венозного тромбоза (3%). Остальные нежелательные явления носили временный характер, не влияли на ход проводимого лечения и не требовали коррекции дозы или перерыва в лечении. В целом токсический профиль лечения не отличался от токсичности, описанной при применении бевацизумаба при другой онкологической патологии. Новых необычных нежелательных явлений не было.
Медиана выживаемости до прогрессирования на терапии бевацизумабом в различных исследованиях колебалась от 3,3 до 10 месяцев. Часть больных длительное время отвечали на лечение. В нашем исследовании 3 (11%) пациента прожили более года без прогрессирования на терапии бевацизумабом. Такое же число пациентов вовсе не ответили на терапию, и прогрессирование заболевания было зарегистрировано уже после 2 месяцев терапии.
Механизм действия бевацизумаба и других антиангиогенных препаратов остается не до конца изученным. ГБМ характеризуется высоким уровнем экспрессии проангиогенных факторов. Следствием служит появление ненормальных сосудов. Морфологически сосуды при ГБМ характеризуются дезорганизацией, снижением покрытия перицитами, увеличением диаметра сосудов, истончением базальной мембраны [39]. Функционально эти сосуды неполноценны, что ведет к снижению доставки кислорода, уменьшению питания, развитию локальной гипоксии, развитию некрозов. Гипоксия – основная причина продукции ангиогенных факторов. В результате формируется порочный круг, разорвать который и должна антиангиогенная терапия. Одним из основных эффектов применения антиангиогенных препаратов является нормализация сосудистого русла, уменьшение гипоксии [40] и проницаемости сосудов, что в итоге приводит к снижению экспрессии VEGF, уменьшению отека. При этом длительность нормализации сосудистого русла варьируется в широких пределах у различных пациентов [41]. Интересен тот факт, что дольше жили пациенты, у которых в опухоли нарастала перфузия и оксигенация вследствие терапии ингибиторами ангиогенеза [42]. В преклинических моделях обнаружена возможная роль снижения иммуносупрессии, что открывает интересные возможности комбинации антиангиогенной и иммунотерапии больных злокачественными глиомами [43]. Антиагенные препараты могут влиять на стволовые клетки ГБМ, инициирующие и поддерживающие рост опухолевых клеток. Стволовые клетки ГБМ, находящиеся в периваскулярном пространстве, вероятно, регулируются окружающими эндотелиальными клетками, которые могут их поддерживать в недифференцированном состоянии, сохраняющем способность к самообновлению [44]. Таким образом, антиангиогенные препараты воздействуют на ГБМ через множественные пути, которые заключаются и в прямом ингибировании роста опухолевых клеток, и через разрыв взаимодействия между эндотелиальными и стволовыми клетками ГБМ. На антиангиогенную терапию бевацизумабом отвечают от 35 до 50% больных, поиск предикторов ответа на лечение остается одной из самых актуальных и сложных задач. Опубликовано несколько проспективных исследований, целью которых была идентификация биомаркеров ответа на терапию. В исследовании RTOG-8505 выделена подгруппа опухолей, содержащих набор из 10 генов, характерных для ГБМ мезенхимального класса. В этой подгруппе бевацизумаб существенно повлиял на ОВ, увеличив ее с 10,4 месяца в контрольной группе до 20,3 – в группе бевацизумаба (ОР=0,28), причем этот набор предсказывал ответ на терапию бевацизумабом только в качестве первичного лечения, но не при прогрессировании заболевания. Помимо обнаружения потенциально положительных предикторов эффективности применения бевацизумаба, возможно, обнаружены отрицательные предикторы. Первое, что обращает на себя внимание в исследовании RTOG-8505, – это тенденция к снижению ОВ у получавших бевацизумаб больных, в опухоли которых было выявлено метилирование гена MGMT (15,7 месяца против 25; p=0,08). Значимость выявленного биомаркера требует проспективной оценки [45]. Согласно имеющимся наблюдениям, у больных с высоким уровнем экспрессии VEGF повышается вероятность получения радиологического ответа на лечение бевацизумабом.

В том же исследовании обнаружено, что повышение уровня карбоангидразы-9 (маркер гипоксии) коррелировало со снижением 1-годичной выживаемости [46]. Низкий уровень карбоангидразы-9 и высокая экспрессия VEGF ассоциируются с увеличением времени до прогрессирования у больных ГБМ, получавших метрономный этопозид в комбинации с бевацизумабом [47]. При ретроспективной оценке результатов аутопсии больных с рецидивом ГБМ, получавших различные варианты антиангиогенной терапии, включая бевацизумаб, отмечено увеличение количества CD68- и CD11b-опухоль-ассоциированных макрофагов, что коррелировало с ухудшением выживаемости. Рецидивные ГБМ демонстрируют увеличение инфильтрации миелоидной популяции в опухоли и ее инфильтративном окружении. Авторы делают вывод о возможной роли опухоль-ассоциированных макрофагов в развитии резистентности к антиангиогенной терапии [48]. Микроокружение опухоли, иммунные клетки могут быть мишенью для нового класса моноклональных тел – ингибиторов ключевых точек. Информация о возможной роли микроокружения опухоли в развитии резистентности к бевацизумабу позволила выдвинуть гипотезу о возможности восстановления чувствительности к ангиогенной терапии при использовании повторного гамма-облучения. В настоящее время начато исследование, оценивающее эффективность повторной лучевой терапии больных, прогрессирующих на ранее эффективной терапии бевацизумабом, в суммарной очаговой дозе (СОД) 40 Гр. Во время проведения лучевой терапии бевацизумаб вводится в дозе 5 мг/кг каждые 2 недели, паклитаксел – в дозе 60 мг/м2 еженедельно. После завершения лучевой терапии больные переводятся на введение бевацизумаба по 5 мг/кг и паклитаксела 135 мг/м2 каждые 3 недели. В настоящее время оценены 8 больных. Частичный регресс достигнут 3 (37,5%) больными, стабилизация заболевания – 3 (37,5%) и прогрессирование – 2 (25%) пациентами. Медиана времени до прогрессирования составила 4 месяца (рис. 3), причем ответ на терапию 4 больных сохранялся более 6 месяцев.
Медиана ОВ на сентябрь 2015 г. составила 8 месяцев (рис. 4), что почти в 2 раза превышает исторический контроль.
Выводы
Антиангиогенная терапия является эффективным методом лечения рецидивов ГБМ, увеличивающим время до прогрессирования и самое главное – ОВ больных. Современные данные о роли микроокружения в развитии резистентности к ангиогенной терапии открывают новые возможности для ее преодоления. Повторная лучевая терапия с бевацизумабом обладает высокой непосредственной эффективностью и требует оценки на большей популяции больных.



