Среди хронических заболеваний особое место занимает сахарный диабет (СД) благодаря высоким темпам распространения, тенденции к росту числа больных, высокой инвалидизации за счет многочисленных макро- и микрососудистых осложнений, а также сохранения лидирующих позиций среди основных причин смерти. По данным Международной федерации диабета на 2013 г., в мире СД страдают 382 млн человек, а по прогнозам экспертов, в 2035 г. число больных увеличится до 592 млн, 46% больных не знают о своем заболевании [1].
Важно подчеркнуть, что эксперты Всемирной организации здравоохранения выделяют две неинфекционные эпидемии, к которым относятся ожирение и СД 2 типа (СД2).
Большое внимание уделяется изучению роли жировой ткани в развитии инсулинорезистентности (ИР), которая может быть следствием липотоксических эффектов свободных жирных кислот и дисбаланса адипокинов [2]. Среди адипокинов, влияющих на развитие признаков метаболического синдрома, в настоящее время наиболее изучены адипонектин, лептин, фактор некроза опухолей α [3].
Лептин секретируется в основном белой жировой тканью, хотя его продукция обнаружена также и в эпителиальных клетках молочной железы, яичников, бурой жировой ткани, костном мозге, скелетных мышцах, гипофизе, печени [4.]. Основной функцией лептина является осуществление информационной связи между адипоцитами и головным мозгом [5]. Секреция лептина положительно коррелирует с количеством жировой ткани. Роль лептина в регуляции массы тела хорошо изучена у грызунов, однако до сих пор остаются некоторые вопросы относительно его роли в организме человека. Большинство пациентов, страдающих ожирением, имеют высокий уровень лептина, однако это не приводит к снижению массы тела, подтверждая тот факт, что у больных ожирением может развиваться резистентность к воздействию лептина. Лептин препятствует повышению массы тела, воздействуя на меланокортиновую систему гипоталамуса, что ведет к торможению аппетита и потребления пищи. Помимо анорексигенного эффекта в регуляции пищевого поведения лептин способен стимулировать и потребление энергии. Когда поступление энергии превышает потребности организма, происходит повышение уровня лептина, которое препятствует дальнейшему потреблению пищи и повышает расход энергии, что приводит к возникновению отрицательного энергетического баланса и восстановлению энергетического баланса. Возможно, что снижение уровня лептина способствует сохранению энергии вследствие снижения ее затрат. Так, голодание мышей приводило к значимому снижению уровня лептина; аналогичные изменения происходят у пациентов, теряющих массу тела. Данный факт можно объяснить тем, что концентрация циркулирующего лептина пропорциональна степени ожирения, снижение массы тела стимулирует снижение концентрации лептина и, соответственно, снижение потребления энергии [6]. В настоящее время изучены также формы ожирения с «нормальным» и низким уровнем лептина. В случае дефицита лептина заместительная терапия этим гормоном приводит к стойкому уменьшению массы тела.
Важно отметить, что лептин способен как непосредственно влиять на метаболизм глюкозы, так и регулировать действие инсулина на скелетную мускулатуру, печень и жировую ткань. Кроме того, в β-клетках поджелудочной железы происходит подавление секреции инсулина под воздействием данного гормона.
Лептинорезистентность – это термин, используемый для описания парадокса между действием лептина как анорексигенного агента и повышением его уровня у большинства пациентов с ожирением [7]. Механизмы лептинорезистентности включают ряд молекулярных и функциональных нарушений, характеризующихся нарушением транспорта лептина через гематоэнцефалический барьер и ухудшением функции и сигнала рецепторов к лептину. Такие механизмы, как гипоталамическое воспаление, стресс эндоплазматического ретикулума, нарушение аутофагии, вовлечены в процесс развития ассоциированной с ожирением лептинорезистентности, что подтверждают данные различных исследований [8–10]. Известно, что лептин сам по себе играет важную роль в развитии резистентности к своему действию. Так, повышение уровня лептина, характерное для ожирения, снижает транспорт гормона к центральной нервной системе и ухудшает сигнальные свойства лептиновых рецепторов. Развивающаяся резистентность к лептину повышает предрасположенность пациентов к индуцированному диетой ожирению, что также способствует дальнейшему повышению уровня лептина и усугублению существующей лептинорезистентности, образуя порочный круг. Таким образом, высокая концентрация лептина слжит основной причиной ожирения, ее последствием может выступать и ИР.
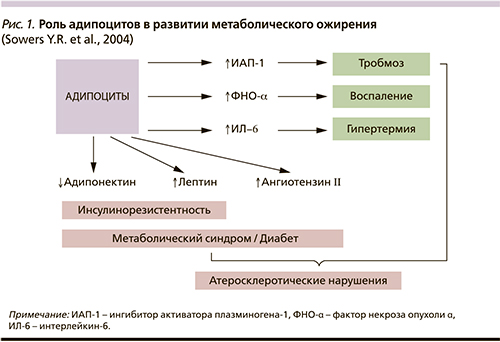
 Другим наиболее изученным адипокином является адипонектин, который продуцируется исключительно клетками жировой ткани и участвует в регуляции углеводного и жирового обменов. Концентрация адипонектина в крови в отличие от лептина отрицательно коррелирует с содержанием жира в организме и индексом массы тела (ИМТ). Адипонектин обладает антиатерогенными, противовоспалительными эффектами, а также подавляет ангиогенез и повышает чувствительность к инсулину. Снижение уровня адипонектина ассоциировано с ИР, гиперинсулинемией и высоким риском развития СД2 вне зависимости от объема жировой массы. Более того, люди с высоким уровнем адипонектина имеют более низкий риск развития СД2. Улучшение гликемического контроля у больных СД2 и уменьшение ИР сопровождается повышением концентрации адипонектина в крови (рис. 1).
Другим наиболее изученным адипокином является адипонектин, который продуцируется исключительно клетками жировой ткани и участвует в регуляции углеводного и жирового обменов. Концентрация адипонектина в крови в отличие от лептина отрицательно коррелирует с содержанием жира в организме и индексом массы тела (ИМТ). Адипонектин обладает антиатерогенными, противовоспалительными эффектами, а также подавляет ангиогенез и повышает чувствительность к инсулину. Снижение уровня адипонектина ассоциировано с ИР, гиперинсулинемией и высоким риском развития СД2 вне зависимости от объема жировой массы. Более того, люди с высоким уровнем адипонектина имеют более низкий риск развития СД2. Улучшение гликемического контроля у больных СД2 и уменьшение ИР сопровождается повышением концентрации адипонектина в крови (рис. 1).
Многофакторный патогенез СД2 диктует необходимость дальнейшего изучения роли различных адипокинов в развитии метаболических процессов, а также способов медикаментозной коррекции секреции гормонов жировой ткани для повышения эффективности терапии при сочетании СД2 и висцерального ожирения.
Согласно принятым в большинстве стран мира консенсусам и стандартам по ведению пациентов с СД2, препаратом первого выбора является метформин. Однако из-за прогрессирующего ухудшения ИР, а также снижения секреции инсулина, частого их сочетания возникает необходимость интенсификации терапии.
Хорошо зарекомендовавшим себя в клинической практике классом пероральных сахароснижающих препаратов являются ингибиторы дипептидилпептидазы-4 (ДПП-4). Вследствие физиологичного сахароснижающего эффекта ингибиторы ДПП-4 используются как наиболее вероятные кандидаты для комбинации с метформином в стартовой терапии или с целью интенсификации терапии больных, уже принимающих метформин.
Ситаглиптин представляет собой высокоселективный, полностью обратимый ингибитор ДПП-4. Наряду с сахароснижающим эффектом ингибиторы ДПП-4 имеют ряд положительных негликемических эффектов, в числе которых отсутствие влияния на массу тела, положительное влияние на липидный профиль, артериальное давление, а также противовоспалительное действие [11, 12].
Однако в доступной нам литературе мы не нашли исследований, посвященных влиянию ситаглиптина на висцеральный жир, а также секрецию гормонов жировой ткани адипонектина и лептина, играющих важную роль в развитии и прогрессировании ИР, основного звена патогенеза СД2.
Цель исследования: оценить влияние комбинированной терапии ситаглиптином и метформином на показатели жирового обмена у пациентов с СД2 и избыточной массой тела.
Материал и методы
Исследование проводилось на кафедре эндокринологии и диабетологии Российской медицинской академии последипломного образования, а также на базе амбулаторного центра № 219 Москвы. Были включены 82 пациента с СД2, не достигшие целевых значений гликированного гемоглобина (HbA1c) на монотерапии метформином и диетотерапии, избыточной массой тела различной степени выраженности, с нарушениями липидного обмена, не принимающие статины. Средний возраст пациентов составил 55,3±9,1 года. В первую группу вошли 42 пациента с СД2 и избыточной массой тела на комбинированной терапии метформин 2000 мг/сут+ситаглиптин 100 мг/сут. До включения в исследование пациенты данной группы получали монотерапию метформином в дозе 1500–2000 мг/сут. Вторую группу составили 40 пациентов на монотерапии метформином в дозе 1500–2000 мг/сут. До включения в исследование пациенты находились на диетотерапии.
Всем пациентам исходно и через 24 недели проведены клинико-инструментальное, а также лабораторное обследования. Определены рост, масса тела, ИМТ, окружность талии (ОТ), соотношение ОТ и окружности бедер (ОБ), глюкоза плазмы натощак и постпрандиально, HbA1c, липидный профиль, содержание адипонектина, лептина, инсулина, проинсулина, С-пептида в крови. Количество и характер распределения жировой ткани оценены методом магнитно-резонансной томографии (МРТ) висцерального жира на уровне L4. Площадь висцерального жира (ПВЖ) ≥130 см2, соотношение ПВЖ/ППЖ (площадь подкожного жира) >0,4 свидетельствовали о наличии висцерального ожирения.
До включения в исследование пациенты подписали информированное согласие, прошли обучение в школе диабета, были обеспечены средствами самоконтроля, дневниками самоконтроля и питания. Сравнительный анализ двух групп показал, что клинические группы больных были сопоставимыми по возрасту, полу, антропометрическим показателям, степени нарушения углеводного и липидного обменов.
Статистический анализ данных проведен с использованием пакета программ Statistica 8. Для оценки различия показателей до и после лечения использован критерий Вилкоксона. Различие динамики в целевой и контрольной группе определено тестом U-критерий Манна–Уитни. Парные взаимосвязи показателей определены коэффициентом ранговой корреляции Спирмена. Для проверки статистических гипотез о виде распределения был применен критерий Шапиро–Уилкса. Величина уровня значимости p принята равной 0,05.
Результаты исследования
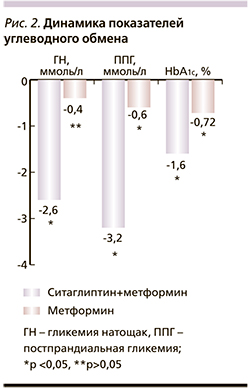
В результате исследования через 24 недели терапии отмечена достоверная положительная динамика всех параметров углеводного обмена. Уровень гликемии натощак в группе, получавшей ситаглиптин+метформин, снизился в среднем на 2,67±2,37 ммоль/л (21%; р<0,001), в то время как в группе, получавшей монотерапию метформином, снижение гликемии натощак не достигло статистической значимости и составило в среднем 0,33±1,6 ммоль/л, (1,45%; р>0,05). Постпрандиальный уровень гликемии в I группе снизился в среднем на 3,26±2,54 (26,35%) ммоль/л (р<0,001), во II – постпрандиальный уровень гликемии снизился в среднем на 0,64±1,2 (5,31%) ммоль/л (p<0,05). Уровень HbA1c снизился в среднем на 1,63±1,31% (18,52%; р<0,001) в I группе (комбинация иДПП-4 с метформином), в то время как во II группе (монотерапия метформином) снижение произошло в среднем на 0,72±0,47%, (8,17%; р<0,001; рис. 2).
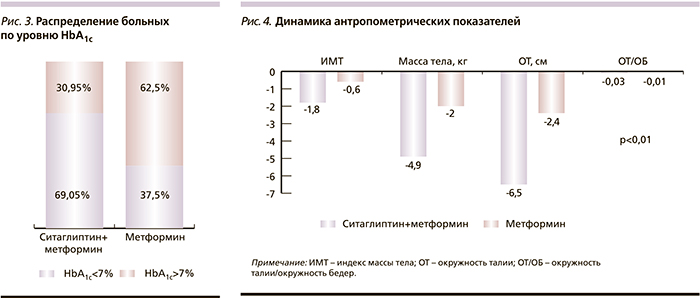
В группе, получавшей ситаглиптин в комбинации с метформином до лечения, уровень HbA1c≤7% имели 11 (26,1%) человек, через 24 недели терапии уровня HbA1c≤7% достигли 29 (69,05%) , в то время как в группе, получавшей монотерапию метформином исходно, уровень НbA1c <7% имели 11 (27,5%) человек, через 24 недели монотерапии метформином HbA1c≤7% имели 15 (37,5%) человек (рис. 3).
Улучшение показателей углеводного обмена происходило на фоне снижения массы тела, ИМТ, ОТ, а также соотношения ОТ/ОБ. Так, через 24 недели на фоне комбинированной терапии ситаглиптина с метформином наблюдалось достоверное снижение уровня ИМТ в среднем на 1,81±1,33, (5,29%; р<0,001), в группе монотерапии метформином – на 0,68±0,35 (1,96%; р<0,001). Масса тела в I группе в среднем снизилась на 4,97±3,22 (5,2%) (р<0,001), во II – на 2±0,94 (2,07%) кг (р<0,001). ОТ уменьшилась в I группе в среднем на 6,52±4,71 (5,88%) (р<0,001); во II – в среднем на 2,42±1,06 (2,18%) см (р<0,001). Соответственно, соотношение ОТ/ОБ уменьшилось в I группе с 0,95±0,06 до 0,91±0,05 (3,28%) (р<0,001), в среднем на 0,03±0,04 (р<0,001), во II группе – с 0,94±0,03 до 0,93±0,03 (0,98%) (р<0,001), в среднем – на 0,009±0,007.
Уменьшение ОТ, а также соотношения ОТ/ОБ указывает на уменьшение количества висцерального жира, а значит, предположительно ИР и гиперинсулинемии, играющих важную роль в развитии метаболического синдрома (рис. 4).
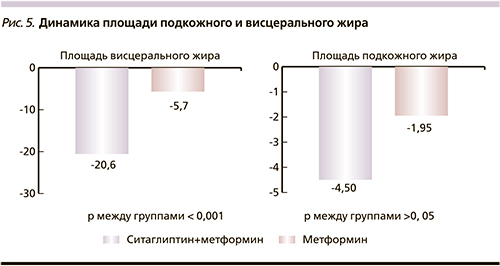
С помощью МРТ подтверждено перераспределение жира за счет уменьшения площади висцерального жира. В группе, получавшей комбинированную терапию ситаглиптином и метформином, ПВЖ уменьшилась в среднем на 20,62±13,54 (7,52%) см2 (р<0,001), в то время как в группе на монотерапии метформином ПВЖ уменьшилась в среднем на 5,77±3,75 (1,76%) см2 (р<0,001).
В динамике ППЖ также наблюдалась положительная динамика в обеих группах, однако статистически значимых различий между группами не выявлено. ППЖ в I группе уменьшилась в среднем на 4,51±14,43 (1,69%) (p<0,05), во II – на 1,95±1,05 (0,46%) см2 (p<0,05; рис. 5).
Соотношение ПВЖ/ППЖ достоверно уменьшилось в I группе на 0,18±0,24 (15,26%), во II – на 0,008±0,008 (1,14%), что также свидетельствует о более выраженном уменьшении именно висцерального жира в группе, использовавшей комбинацию ситаглиптина с метформином.
Корреляционный анализ показал зависимость между динамикой ПВЖ на уровне L4 с динамикой массы тела (r=0,58; p<0,05), динамикой ИМТ (r=0,58; p<0,05), ОТ (r=0,55; p<0,05), соотношением ОТ/ОБ, (r=0,49; p<0,05), динамикой уровней лептина (r=0,33; p<0,05), адипонектина (r=-0,54; p<0,05), HbA1c (r=0,34; p<0,05).
Как видно из корреляционно-регрессионного анализа, дополнительный терапевтический эффект в отношении гликемического контроля у больных СД2 и ожирением связан с уменьшением количества висцерального жира. Корреляционная зависимость между динамикой ПВЖ (L4) и динамикой ОТ, соотношением ОТ/ОБ может свидетельствовать о перераспределении жира в организме, а также о необходимости измерения ОТ, ОТ/ОБ у больных СД2 и ожирением для диагностики висцерального ожирения.
Особый интерес представляло изучение секреции гормонов жировой ткани наряду с уменьшением депо висцерального жира. В нашем исследовании на фоне терапии ситаглиптином и метформином отмечено более выраженное снижение среднего уровня лептина с 23,87±13,43 до 16,49±9,63 (30,47 %) нг/мл, (p<0,001), в то время как, на монотерапии метформином средний уровень лептина снизился с 23,87±9,61 до 22,66±9,61 (5,41%) нг/мл, (p<0,001). Динамика уровня лептина положительно коррелировала с динамикой HbA1c (r=0,32; p<0,05), массы тела (r=0,45; p<0,05), ОТ (r=0,43; p<0,05), ОТ/ОБ (r=0,29; p<0,05), инсулина (r=0,35; p<0,05), ПВЖ (r=0,33; p<0,05) и ППЖ (r=0,41; p<0,05), что не противоречит данным литературы.
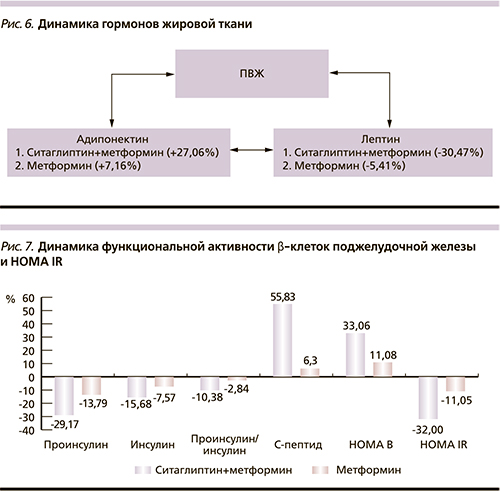
В результате работы мы исследовали также динамику уровня адипонектина. В обеих группах исходно уровень адипонектина был ниже референсных значений. Через 24 недели терапии в исследуемой группе, получавшей комбинацию ситаглиптина с метформином, уровень адипонектина увеличился на 1,95±1,56 (27,06%; p<0,001), а в группе, получавшей монотерапию метформином, увеличение составило 0,49±0,26 (7,16%; p<0,001; рис. 6).
В исследовании выявлена отрицательная корреляционная зависимость между динамикой уровня адипонектина и динамикой уровня HbA1c (r=-0,39; p<0,05), а также ПВЖ (r=-0,54; p<0,05), ОТ (r=-0,62; p< 0,05), ОТ/ОБ (r=-0,34; p< 0,05), что также соответствует данным литературы.
Известно, что секреция этого гормона снижена при СД2, а ее восстановление сопровождается улучшением углеводного обмена при СД, снижением атерогенеза и замедлением прогрессирования сосудистых осложнений диабета.
Анализ липидного профиля показал достоверное снижение всех показателей и повышение ЛПВП (липопротеиды высокой плотности) в обеих группах, однако статистически значимые различия между группами отмечались только в динамке ЛПНП (липопротеиды низкой плотности) и ТГ (триглицериды). Уровень ЛПНП в I группе снизился на 0,78±0,5 (17,43%)ммоль/л (p<0,001), во II – на 0,37±0,17 (9,63%) ммоль/л (р<0,001); в I группе уровень ТГ снизился на 1,33±1,16 (28,15%) ммоль/л (p<0,001), во II группе – на 0,63±0,39 (15,19%) ммоль/л, (р<0,001).
Изучение функциональной активности β-клеток поджелудочной железы показало достоверное увеличение в I группе индекса HOMA (Homeostasis Model Assessment) β в среднем на 23,4±22,6 (33,06%) усл.ед. (р<0,0001), во II группе отмечено недостоверное повышение данного показателя в среднем на 4,8±16,3 (11,08%) усл.ед. (р>0,05).
Кроме того, получено статистически значимое снижение уровня базального инсулина в обеих группах. Так, при приеме ситаглиптина в сочетании с метформином уровень инсулина снизился на 3,45±5,26 (15,68%) Ме/мл (p<0,001), в то время как при использовании монотерапии метформина снижение базального инсулина произошло на 1,63±2,17 (7,57%) мкМе/мл (p<0,001).
До лечения в обеих группах отмеченео повышение уровня проинсулина, через 6 месяцев терапии мы получили достоверное снижение уровня проинсулина в I группе (ситаглиптин/метформин) на 2,93±3,02 (29,17%) пмоль/л (p<0,001), во II группе (метформин) – на 1,26±1,1 (13,79%) пмоль/л (p<0,001).
Также на фоне терапии ситаглиптином в комбинации с метформином отмечено статистически значимое уменьшение соотношения проинсулина к инсулину на 0,19±0,79 (10,38%; p<0,05), что свидетельствует об улучшении качества инсулина, в то время как в группе монотерапии метформином уменьшение данного соотношения было недостоверным на 0,03±0,2 (2,84%; p>0,05).
Важно отметить, что уровень С-пептида увеличился в результате терапии ингибитором ДПП-4 в сочетании с метформином на 1,42±1,62 (55,83%; р<0,0001), а в группе, получавшей монотерапию метформином, уровень С-пептида увеличился в среднем на 0,16±0,13 (6,3%; p<0,05), что может быть следствием снижения глюкозо- и липотоксичности, а также следствием непосредственного влияния ситаглиптина на функцию β-клеток поджелудочной железы В динамике индекса ИР тканей (HOMA IR – Homeostasis Model Assessment of Insulin Resistance) статистически значимых различий между группами мы не получили, произошло достоверное снижение индекса в обеих группах: в I группе на 2,36±2,49 (32%) усл.ед. (р<0,0001), во II группе – на 2,10±2,52 (11,05%) усл.ед. (р<0,0001; рис. 7).
Обсуждение
В нашем исследовании изучено влияние ситаглиптина в комбинации с метформином и монотерапии метформином на углеводный и жировой обмены у пациентов, нуждавшихся в интенсификации терапии. Согласно полученным данным, через 24 недели положительная динамика уровня HbA1c сопровождалась достоверным снижением средних значений гликемии натощак и постпрандиальной гликемии в I группе, в то время как во II группе (на монотерапии метформином) снижение уровня гликемии не достигло статистической значимости.
Важным преимуществом в нашем исследовании оказалось следующее: несмотря на распространенное мнение о нейтральном влиянии ингибиторов ДПП-4 на массу тела, мы показали, что при добавлении ситаглиптина к метформину наблюдалось более выраженное снижение массы тела (ИМТ), уменьшение депо висцерального жира по сравнению с группой пациентов, где использовалась монотерапия метформином. Каков «чистый» вклад сочетания ингибитора ДПП-4+метформина, а каков – изменения стиля жизни в обеих группах, определить в данной работе невозможно, поэтому требуются дальнейшие проспективные исследования с количественным учетом энергозатрат.
Особый интерес представляло изучение гормонов жировой ткани адипокинов, а именно, лептина и адипонектина. Известно, что секреция лептина положительно коррелирует с количеством жировой ткани, что также было показано в нашей работе. Нарушение действия лептина при ожирении может быть ведущим фактором в развитии ИР и нарушении метаболизма жира и глюкозы. В нашей работе на фоне комбинированной терапии ситаглиптином и метформином наблюдалось снижение уровня лептина на 30,47%, а в группе монотерапии метформином – на 5,41%.
В исследовании изучена динамика еще одного адипокина – адипонектина. Через 24 недели терапии в группе, получавшей комбинацию ситаглиптина с метформином, содержание адипонектина в крови увеличилось на 27,06%, а в группе, получавшей монотерапию метформином, на 7,16%. Адипонектин может являться дополнительной мишенью терапевтического воздействия благодаря его способности к уменьшению ИР свойственной больным СД2 и избыточной массой тела, а также благодаря его противовоспалительным, антидиабетическим и антисклеротическим эффектам.
Корреляционный анализ показал взаимосвязь гликемического контроля у больных СД2 и ожирением с уменьшением количества висцерального жира, восстановлением секреции гормонов жировой ткани.
Кроме того, в исследовании показано достоверное улучшение функциональной активности β-клеток поджелудочной железы на фоне комбинированной терапии ситаглиптином и метформином, что подтверждалось повышением индекса HOMA β, уменьшением соотношения проинсулин/инсулин, в то время как в группе монотерапии метформином изменение данных показателей не достигло статистической значимости.
Заключение
Таким образом, в нашем исследовании на фоне комбинированной терапии ситаглиптином и метформином по сравнению с монотерапией метформином получены более выраженные гликемические и негликемические эффекты. Уменьшение площади висцерального жира, по данным МРТ, сопровождалось восстановлением секреции гормонов жировой ткани (адипонектина, лептина), следствием чего стало улучшение показателей углеводного и жирового обменов. Ситаглиптин рассматривается нами как препарат, способствующий снижению массы тела, несмотря на распространенное мнение о нейтральном влиянии на массу тела. Работа продемонстрировала, что уменьшение депо висцерального жира играет ключевую роль в коррекции нарушений углеводного обмена, а восстановление таких показателей, как HOMA IR и HOMA β, может свидетельствовать об обратимости заболевания.


