За последние десятилетия в лечении диссеминированного колоректального рака (КРР) достигнут значительный прогресс. Выросло число лечебных опций: от монотерапии 5-фторурацилом до комбинированного подхода с включением хирургического этапа. Среди больных метастатическим раком выделены пациенты с изолированным поражением печени, которым проведение системной химиотерапии (ХТ) и оперативного лечения позволило достичь 5-летней выживаемости на 36–43% [1–3]. Применение предоперационной ХТ в этой группе больных позволяет повышать радикальность операции за счет уменьшения размеров очагов и эрадикации микрометастазов. Кроме того, оценка лечебного патоморфоза в опухоли делает выбор послеоперационной тактики более обоснованным. Однако многие вопросы периоперационной ХТ остаются спорными и требуют дальнейших разработок.
Материал и методы
 В настоящее исследование включены 60 больных КРР с метастазами в печени в возрасте от 27 до 75 лет; среди них 27 мужчин и 33 женщины. При отборе больных ориентировались на следующие критерии резектабельности метастазов в печени: сохранение не менее 25% паренхимы печени, сформированной как минимум двумя смежными сегментами, с адекватным желчеотведением и сосудистым кровоснабжением. Данные параметры соответствовали современным мировым рекомендациям [4, 5].
В настоящее исследование включены 60 больных КРР с метастазами в печени в возрасте от 27 до 75 лет; среди них 27 мужчин и 33 женщины. При отборе больных ориентировались на следующие критерии резектабельности метастазов в печени: сохранение не менее 25% паренхимы печени, сформированной как минимум двумя смежными сегментами, с адекватным желчеотведением и сосудистым кровоснабжением. Данные параметры соответствовали современным мировым рекомендациям [4, 5].
Большинству (75%) больных поставлен диагноз первично метастатического процесса, и в плане комбинированного лечения на первом этапе выполнено удаление первичной опухоли.
У 15 (25%) пациентов метастазы в печени были выявлены после резекции кишки в сроки от 6 до 63 месяцев, в среднем через 24±4,5 месяца. По данным морфологического исследования, преобладала умеренно дифференцированная аденокарцинома (70%); высоко- и низкодифференцированные варианты встречались значительно реже (13,4 и 8,3% соответственно). Адъювантная ХТ, завершенная более чем за 6 месяцев до выявления метастазов, была проведена 9 больным.
В большинстве (68,3%) случаев отмечено билобарное поражение печени. Размеры метастазов варьировались от 0,3 до 14,5 см, а число метастазов – от 1 до 15 (в среднем 4,7±0,4). На момент включения в исследование все больные имели удовлетворительное состояние (ECOG – Eastern Cooperative Oncology Group 0–1), нормальные показатели функции кроветворения, печени и почек, отсутствовала серьезная сопутствующая патология.
В плане комбинированного лечения всем больным проведена предоперационная двукомпонентная ХТ и хирургическое лечение. Послеоперационную ХТ получили 46 (76,7%) больных. Средняя продолжительность пери-операционной ХТ составила 6,3±0,21 месяца (в среднем 3,6±0,11 до и 2,98±0,16 месяца после операции), 14 (23,3%) больных после резекции печени находились под динамическим наблюдением без дополнительной противоопухолевой терапии.
Результаты и обсуждение
У 54 (90%) из 60 включенных в исследование больных КРР проведена предоперационная ХТ с включением фторпиримидинов и оксалиплатина (режимы XELOX, CAPOX, FOLFOX); 6 (10%) больных получили режим FOLFIRI. Исходя из подтвержденных данных о равной эффективности оксалиплатин- и иринотекан-содержащей ХТ эффект лечения оценен в общей группе больных, согласно критериям RECIST (Response Evaluation Criteria In Solid Tumors). Объективный эффект отмечен в 33 (55%) случаях. Стабилизация заболевания в среднем в течение 3,5±0,16 месяца установлена в 23 (38,3%) случаях, причем в 10 (43,5%) из них отмечено уменьшение размеров измеряемых очагов в среднем на 21,4%. Максимальный эффект предоперационной ХТ достигнут у 23 (63,9%) пациентов с билобарным поражением печени, получавших комбинации с оксалиплатином. Прогрессирование заболевания на фоне предоперационной ХТ установлено у 4 (6,7%) больных.
Повышенный уровень ракового эмбрионального антигена (РЭА) до начала предоперационной ХТ имели 44 (73,3%) больных. Успех предоперационной ХТ сопровождался снижением уровня РЭА у всех 24 больных с объективным эффектом и у 11 (64,7%) из 17 больных со стабилизацией. Необходимо отметить, что при частичном регрессе метастазов в 10 случаях отмечена нормализация маркера. В работе подтверждена описанная при метастатическом КРР прямая корреляция между эффективностью ХТ и уровнем РЭА [5]. Целесообразна динамическая оценка РЭА на фоне предоперационной ХТ, которая может служить маркером химиочувствительности опухоли.
У 60 больных оценены побочные эффекты 334 курсов предоперационной ХТ: 220 курсов в режимах XELOX и CAPOX (n=45); 72 курса FOLFOX (n=9) и 42 курса FOLFIRI (n=6).
В большинстве случаев нежелательные явления были клинически незначимыми и не превышали I–II степеней. Побочные эффекты III–IV степеней сопровождали 16 (4,8%) курсов лечения 12 (20%) больных. Наибольшее клиническое значение имели нейтропения, диарея и ладонно-подошвенный синдром. Случаев прекращения ХТ в связи с неприемлемой токсичностью не отмечено. Нежелательные явления не повлияли на сроки проведения хирургического вмешательства.
Объем операции определен с учетом исходной распространенности болезни, данных интраоперационного ультразвукового исследования, что соответствует международным рекомендациям [6–8]. Обширные резекции печени выполнены 40 (66,7%) больным; экономные резекции – 20 (33,3%). Для увеличения размеров гипотрофированной левой доли 4 (6,7%) больным предварительно выполнена механическая эмболизация правой ветви воротной вены. Необходимо отметить, что дополнительные вмешательства на контралатеральной доле печени проведены 29 (48,3%) пациентам: в 19/40 и 10/20 случаях при обширных и экономных резекциях соответственно.
Эффективная предоперационная ХТ 52 (86,7%) больных КРР позволила провести R0-резекцию метастазов в печени. Остальным 8 больным выполнены R1(n=5)- и R2(n=3)-резекции. Послеоперационные осложнения отмечены у 20 (33,3%) больных. Наибольшее клиническое значение имели печеночная недостаточность, формирование желчных свищей, абсцессов и кровотечение из зоны резекции печени. Летальных исходов не отмечено. Полученные результаты сопоставимы с литературными данными, согласно которым частота послеоперационных осложнений варьируется от 16 до 47% [1, 9, 10].
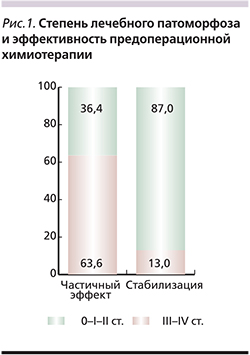
Для анализа эффективности предоперационной ХТ оценена выраженность лечебного патоморфоза в метастазах печени. Степень лечебного патоморфоза определена в каждом опухолевом узле в соответствии с классификацией Г.А. Лавниковой, Е.Ф. Лушникова [11]. У 55 (91,7%) больных наблюдали патоморфологический ответ разной степени выраженности; у остальных 5 (8,3%) признаков патоморфоза не было. Лечебный патоморфоз II–III cтепеней наблюдали у 34 (56,6%), а лечебный патоморфоз IV степени – у 4 (6,8%). В работе выявлена статистически значимая корреляция между степенью лечебного патоморфоза и эффективностью предоперационной ХТ. При частичном эффекте патоморфоз III–IV степеней отмечен в 63,6%; при стабилизации – в 13% (р=0,01) случаев (рис. 1).

Безопасность применения двукомпонентных режимов предоперационной ХТ подтверждена морфологическим исследованием ткани печени на удалении от опухолевых узлов. Лекарственные микрососудистые повреждения в виде синусоидальной дилатации II–III установлены у 17 (31,5%) больных после оксалиплатин-содержащей ХТ. Жировой гепатоз II–III степеней наблюдали в 8 (14,8%) случаях. Двоих больных этой группы применение ХТ в режиме FOLFIRI привело к активному стеатогепатиту. Выявленные изменения не отразились на послеоперационном периоде. Большинство больных получили оксалиплатин-содержащие режимы предоперационной ХТ, что объясняет преобладание микрососудистых повреждений. Полученные результаты согласуются с данными литературы [10, 12–15].
Предложенный алгоритм лечения позволил достичь высоких показателей выживаемости в изученной группе больных. Медиана времени без прогрессирования составила 28,8 месяца (95% ДИ – 17,2–40,4). Однолетняя и 3-летняя выживаемость без прогрессирования – 84,1% (95% ДИ – 74,6–93,6) и 46,7% (95% ДИ – 32,4–61) соответственно. Медиана общей выживаемости составила 49,1 месяца (95% ДИ – 36,4–61,8). Однолетняя, 3-летняя и 5-летняя общая выживаемость достигла 100%; 70,4 (95% ДИ – 58,6–82,2) и 48% (95% ДИ – 33,9–62,1) соответственно. Полученные цифры оказались несколько выше представленных в литературе [1, 16–18].
Для выявления больных, для которых применение двухкомпонентных режимов ХТ будет иметь наибольшую выгоду, целесообразно определение факторов прогноза. В нашей работе оценено прогностическое значение 32 клинико-морфологических характеристик. Среди них потенциальное отрицательное влияние на прогноз имели локализация первичной опухоли в прямой кишке; метастазы в регионарных лимфоузлах на момент диагноза (N+); билобарные метастазы в печени; повышенный после завершения предоперационной ХТ уровень РЭА (>5 нг/мл); отсутствие объективного эффекта; отсутствие или минимальный патоморфологический ответ (0, I, II степени). Данные результаты нашли подтверждение в ряде исследований [2, 18, 19].
При однофакторном анализе значимое влияние на выживаемость больных оказала выраженность лечебного патоморфоза. Достижение лечебного патоморфоза III–IV степеней в метастазах печени достоверно улучшало выживаемость больных; p=0,005 (рис. 2а). Показатели 3- и 5-летней общей выживаемости достигли соответственно 100 и 78,9% (95% ДИ 62,6–95,2) при лечебном патоморфозе III–IV степеней по сравнению с 52,7% (95% ДИ 36,3–69,1) и 25,1% (95% ДИ 10,8–39,4) при 0, I и II степенях. Сравнение кривых времени без прогрессирования выявило аналогичные закономерности; p=0,006 (рис. 2б).
Заключение
Достигнутые высокие показатели выживаемости, в т.ч. у больных КРР с множественными метастазами в обеих долях печени, свидетельствуют об онкологической оправданности комбинированного лечения, сочетающего хирургическое вмешательство с периоперационной ХТ. При планировании операции основной целью служит достижение R0-резекции метастазов. Наибольшее прогностическое значение имеют выраженность лечебного патоморфоза, уровень РЭА перед хирургическим лечением и число пораженных долей печени. Выделение ряда клинико-морфологических факторов способствует индивидуализации прогноза жизни больных.


